Вода – самое распространенное соединение на Земле. Вода является универсальным растворителем. Природные воды, находясь в контакте с почвенным покровом, атмосферой и недрами земли, способны растворять как минеральные, так и органические вещества. В природных водах, кроме этого, находятся живые организмы, различные микроорганизмы и растения. Поэтому природные воды называют естественными растворами. На состав природных вод влияет и работа промышленных предприятий.
Ежегодный мониторинг поверхностных вод водотоков Тюменской области показывает их загрязненность [1]. Основная часть загрязнений поступает в водоисточники транзитом из соседних областей [2]. Качество воды в водотоках зависит и от несанкционированных сбросов сточных вод промышленными предприятиями. Качество воды в водных объектах на территории г. Тюмени согласно гигиеническим нормативам приведено в табл. 1 [3].
Таблица 1
Сведения о превышениях нормативов качества воды
|
Показатель |
р. Тюменка |
оз. Песьяное |
руч. Ключи |
р. Бабарынка |
ПДКк (ПДУ) |
|
рН |
7,9 |
8,00 |
7,67 |
7,81 |
6,5–8,5 |
|
Взвешенные вещества |
117,8 |
17 |
16 |
4,0 |
Не более 30 мг/дм3 в межень |
|
Сухой остаток |
1087,5 |
672 |
568 |
202 |
1000 |
|
ХПК |
91,6 |
27 |
5 |
37 |
30 |
|
БПК полн. |
47,2 |
6,08 |
3,89 |
6,11 |
6 |
|
Аммоний-ион |
6,3 |
0,61 |
1,51 |
0,71 |
1,5 |
|
Железо общ. |
1,6 |
0,22 |
0,088 |
0,089 |
0,3 |
|
Марганец |
1,9 |
0,9 |
0,33 |
0,13 |
0,1 |
|
Медь |
6,3 |
2,5 |
5,3 |
1,57 |
1 |
|
Нефтепродукты |
0,38 |
0,31 |
0,019 |
0,17 |
0,3 |
Наиболее опасны в природных и сточных водах ионные комплексные формы тяжелых металлов [4]. Такими ионами металлов в первую очередь являются медь, марганец и железо. С экономической точки зрения для очистки вод целесообразно использовать ионообменную сорбцию. Этот метод применяется для глубокой очистки вод.
Десорбция ионов металлов и регенерация катионитов способствует полному извлечению тяжелых металлов и получению продуктов регенерации в виде индивидуальных солей металлов.
Целью настоящей работы является исследование условий сорбции и десорбции ионов меди, марганца и железа из модельных водных растворов катионитом СФ-5.
Материалы и методы исследования
Исследование условий сорбции и десорбции ионов меди, марганца и железа проводили в динамических условиях на катионите СФ-5 при температуре 25 °C. Сорбция проводилась на модельных 0,2 М растворов для хлоридов меди и марганца, 0,3 М раствора хлорного железа. Десорбции подвергались 5 мг-экв ионов железа, меди и марганца. Растворы заданной концентрации и химического состава пропускались со скоростью фильтрации 1 мл/см2∙мин на 6 г катионита. Содержание ионов в фильтрате измерялось по стандартным методикам [5].
По данным химического анализа строились выходные кривые сорбции, интегральные и дифференциальные кривые десорбции, которые использовались для расчета параметров процесса: эффективности регенерации (η), коэффициентов весового и объемного распределения (Kd и KV), констант элюирования (Е).
Результаты исследования и их обсуждение
Катионит СФ-5 получен сополимеризацией стирола и дивинилбензола с последующей обработкой треххлористым фосфором, затем омылением и окислением. Катионит в своей структуре в качестве ионогенных групп содержит фосфоновые группы – РО(ОН)2, степень ионизации характеризуется показателями рК1 = 3,1 и рК2 = 8,4; обменная емкость 15,84 моль/г. Это указывает на то, что сорбция ионов катионитом будет определяться значениями рН исходных растворов. На рис. 1 представлены выходные кривые ионов железа (III), меди (II) и марганца (II).
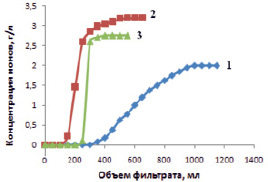
Рис. 1. Выходные кривые сорбции катионов Fe3+ (1), Cu2+ (2), Mn2+ (3) из хлоридных растворов катионитом СФ-5 в NH4+ – форме. Навеска ионита 6 г
Выходные кривые сорбции катионов железа, меди и марганца имеют обычный вид. Величина сорбируемости (моль/г) из водных растворов составила: Fe3+ = 23; Cu2+ = 8,8; Mn2+ = 9,2. Сорбируемость по своей величине для MeCl2 не приближается к значению обменной емкости катионита. Это указывает на сорбцию меди и марганца в виде простых катионов в соответствии с суммарной реакцией ионного обмена:
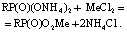
При сорбции катионов железа сорбируемость, по своей величине превышает обменную емкость катионита. Это можно объяснить тем, что железо сорбируется в виде комплексных ионов 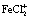 и FeCl2+. Последнее подтверждается сорбцией одновременно с металлом и хлор-ионом.
и FeCl2+. Последнее подтверждается сорбцией одновременно с металлом и хлор-ионом.
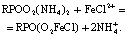
Полученные результаты исследования сорбции катионов железа (III), меди (II) и марганца (II), представленные на рис. 1, показывают, что на стадии сорбции наблюдаются различия. Эти различия можно использовать для выбора условий извлечения, концентрирования и разделения с использованием катионита СФ-5. Легко решаются задачи по разделению и очистке меди и марганца от примеси железа на стадии сорбции. На рис. 2 приводятся данные балансового опыта по разделению ионов меди и железа с помощью 6 г катионита СФ-5 в  -форме в растворе 0,2М CuCl2 + 0,3M FeCl3.
-форме в растворе 0,2М CuCl2 + 0,3M FeCl3.
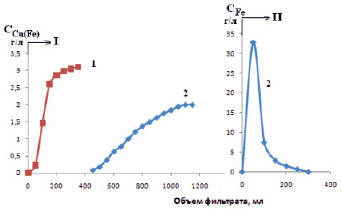
Рис. 2. Разделение ионов меди (1) и железа (2) в растворе 0,2М CuCl2 + 0,3M FeCl3 с применением катионита СФ-5 в NH4+-форме. Растворы: I – исходный; II – 3,0М HCl
Для десорбции катионов и регенерации катионитов в промышленных установках используют растворы кислот и их аммонийных солей. На стадии десорбции катионов металлов можно получить важные технологические соединения.
На рис. 3 представлены сравнительные данные по десорбции исследованных ионов растворами соляной, серной и фтористоводородной кислот. При десорбции расходуется незначительное количество кислот, количество которых уменьшается с возрастанием концентрации вымывающего раствора. Повышение концентрации кислоты в десорбирующем растворе способствует протонированию ионогенных групп катионита и сдвигу за счет этого реакции ионного обмена
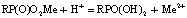
в правую сторону.
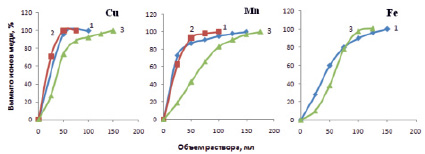
Рис. 3. Вымывание катионов Cu2+, Mn2+, Fe3+ из катионита СФ-5 3М растворами кислот: HCl (1), H2SO4 (2) и HF (3)
Из результатов рис. 3 для ионов меди и марганца более эффективны растворы HCl и H2SO4, чем HF. В присутствии соляной и серной кислот ионы меди и марганца образуют комплексные хлоридные и сульфатные анионы, что и объясняет лучшую десорбцию этих ионов. Наоборот, из-за большой прочности фторидных комплексов железа HF оказывается эффективнее при десорбции ионов железа. Железо десорбируется из катионита только 3,0 и 2,0 М растворами соляной кислоты. Такое различие поведения объясняется образованием прочных комплексных соединений железа с ионогенными группами катионита.
Рассмотренные данные по десорбции ионов меди, марганца и железа при десорбции показывают, что имеющие различия можно использовать для решения задач по разделению на стадии десорбции.
Таблица 2
Основные свойства слоя катионита в колонке
|
Катионит |
Vобщ., мл |
Vп.з., мл |
Vэф., мл |
ε, мл |
dп, г/мл |
|
СФ-5 в NH4+ |
22,0 |
1,6 |
20,5 |
0,58 |
0,51 |
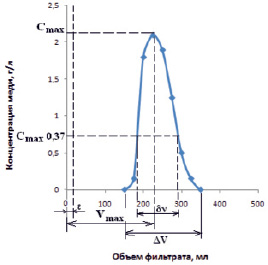
Рис. 4. Кривая десорбции ионов меди из катионита СФ-5 0,1М раствором соляной кислоты
В табл. 2 приведены расчетные данные эффективности регенерации η0,9, относится к десорбции 90 % от первоначально сорбированных ионов. Взятые для исследования соляная, серная и фтористоводородная кислоты отличаются различной концентрацией ионов водорода. Степень диссоциации 0,1 н растворов соляной, серной и фтористоводородной кислот равна соответственно 0,9; 0,6 и 0,08 [6]. Значения эффективности регенерации, объемные и весовые коэффициенты распределения, константы элюирования и другие показатели рассчитаны по уравнениям [7]:
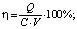 (1)
(1)
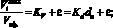 (2)
(2)
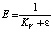 , (3)
, (3)
где η – эффективность десорбции; Q – количество десорбированного иона, моль/г; C – концентрация реагента в десорбирующем растворе, моль/дм3; V – расход раствора, см3; Vimax – объем десорбирующего раствора, пропущенного до появления максимума кривой, см3.
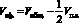 , (4)
, (4)
Vэф. – эффективный объем колонки, см3; Vп.з. – объем, соответствующий первоначальной загрузке колонки, см3; Vобщ. – общий объем колонки, см33; KV и Kd соответственно объемный и весовой коэффициенты распределения; dи – плотность слоя ионита (г сухого ионита на 1 см3 слоя); ε – доля свободного объема колонки (объем раствора на единицу объема колонки); Е – константа элюирования.
Характеристика слоя катионита СФ-5 в колонке приведена в табл. 2. Объяснение обозначений дано на дифференциальной кривой десорбции ионов меди, представленной на рис. 4.
Результаты расчета констант и показателей процесса десорбции представлены в табл. 3–5. Эти данные можно использовать в технологических расчетах при определении высоты слоя катионита в аппарате по значению высоты эквивалентной тарелки.
Таблица 3
Показатели процесса десорбции катионов меди, марганца, железа раствором соляной кислоты
|
Концентрация кислот, моль/л |
Эффективность десорбции η0,9 |
Объемный коэффициент распределения KV |
Весовой коэффициент распределения Kd |
Константа элюирования Е |
||||
|
Cu2+ |
Mn2+ |
Cu2+ |
Mn2+ |
Cu2+ |
Mn2+ |
Cu2+ |
Mn2+ |
|
|
0,1 0,3 0,5 1,0 2,0 3,0 |
15,79 11,54 9,00 4,50 4,50 3,75 |
14,52 10,72 7,50 4,50 2,81 2,60 |
12,07 4,0 3,2 2,9 2,1 2,1 |
10,1 8,0 4,8 2,9 1,8 1,0 |
26,5 8,3 6,7 6,0 4,4 4,4 |
21,0 16,7 10,0 6,0 3,8 2,0 |
0,07 0,22 0,27 0,29 0,38 0,38 |
1,0 1,6 1,9 5,3 4,1 11,1 |
Таблица 4
Показатели процесса десорбции катионов меди, марганца, железа раствором серной кислоты
|
Концентрация кислот, моль/л |
Эффективность десорбции η0,9 |
Объемный коэффициент распределения KV |
Весовой коэффициент распределения Kd |
Константа элюирования Е |
||||
|
Cu2+ |
Mn2+ |
Cu2+ |
Mn2+ |
Cu2+ |
Mn2+ |
Cu2+ |
Mn2+ |
|
|
0,1 0,3 0,5 1,0 2,0 3,0 |
30,00 16,67 12,86 10,00 5,00 7,50 |
6,21 3,75 3,60 3,00 2,25 2,14 |
5,30 4,00 3,00 1,50 1,30 0,80 |
11,40 4,20 3,20 2,60 1,20 0,80 |
11,00 8,30 6,30 3,00 2,70 1,70 |
23,80 8,80 6,70 5,40 2,30 1,70 |
0,17 0,22 0,32 0,44 0,54 0,75 |
0,08 0,21 0,27 0,31 0,54 0,75 |
Таблица 5
Показатели процесса десорбции катионов меди, марганца, железа раствором фтористоводородной кислоты
|
Ион |
Концентрация кислот, моль/л |
Эффективность десорбции η0,9 |
Объемный коэффициент распределения KV |
Весовой коэффициент распределения Kd |
Константа элюирования Е |
|
Cu2+ |
0,1 0,3 0,5 1,0 2,0 3,0 |
4,29 6,38 4,50 4,50 2,65 2,14 |
12,07 4,00 3,20 2,90 2,10 2,10 |
26,5 8,3 6,7 6,0 4,4 4,4 |
0,07 0,22 0,27 0,29 0,38 0,38 |
|
Mn2+ |
0,1 0,3 0,5 1,0 2,0 3,0 |
6,21 3,75 3,60 3,00 2,25 2,14 |
10,10 8,00 4,80 2,90 1,80 1,00 |
21,00 16,7 10,00 6,00 2,80 2,00 |
0,09 0,12 0,19 0,29 0,43 0,63 |
|
Fe3+ |
0,3 0,5 1,0 2,0 3,0 |
0,31 1,00 1,67 5,00 9,00 |
43,19 5,07 5,69 5,07 5,69 |
89,98 10,56 11,85 10,56 11,85 |
0,023 0,176 0,160 0,178 0,160 |
Заключение
На основании установленных различий при сорбции ионов меди (II), марганца (II), с одной стороны, и железа (III), с другой, рассмотрены возможные области практического применения катионита СФ-5 при решении задач извлечения и разделения ионов.
Исследовано поведение катионов меди (II), марганца (II) и железа (III) в процессе десорбции растворами соляной, серной и фтористоводородной кислот. Установлена взаимосвязь прочности полимерных комплексов с составом десорбирующего раствора и поведением катиона железа (III) при десорбции из катионита.
На основании экспериментальных данных при исследовании десорбции, рассчитаны значения эффективности регенерации, констант обмена, коэффициентов распределения. Полученные данные могут быть использованы для выбора условий разделения ионов на стадии процесса десорбции и расчета параметров технологических аппаратов.



