При рассмотрении вопросов обогащения полезных ископаемых большое внимание уделяется концентрированию продуктивных растворов в гидрометаллургии. Одним из методов концентрирования является сорбция с последующей десорбцией. Катионит КУ-2-8 широко используется в процессах водоподготовки в различных областях промышленности, в том числе и при обогащении полезных ископаемых. Высокая скорость ионного обмена как водородной, так и натриевой формы катионита позволяет использовать его для извлечения различных катионов из растворов. Сорбцию проводят из сернокислых, солянокислых, фосфорнокислых, аммиакатных и других растворов. Сорбент выдерживает большое количество циклов сорбции-десорбции, но следует отметить низкую избирательность сорбции.
Большое количество публикаций посвящено применению сорбционных методов для кондиционирования сточных и промывных вод предприятий, в которых тяжелые цветные металлы присутствуют в высоких концентрациях (более ПДК). Ранее нами опубликована обзорная работа по применению катионита КУ-2-8 и его зарубежных аналогов для сорбции цветных металлов из многокомпонентных растворов [1; 2]. Несмотря на широту применения катионита КУ-2-8, недостаточно изученным остается вопрос сорбции из многокомпонентных растворов. Особенно это касается растворов цветных металлов, полученных при бактериально-химическом выщелачивании кобальт-медно-никелевых руд, а также сточных и шахтных вод в районах горно-обогатительных предприятий.
Цель настоящей работы – экспериментально исследовать и рассчитать сорбционные характеристики сильнокислотного катионита КУ-2-8 по отношению к ионам цветных металлов (Cu2+, Ni2+, Co2+) при их совместном присутствии в модельных растворах, имитирующих реальные растворы бактериально-химического выщелачивания в зависимости от скорости потока и высоты сорбционной колонны.
Характеристики сорбционной колонны описывают с помощью кривых проскока [3–5], которые графически выражают зависимостью отношения Ct / C0, как функция от времени t (где Ct и C0 – концентрация ионов металла в элюате и элюэнте).
Модель Томаса – одна из наиболее общих и широко используемых моделей в теории производительности колонн [6–8], уравнение которой имеет вид:
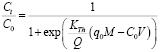 , (1)
, (1)
где С0 – концентрация сорбата на входе в колонну, мг/мл; Сt – концентрация сорбата в элюате, мг/мл; KTh – константа Томаса, мл∙/мин.∙мг; q0 – равновесная обменная емкость адсорбента (мг/г); М – масса сорбента, г; Q – объемная скорость элюэнта (мл/мин.); V – общий объем раствора, мл. При этом V = Q · t. Линейная форма уравнения (1) может быть представлена в координатах 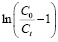 от t:
от t:
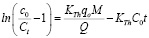 . (2)
. (2)
Материалы и методы исследования
В работе использовали водородную форму промышленного сульфокатионита катионита КУ-2-8 (ГОСТ 20298-74) ПОЛИФЛОК® (Россия), который представляет собой сополимер стирола и дивинилбензола. Подготовку катионита КУ-2-8 проводили по стандартной методике, ранее применяемой нами [1; 2]. В качестве сорбционной колонны использовали бюретку диаметром 10 мм. Загрузку сорбента, в зависимости от опыта, проводили на 10, 20 и 30 см. Элюирование выполняли сверху вниз, скорость подачи раствора поддерживали на уровне 1,0, 3,0 и 5,0 мл/мин. Определение меди, никеля и кобальта выполняли атомно-абсорбционным методом на приборе АА-6300 Shimadzu (Япония) по стандартным методикам [9; 10].
Модельные растворы готовили, растворяя точные навески кристаллогидратов сульфатов солей цветных металлов. В состав смешанных модельных растворов входили медь, никель и кобальт в равных концентрациях на уровне 480±30 мг/л.
После окончания сорбции проводили десорбцию. В случае с водородной формой катионита КУ-2-8 процесс десорбции совмещали с регенерацией. В качестве регенерирующего раствора использовали 10%-ную серную кислоту. Все колонки с сорбентом были залиты раствором серной кислоты и в статическом режиме выдержаны в течение 30 мин., затем промыты десорбентом со скоростью 1–2 мл/мин. В элюатах определяли содержание цветных металлов.
Результаты исследования и их обсуждение
Выходные кривые, представленные на рисунках 1а, 2а, 3а в координатах Ct / C0 – t, имеют S-образную форму. При увеличении высоты слоя сорбента время проскока увеличивается, при увеличении скорости – уменьшается. При увеличении высоты поглощающего слоя от 10 до 30 см суммарная сорбционная емкость уменьшается вне зависимости от скорости потока элюэнта в изученном диапазоне скоростей.
При скорости потока 1 мл/мин значение сорбционной емкости достигало значения 3,19 мг-экв/г при высоте колонны 10 см, 3,15 мг-экв/г при высоте колонны 20 см и 3,03 мг-экв/г при высоте слоя сорбента 30 см. При этом сорбционная емкость по меди составила – 0,919±0,036 мг-экв/г; по никелю – 1,019±0,035 мг-экв/г; по кобальту – 1,184±0,051 мг-экв/г. При скорости потока 3 мл/мин. значение сорбционной емкости становилось равным 3,00 мг-экв/г при высоте колонны 10 см, 2,95 мг-экв/г при высоте колонны 20 см и 2,67 мг-экв/г при высоте слоя сорбента 30 см. При этом сорбционная емкость по меди составила – 0,926±0,036 мг-экв/г; по никелю – 0,940±0,035 мг-экв/г; по кобальту – 1,069±0,051 мг-экв/г. 3,0 При повышении скорости потока до 5 мл/мин. значение сорбционной емкости достигало значения 3,23 мг-экв/г при высоте колонны 10 см, 2,91 мг-экв/г при высоте колонны 20 см и 2,69 мг-экв/г при высоте слоя сорбента 30 см. При этом сорбционная емкость по меди составила – 0,868±0,035 мг-экв/г; по никелю – 1,036±0,035 мг-экв/г; по кобальту – 1,069±0,051мг-экв/г.
На графиках, изображенных на рисунках 1б, 2б, 3б, представлена линейная форма уравнения (1) в координатах 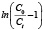 от t. Графоаналитическим методом были рассчитаны значения констант модели Томаса KTh, емкость сорбента q0 при скоростях потока элюента 1, 3 и 5 мл/мин. соответственно. Данные представлены в таблице. Недостатком самого сорбента является отсутствие селективности по отношению к ионам меди, никеля и кобальта.
от t. Графоаналитическим методом были рассчитаны значения констант модели Томаса KTh, емкость сорбента q0 при скоростях потока элюента 1, 3 и 5 мл/мин. соответственно. Данные представлены в таблице. Недостатком самого сорбента является отсутствие селективности по отношению к ионам меди, никеля и кобальта.
Коэффициенты корреляции R2 изменяются в диапазоне значений 0,93–0,99, что дает нам право использовать модель Томаса для описания процесса сорбции меди никеля и кобальта из смешанных растворов при различных скоростях потока. Недостатком самого сорбента является отсутствие селективности по отношению к ионам изученных цветных металлов.
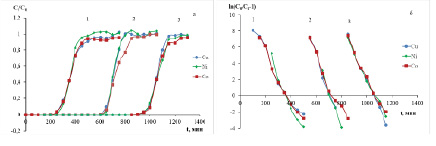
Рис. 1. Графические зависимости динамики сорбции цветных металлов от времени при скорости потока 1 мл/мин.: 1 – высота колонны 10 см; 2 – 20 см; 3 – 30 см; а – Ct / C0 от t, мин.; б – 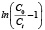 от t, мин.
от t, мин.
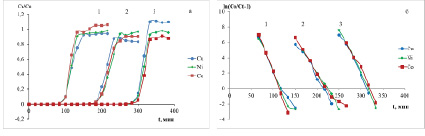
Рис. 2. Графические зависимости динамики сорбции цветных металлов от времени при скорости потока 3 мл/мин.: 1 – высота колонны 10 см; 2 – 20 см; 3 – 30 см; а – Ct / C0 от t, мин.; б – 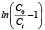 от t, мин.
от t, мин.
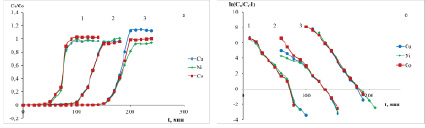
Рис. 3. Графические зависимости динамики сорбции цветных металлов от времени при скорости потока 1 мл/мин.: 1 – высота колонны 10 см; 2 – 20 см; 3 – 30 см; а – Ct / C0 от t, мин.; б –  от t, мин.
от t, мин.
Расчетные сорбционные характеристики модели Томаса: KTh – константа Томаса, равновесная обменная емкость сорбента q0 и коэффициенты корреляции R2 при разных скоростях потока элюента
|
Компонент |
Cu |
Ni |
Co |
|||||||
|
Z, |
см |
10 |
20 |
30 |
10 |
20 |
30 |
10 |
20 |
30 |
|
Скорость потока 1 мл/мин. |
||||||||||
|
KTh |
мл/мг мин.∙ |
0,074 |
0,100 |
0,086 |
0,075 |
0,098 |
0,075 |
0,060 |
0,067 |
0,070 |
|
q0 |
мг/г |
29,9 |
32,1 |
29,3 |
35 |
32,8 |
30 |
37,7 |
37,2 |
32,3 |
|
R2 |
0,967 |
0,988 |
0,996 |
0,961 |
0,989 |
0,993 |
0,972 |
0,965 |
0,988 |
|
|
Скорость потока 3 мл/мин. |
||||||||||
|
KTh |
мл/мг мин.∙ |
0,252 |
0,212 |
0,281 |
0,268 |
0,211 |
0,281 |
0,317 |
0,162 |
0,241 |
|
q0 |
мг/г |
32,8 |
28,9 |
25,7 |
31,6 |
28,6 |
27,1 |
32,9 |
33,8 |
30,5 |
|
R2 |
0,982 |
0,985 |
0,985 |
0,977 |
0,995 |
0,994 |
0,998 |
0,975 |
0,986 |
|
|
Скорость потока 5 мл/мин. |
||||||||||
|
KTh |
мл/мг мин.∙ |
0,257 |
0,205 |
0,271 |
0,230 |
0,163 |
0,225 |
0,230 |
0,185 |
0,216 |
|
q0 |
мг/г |
32,5 |
26,6 |
24,8 |
35,5 |
30,1 |
29,9 |
35,8 |
33,5 |
29,3 |
|
R2 |
0,983 |
0,959 |
0,996 |
0,96 |
0,931 |
0,997 |
0,957 |
0,994 |
0,99 |
|
Теоретически рассчитанная равновесная емкость сорбента q0 для ионов меди при высоте слоя 10 см незначительно увеличивается при увеличении скорости потока от 1 до 5 мл/мин. и уменьшается при высоте слоя сорбента 20 и 30 см при увеличении скорости потока от 1 до 5 мл/мин. Теоретическая емкость сорбента q0 по кобальту также уменьшается при увеличении скорости потока от 1 до 5 мл/мин. при любой высоте слоя в изученном диапазоне. Исключение составляет уменьшение емкости по кобальту при высоте слоя 20 см и скорости потока 3 мл/мин. Для никеля уменьшение теоретической сорбционной емкости q0 наблюдается при увеличении высоты слоя сорбента и увеличении скорости потока элюента.
В результате десорбции нами выделено три типа растворов: раствор I – концентрат; раствор II – промежуточный раствор; раствор III – промывные воды.
При скорости сорбции 1 мл/мин. концентрат представляет собой раствор с содержанием каждого компонента на уровне, г/л: 2,1–2,3; 3,0–3,3; 4,5–4,8, при высоте слоя сорбента 10, 20 и 30 см соответственно. При увеличении скорости сорбции до 3 мл/мин. концентрат представляет собой раствор с содержанием каждого компонента на уровне, г/л: 2,6–2,9; 3,2–3,3; 4,1–4,6, при высоте слоя сорбента 10, 20 и 30 см соответственно. При скорости сорбции 5 мл/мин. получены концентраты с содержанием компонентов на уровне, г/л: 2,8–3,3; 3,2–3,9; 4,2–5,2, при высоте слоя сорбента 10, 20 и 30 см соответственно. Наибольший коэффициент концентрирования, равный 8,8–10,8, получен при десорбции колонн, в которых сорбция проводилась при скорости потока 5 мл/мин. и высоте слоя сорбента 30 см. Промежуточный раствор, полученный в этих же условиях, имеет содержание компонентов в растворе 0,144–0,365 г/л и направляется на повторную сорбцию. Промывные воды, в которых содержание компонентов на уровне 9,85–16,5 мг/л, могут быть объединены с десорбентом. Таким образом, рекомендуется проводить концентрирование цветных металлов сорбционным методом при скорости потока 5 мл/мин. и высоте слоя сорбента 30 см.
Заключение
Для извлечения цветных металлов из многокомпонентных растворов в диапазоне концентраций на уровне 480±30 мг/л по каждому иону при совместном присутствии может быть использован сульфокатионит КУ-2-8 в водородной форме. Преимуществом катионита является возможность его использования в широком диапазоне pH. Однако низкая селективность по отношению к цветным металлам (Cu2+, Ni2+, Co2+) ограничивает область применения.
Модель Томаса следует применять для описания процесса сорбции цветных металлов Cu2+, Ni2+, Co2+ при их совместном присутствии в модельных растворах, если не требуется их разделение. Полученные значения коэффициентов Томаса, равновесной обменной емкости сорбента, для меди никеля и кобальта, а также форма выходных кривых позволят определять время работы колонны до проскока.
Наиболее технологичной, по мнению авторов, является скорость потока 5 мл/мин. Учитывая, что сульфокатионит КУ-2-8 не проявляет выраженной селективности к ионам цветных металлов, целесообразно говорить о суммарной практической сорбционной емкости, которая увеличивается с увеличением высоты слоя сорбента от 10 до 20 и до 30 см, равной, мг-экв/г: 3,23; 2,91, 2,69. При этом сорбционная емкость по меди составила – 0,868±0,035 мг-экв/г; по никелю – 1,036±0,041 мг-экв/г; по кобальту – 1,069±0,043 мг-экв/г.
В результате десорбции получен концентрат с содержанием по каждому иону на уровне 4,2–5,2 г/л, при этом коэффициент концентрирования составил 8,8–10,8 раза.



