К настоящему времени известно большое количество гидрометаллургических методов для переведения цветных металлов, таких как медь, никель, кобальт, из рудного сырья в раствор. По некоторым оценкам, на долю гидрометаллургической переработки медно-никелевых руд приходится порядка 20 % от общего объема производства. Ожидаемо, что ввиду более низкой энергоемкости, по сравнению с пирометаллургическими методами переработки медно-никелевых руд, доля гидрометаллургии будет возрастать. Эти методы отличаются используемыми реагентами и условиями проведения процесса выщелачивания. В зависимости от типа рудного материала – окисленные это руды или сульфидные – реагентами выщелачивания служат различные индивидуальные минеральные кислоты или многокомпонентные смеси. Так, для выщелачивания окисленных медно-никелевых руд часто применяют растворы серной, соляной и других кислот, раствор карбоната аммония. Для выщелачивания сульфидных руд требуется добавлять окислитель, в качестве которого часто используют растворы трехвалентного железа. Для низкосортных руд используют бактериальное выщелачивание. Так как скорость бактериального выщелачивания мала, а накопление ценного компонента в продуктивном растворе еще более замедляет процесс выщелачивания, возникает необходимость отвода продуктивного раствора из зоны реакции. Концентрирование продуктивных растворов целесообразно проводить сорбционными методами. Для концентрирования ионов цветных металлов используют различные типы сорбентов: органические смолы [1], такие как сульфо-катиониты [2], карбоксильные катиониты либо минеральные сорбенты, такие как цеолиты [3]. Сорбционная емкость сульфо-катионитов обычно составляет 1,8–1,9 моль-экв/л сорбента. Возможность применения минеральных сорбентов ограничивается сравнительно невысокой обменной емкостью, и их применение обосновано для низко концентрированных растворов, обычно это содержание менее 100 мг/л [4]. Важным является процесс регенерации сорбентов, так как это и затраты времени, и расход реактивов [5, 6]. Вопросам регенерации сорбентов посвящено большое количество исследований. Так, например, проведено сравнение регенерации КУ-2-8 растворами таких кислот, как серная, соляная, азотная [7].
Цель настоящей работы – оптимизировать регенерацию ионообменных сорбентов при сорбционном концентрировании растворов цветных металлов, полученных в результате бактериально-химического выщелачивания сульфидных медно-никелевых руд.
Материалы и методы исследования
Для первичной переработки продуктивных растворов, содержащих одновременно медь, никель и кобальт, был применен сорбционный метод с использованием промышленного сульфо-катионита КУ-2-8 в водородной и натриевой формах. Сорбционные колонны с диаметром 1,2 см были заполнены катионообменной смолой КУ-2-8, высота сорбента составляла 10, 20 и 30 см, всего было приготовлено 18 колонок, из них 9 колонок с водородной формой сорбента и 9 колонок с натриевой формой. Колонны были насыщены ионами меди, никеля и кобальта путем пропускания через них модельного раствора, содержащего указанные катионы цветных металлов в концентрациях на уровне 500±50 мг/л каждого компонента. Насыщение проводили с различной объемной скоростью потока элюента – 1, 3 и 5 мл/мин – до того момента, когда в трех последних пробах концентрация цветных металлов на выходе из колонки оставалась приблизительно одинаковой, после чего дополнительно пропускали еще по 5–7 колоночных объемов. При этом суммарная сорбционная емкость нарастала незначительно.
Затем проводили десорбцию, используя 10 % раствор серной кислоты, чередуя статический и динамический режимы. Для этого нагруженные колонки заполняли раствором десорбента и выдерживали в статическом режиме в течение 30 мин, после этого открывали вентиль и собирали элюат в мерные колбы объемом 25 мл, контролируя содержания ионов металлов атомно-абсорбционным методом, используя атомно-абсорбционный спектрофотометр АА-6300 (Shimadzu, Япония).
Результаты исследования и их обсуждение
При насыщении колонок, содержащих различное количество сорбента с различной скоростью потока элюента, получены зависимости емкости катионита от высоты поглощающего слоя и от скорости потока. Максимально достигнутая емкость сорбентов приведена в таблице. В таблице приводятся данные по суммарной сорбционной емкости и по емкости сорбента по каждому компоненту в отдельности, как для водородной, так и для натриевой форм.
Отметим, что суммарная сорбционная емкость снижается при увеличении скорости потока при сорбции на водородной форме сорбента и увеличении высоты поглощающего слоя. При этом минимальная суммарная емкость 2,678 мг-экв/г обнаружена при высоте столба 30 см и скорости потока 5 мл/мин. Максимальная – 3,188 мг-экв/г – при высоте столба сорбента 10 см и скорости потока 1 мл/мин. Разница между максимальной и минимальной сорбционными емкостями составляет 19 %. Более стабильно ведет себя натриевая форма.
Десорбцию проводили серной кислотой, чередуя статический и динамический режимы. В результате десорбции выделены концентраты. Сравнительная характеристика концентратов приведена в таблице. Динамика десорбции сульфо-катионита показана на рис. 1 и 2.
Зависимость сорбционной емкости катионита КУ-2-8 и солесодержания концентратов десорбции от высоты поглощающего слоя h, объемной скорости потока Q насыщения и формы сорбента
|
№ колонны |
Q, мл/мин |
h, см |
Сорбционная емкость, мг-экв/г |
Десорбция. Состав концентрата, г/л |
|||||
|
Суммарная |
Cu2+ |
Ni2+ |
Co2+ |
Cu2+ |
Ni2+ |
Co2+ |
|||
|
H-форма |
|||||||||
|
1 |
1 |
3,188 |
0,868 |
1,072 |
1,248 |
2,20 |
2,34 |
2,07 |
|
|
2 |
3 |
10 |
3,071 |
0,999 |
1,012 |
1,059 |
3,09 |
3,33 |
3,13 |
|
3 |
5 |
3,099 |
1,037 |
1,231 |
1,024 |
4,69 |
4,79 |
4,47 |
|
|
4 |
1 |
3,156 |
0,975 |
0,966 |
1,208 |
2,69 |
2,62 |
2,93 |
|
|
5 |
3 |
20 |
3,035 |
0,996 |
0,910 |
1,129 |
3,26 |
3,45 |
3,30 |
|
6 |
5 |
2,950 |
0,837 |
0,971 |
1,142 |
4,40 |
4,69 |
4,06 |
|
|
7 |
1 |
3,030 |
0,914 |
1,020 |
1,096 |
2,80 |
3,35 |
2,88 |
|
|
8 |
3 |
30 |
2,720 |
0,783 |
0,898 |
1,040 |
3,16 |
3,57 |
3,86 |
|
9 |
5 |
2,678 |
0,732 |
1,003 |
0,943 |
4,18 |
4,72 |
5,23 |
|
|
Na-форма |
|||||||||
|
10 |
1 |
3,158 |
0,911 |
1,146 |
1,101 |
2,29 |
2,33 |
1,63 |
|
|
11 |
3 |
10 |
3,186 |
0,961 |
1,121 |
1,104 |
3,99 |
3,05 |
3,90 |
|
12 |
5 |
3,625 |
1,166 |
1,231 |
1,228 |
5,70 |
5,80 |
5,36 |
|
|
13 |
1 |
3,176 |
1,047 |
1,052 |
1,077 |
2,36 |
3,61 |
3,00 |
|
|
14 |
3 |
20 |
3,354 |
1,012 |
1,157 |
1,184 |
3,79 |
4,35 |
4,20 |
|
15 |
5 |
3,203 |
0,995 |
1,144 |
1,064 |
4,93 |
5,01 |
5,64 |
|
|
16 |
1 |
3,305 |
1,041 |
1,187 |
1,077 |
3,25 |
3,21 |
3,26 |
|
|
17 |
3 |
30 |
3,219 |
0,969 |
1,116 |
1,134 |
3,96 |
4,53 |
3,89 |
|
18 |
5 |
3,255 |
1,118 |
1,013 |
1.124 |
5,38 |
5,95 |
5,60 |
|
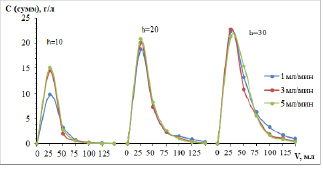
Рис. 1. Кривые элюирования цветных металлов раствором серной кислоты из колонок с катионитом КУ-2-8 в Н-форме, высотой 10, 20 и 30 см, нагруженных с различной скоростью – 1, 3 и 5 мл/мин
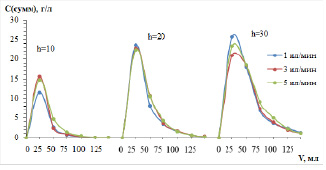
Рис. 2. Кривые элюирования цветных металлов раствором серной кислоты из колонок с катионитом КУ-2-8 в Na-форме, высотой 10, 20 и 30 см, нагруженных с различной скоростью – 1, 3 и 5 мл/мин
Обращает на себя внимание тот факт, что выходные кривые имеют приблизительно одинаковую форму вне зависимости от высоты слоя сорбента и скорости потока элюента. Однако ширина пиков увеличивается при увеличении высоты слоя, и асимметрия становится более ярко выраженной. При десорбции колонн, первоначально имевших Na-форму, это явление проявляется сильнее. После выделения концентрата (обычно это 3–4 колоночных объема) растворы элюирования еще имеют значительные содержания ионов цветных металлов на уровне 100–300 мг/л и должны быть направлены на повторную сорбцию.
На графике (рис. 3) представлена зависимость солесодержания в концентрате десорбции от высоты слоя и скорости потока при насыщении сорбционных колонн. Максимальное солесодержание получено при десорбции колонн с Na-формой сорбента, высотой 30 см, насыщенных цветными металлами. Но в этом случае невозможно провести регенерацию сорбента в одну стадию. Сначала проводят десорбцию с одновременной регенерацией в водородную форму, а затем осуществляют перевод сорбента в Na-форму, применяя 10 % раствор хлорида натрия.
Учитывая, что сорбционная емкость Na-формы катионита превышает емкость Н-формы, растворы десорбции тоже получились более концентрированные, исключение наблюдается только для кобальта в составе раствора, полученного при десорбции колонны с высотой поглощающего слоя равной 10 см и скорости насыщения 1 мл/мин.
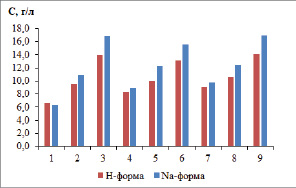
Рис. 3. Зависимость солесодержания в концентрате десорбции от высоты слоя и скорости потока при насыщении сорбционных колонн: 1–3 – скорость насыщения 1 мл/мин, 4–6 – 3 мл/мин,7–9 – 5 мл/мин; 1, 4, 7 – высота слоя 10 см, 2, 5, 8 – 20 см, 3, 6, 9 – 30 см
При десорбции колонн № 1 и № 10 (h = 10 см, Q = 1 мл/мин) получаем раствор с суммарным солесодержанием 6,61 и 6,25 г/л, коэффициенты концентрирования составляют 4,1–4,7 и 3,3–4,7 для водородной и натриевой форм по каждому компоненту соответственно. При десорбции колонн № 2 и № 11 (h = 10 см, Q = 3 мл/мин) получаем раствор с суммарным солесодержанием 8,24 и 8,97 г/л, коэффициенты концентрирования составляют 5,2–5,9, и 4,7–7,2 для водородной и натриевой форм по отдельным компонентам соответственно.
При десорбции колонн № 3 и № 12 (h = 10 см, Q = 5 мл/мин) получаем раствор с суммарным солесодержанием 9,03 и 9,72 г/л, коэффициенты концентрирования составляют 5,6–6,7 и 6,4–6,5 для водородной и натриевой форм по каждому компоненту соответственно.
При десорбции колонн № 4 и № 13 (h = 20 см, Q = 1 мл/мин) получаем раствор с суммарным солесодержанием 9,55 и 10,94 г/л, коэффициенты концентрирования составляют 6,2–6,7 и 6,1–8,0 для водородной и натриевой форм по каждому компоненту соответственно. При десорбции колонн № 5 и № 14 (h = 20 см, Q = 3 мл/мин) получаем раствор с суммарным солесодержанием 10,01 и 12,34 г/л, коэффициенты концентрирования составляют 6,5–6,9 и 7,6–8,7 для водородной и натриевой форм по отдельным компонентам соответственно. При десорбции колонн № 6 и № 15 (h = 20 см, Q = 5 мл/мин) получаем раствор с суммарным солесодержанием 10,59 и 12,38 г/л, коэффициенты концентрирования составляют 6,3–7,7 и 7,8–9,1 для водородной и натриевой форм по каждому компоненту соответственно.
При десорбции колонн № 7 и № 16 (h = 30 см, Q = 1 мл/мин) получаем раствор с суммарным солесодержанием 13,95 и 16,86 г/л, коэффициенты концентрирования составляют 8,9–9,6 и 10,7–11,6 для водородной и натриевой форм по каждому компоненту соответственно. При десорбции колонн № 8 и № 17 (h = 30 см, Q = 3 мл/мин) получаем раствор с суммарным солесодержанием 13,15 и 15,58 г/л, коэффициенты концентрирования составляют 8,2–9,4, и 9,9–11,3 для водородной и натриевой форм по отдельным компонентам соответственно. При десорбции колонн № 9 и № 18 (h = 30 см, Q = 5 мл/мин) получаем раствор с суммарным солесодержанием 14,13 и 16,93 г/л, коэффициенты концентрирования составляют 8,4–10,5 и 10,8–11,9 для водородной и натриевой форм по каждому компоненту соответственно.
Общий расход серной кислоты на полную регенерацию катионита составляет 10 г-экв/г-экв Ме2+. Стоит учитывать, что кислота расходуется не только на получение концентрата, но и на дальнейшую отмывку сорбента, как только из колонны начинает выходить раствор с содержанием ионов металлов на уровне 500 мг/л, его отправляют на повторную сорбцию.
Заключение
Сорбционный метод концентрирования может быть успешно применен для первичной переработки растворов бактериально-химического выщелачивания медно-никелевых руд.
Применение сульфо-катионита КУ-2-8 в натриевой и водородной формах позволяет уже в первом цикле сорбция-десорбция получить растворы с высоким солесодержанием, которые подлежат дальнейшей переработке известными методами с целью получения товарного продукта.
Коэффициент концентрирования, равный 10,8–11,9 для натриевой формы сорбента, получен при десорбции колонны высотой 30 см 10 % раствором серной кислоты при чередовании статического и динамического режимов.
Несмотря на лучшие показатели сорбции-десорбции натриевой формы катионита КУ-2-8, применение водородной формы более технологично, так как процесс десорбции является, по сути, процессом регенерации и нет необходимости вводить в технологический цикл дополнительные операции и реагенты, такие как хлорид натрия. При использовании водородной формы катионита для концентрирования растворов цветных металлов в качестве десорбента могут быть использованы элюаты, полученные при сорбции до проскока, которые представляют собой растворы серной кислоты.



