Актуальной задачей экологии является рациональное использование водных ресурсов. В окружающей среде происходят превращения веществ, при этом металлы не исчезают, а вступают в различные взаимодействия. Наблюдения за состоянием поверхностных вод водотоков Тюменской области показывают их загрязненность [1]. Юг Тюменской области располагается таким образом, что главные водные артерии берут начало в развитых индустриальных регионах (Челябинская область, Башкирия, Свердловская область). Выше водозаборных сооружений г. Тюмени находятся 17 крупных металлургических предприятий, сточные воды которых сбрасываются в источник централизованного водоснабжения г. Тюмени (рис. 1).
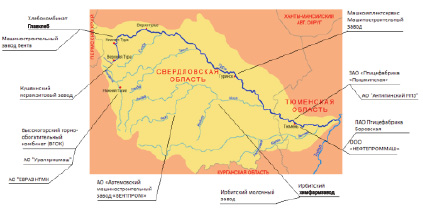
Рис. 1. Основные источники промышленных стоков бассейна р. Тура [2]
Многие промышленные предприятия имеют в своем составе гальванические цеха для нанесения металлических покрытий [3]. При работе возникает необходимость утилизации отработанных растворов и сточных вод после промывки металлических изделий. К группе токсичных металлов относятся медь, марганец, цинк, кадмий, кобальт, никель, железо и хром. Вклад в загрязнение водоемов ионами металлов представлен на рис. 2. Основная масса цинка мигрирует через гидросферу. Цинк составляет более 30 % от общего количества загрязнений, его фоновая концентрация в поверхностных водоемах в среднем в два раза превышает ПДК и колеблется от 1,7 до 3,2 мг/дм3 [1].
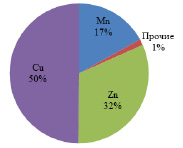
Рис. 2. Доминирующие металлы в составе загрязнений водных объектов Тюменской области
Сточные воды содержат соли токсичных тяжелых металлов, которые передаются по пищевой цепочке и представляют опасность для живых организмов. Задача снижения концентрации ионов тяжелых металлов в водоёмах Юга Тюменской области является актуальной и связана с внедрением доступных и эффективных технологий, позволяющих не только извлекать ионы металлов, но и повторно использовать их в смежных технологических цепочках. Таким образом, загрязнение окружающей среды тяжелыми металлами требует извлечения их из производственных растворов и рециклинга их в дальнейшем в основных или вспомогательных производственных процессах.
Эффективным методом извлечения металлов является ионный обмен с применением комплексообразующих ионитов, которые обладают высокой избирательной способностью и чистотой разделения.
Цель исследования – определение условий сорбции и десорбции ионов цинка и кадмия из модельных растворов катионитом СФ-5.
Материалы и методы исследования
Для исследования использовали катионит СФ-5 пористой структуры в водородной и солевой (аммонийной) формах. Крупность зерен была 0,25–0,50 мм (воздушно-сухом состоянии). Сорбция изучалась в динамических условиях. В колонку сечением 1,4 см2 загружали 6,0 г катионита, что соответствовало высоте слоя 16,5 см2, затем пропускали растворы сульфатов цинка и кадмия в присутствии соляной кислоты и в ее отсутствие. В проводимых опытах скорость фильтрации была 1,0 мл/(см2∙мин). Объем растворов, выходящий из колонки, отбирался по 25 мл.
В промышленных условиях для очистки загрязненных вод используют аппараты непрерывного действия (адсорберы), в которых происходит извлечение тяжелых металлов. Принцип действия заключается в том, что адсорбент движется навстречу поступающему раствору. Для работы технологического процесса необходимо провести технологический расчет аппарата и определить кинетические параметры процесса сорбции.
Результаты исследования и их обсуждение
В процессах нанесения покрытий используют растворы солей с добавлением неорганических и органических кислот. При этом растворы приобретают кислую среду, рН растворов может изменяться от 4,5 до 1,0 в зависимости от концентрации кислоты. Отработанные растворы попадают в сточные воды, которые необходимо утилизировать для извлечения ценных компонентов. Для этих целей применяют катиониты и аниониты [4].
Фосфорнокислый катионит СФ-5 диссоциирует по двум ступеням. Каждая ступень характеризуется показателем кажущейся константой ионизации рК1 = 3,1 и рК2 = 8,4. Полная обменная динамическая емкость катионита 15,84 мг/г. По значениям констант ионизации можно оценить связь ионогенной группы с катионом водорода. На рис. 3 наблюдается проявление конкурентной сорбции ионов водорода.
На рис. 3 видно, что с увеличением концентрации соляной кислоты сорбция ионов металлов уменьшается. В результате эксперимента получили значения обменной емкости для аммонийной формы катионита несколько выше, чем водородной формы. Для растворов, не содержащих соляную кислоту, значение обменной емкости приближается к значению обменной емкости катионита. Это подтверждает, что сорбция происходит в виде простых катионов:
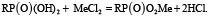
Таким образом, процесс сорбции будет зависеть от ионной формы катионита, прочности образующихся комплексных соединений иона металла с функциональной группой и рН среды растворов.
Для извлечения сорбированных ионов металлов из катионита требуется подобрать условия, при которых происходит легкость и полнота десорбции. Скорость и полнота вымывания сорбированных ионов металлов определяется не только свойствами иона, но и свойствами десорбирующих растворов. Десорбция ионов и регенерация катионита растворами кислот и солей представляет наибольший интерес.
На рис. 4 представлены выходные кривые сорбции ионов цинка и кадмия. Полученные в эксперименте выходные кривые ионов металлов имеют обычный вид.
Рассматривая результаты опытов по сорбции, необходимо отметить осложнение ионного обмена процессами комплексообразования ионогенных групп с катионами цинка и кадмия. Полученные результаты по сорбции позволяют рассчитать площадь контакта катионита с расходом сточной воды, общее количество ионов, поглощенных в колонке за 1 час.
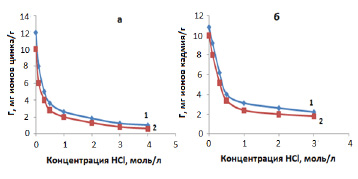
Рис. 3. Сорбция ионов Zn2+ (а) и Cd2+ (б) из 0,2 М растворов, содержащих HCl катионитом СФ-5 в H+ – (1) и NH4+ – (2)
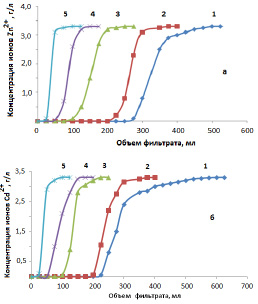
Рис. 4. Выходные кривые сорбции ионов цинка (а) и кадмия (б) из 0,2 М растворов, содержащих HCl катионитом СФ-5 в NH4+-форме. Концентрация HCl, моль/л: 0,0 (1); 0,1 (2); 0,5 (3); 1,0 (4); 2,0 (5)
Процессы сорбции взаимосвязаны с процессами десорбции и характеризуют обратимость ионного обмена. Для десорбции ионов и регенерации катионита использовали соляную и серную кислоты, соли этих кислот. Десорбция из комплексообразующих катионитов определяется факторами: характера связей между катионом и ионогенной группы, сродство катиона десорбирующего реагента к катиониту, тип и концентрация электролита, рН среды.
Основной реакцией ионного обмена при десорбции будет
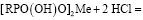
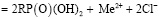 ,
,
протеканию способствует протонирование ионогенных групп и, как следствие, сдвиг реакции ионного обмена в правую сторону. Поэтому для большего проявления различий перед десорбцией сорбировалось по 10 мг катионов цинка и кадмия при общей обменной емкости слоя катионита в колонке 15,84 мг ∙ 6 г = 95,04 мг.
На рис. 5 представлены кривые десорбции цинка и кадмия.
Кинетика ионного обмена рассматривается с позиции общей теории гетерогенных реакций. Процесс ионного обмена заключается в химическом превращении, который протекает в твердой фазе. Кроме того, происходит процесс переноса массы вещества из одной фазы в другую. В основе ионного обмена лежит простая химическая реакция
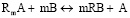 .
.
Процесс переноса вещества позволяет определить лимитирующую стадию. Для комплексообразующих катионитов лимитирующей стадией является диффузия сорбированного иона в зерне.
Для определения эффективности внедрения ионообменной очистки в практику очистки промышленных стоков смоделируем количество ионообменных колонн и оценим необходимое количество ионообменной смолы СФ-5 при очистке 100 м3/ч сточных вод. Результаты по сорбции использовали для расчета площади контакта катионита с расходом сточной воды. В качестве базовых выражений для расчета были использованы формулы (1)–(7) [5].
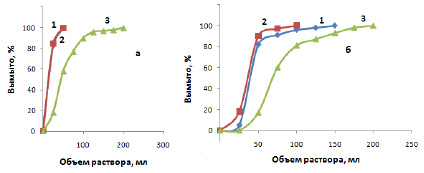
Рис. 5. Кривые вымывания ионов цинка (а) и кадмия (б) растворами: 1 М HCl (1), 2 M Н2SO4 (2), 1 M HF (3)
Расчет ионообменных колонн для извлечения цинка
|
Параметр |
Единица измерения |
Значение |
|
Расход сточных вод, Q |
м3/ч |
100 |
|
Скорость фильтрации, V |
м/ч |
8 |
|
Высота слоя катионита, Hk |
м |
3 |
|
Требуемый объем катионита, Vk |
м3 |
150,76 |
|
Исходная концентрация загрязнения, Cex |
мг/дм3 |
2 |
|
Предельно допустимая концентрация загрязнения, Сen |
мг/дм3 |
0,01 |
|
Количество регенераций в сутки, n |
- |
2 |
|
Ионообменная ёмкость, Ek |
мг*экв/г |
15,84 |
|
Требуемая масса катионита, М |
кг/ч |
12,56 |
|
Продолжительность фильтроцикла, t |
ч |
12 |
В качестве объекта изучения были выбраны очищенные сточные воды с исходным содержанием цинка 2 мг/дм3. Очистка производилась до ПДК хозяйственно-питьевых водоемов, 0,01 мг/дм3. Основные и промежуточные результаты расчета приведены в таблице.
В результате расчета было установлено, что для очистки заданного количества стоков до ПДК потребуется 6 ионообменных колонн с диаметром 2 м и высотой рабочего ионообменного слоя 3 м. Эффективность очистки сточных вод в данном случае составляет 99,5 %.
Заключение
В результате проведенных исследований было установлено, что СФ-5 эффективен для удаления ионов кадмия и цинка. Эффективность извлечения ионов может быть увеличена за счет температуры сточных вод и модификации катионита ионами аммония. Очистка с использованием катионита СФ-5 может внедряться в действующие технологических схемы подготовки сточных вод на стадии заключительной очистки перед сбросом сточных вод в водоемы.



