Накоплен большой объем работ, рассматривающих действие электромагнитных излучений (ЭМИ) крайневысоких частот (КВЧ) на живые организмы. Существенный вклад внесли академик Н.Д. Девятков и профессор О.В. Бецкий, обнаружившие терапевтическое действие ЭМИ КВЧ при лечении человека [1, 2]. Позднее начали появляться работы по изучению действия ЭМИ КВЧ на микроорганизмы. Цель подобных работ – применение полученных знаний для создания и совершенствования биотехнологий. Причем полезным может оказаться как стимулирующее действие ЭМИ КВЧ [3, 4, 5], так и угнетающее [6].
Объект в исследовании действия ЭМИ миллиметрового диапазона – хлорелла. Хлорелла (Chlorella Beij., 1890) – обширно распространенная в природе одноклеточная фотосинтезирующая планктонная микроводоросль. Chlorella применяется как пищевая добавка; корм; для синтеза кислорода и создания биотоплива; для восстановления водоемов и очистки сточных вод; в качестве тест-объекта при экологическом мониторинге. Показана способность очищать воду от соединений неорганического азота в различных температурных режимах с эффективностью 85–100% [7, 8] – востребованная задача горнодобывающего производства.
Применение в биотехнологиях открывает возможность применения Chlorella в качестве объекта для разработки методик стимулирования роста микроводорослей, а простота организации и культивирования дает возможность оценить действия различных факторов, в том числе воздействия ЭМИ, на Chlorella. В работе [9] исследовалось воздействие низкоинтенсивного низкочастотного электромагнитного поля (ЭМП) с мощностью 3 мТл на Chlorella vulgaris. Было установлено, что низкоинтенсивное низкочастотное ЭМП способно усиливать кластеризацию клеток. Успехов по стимулированию Chlorella vulgaris добился Н.А. Суховский [10]. Разработанный реактор, использующий электростатическое поле для стимуляции роста Chlorella vulgaris, увеличивает эффективность выращивания водоросли в 2 раза.
Цель исследования: выявить, как ЭМИ в диапазоне частот 38–53 ГГц воздействует на микроводоросль Chlorella vulgaris, и оценить, можно ли использовать ЭМИ КВЧ для стимулирования роста микроводоросли. Этот вопрос для Chlorella vulgaris будет рассмотрен впервые.
Как показано в работах [7, 8], Chlorella способна к доочистке сточных вод от неорганического азота. А облучение ЭМИ КВЧ, согласно проведенным исследованиям, позволяет стимулировать рост микроорганизмов [3, 4, 5] и повысить стойкость микроорганизмов к действию загрязнителей [11, 12, 13]. Загрязнение сточных вод горнодобывающих производств неорганическим азотом – серьезная проблема. Внедрение биотехнологий по очистке сточных вод поможет снизить воздействие предприятий на экосистему и человека.
Материал и методы исследования
Объект исследования – суспензия одноклеточной зеленой водоросли Chlorella vulgaris. Перед началом экспериментов Chlorella vulgaris выращивалась в течение 7 дней на среде Тамия при комнатной температуре 20⁰С при естественном освещении. Методика подготовки культуры к экспериментам разработана на основе работы [11]. Работа взята за основу из-за близости тематики исследования и доступности изложения.
Условия эксперимента. Эксперименты, включающие период облучения и период культивирования без облучения, проходили при постоянном искусственном освещении, постоянной температуре 30⁰С и подаче воздуха 2,5 л/м. Искусственное освещение, аэрация и поддержание постоянной температуры использовались для создания одинаковых условий в экспериментах. Температура 30⁰С подобрана для исследуемой культуры в серии предварительных экспериментов. Нагреватель АН-1006-1, который находился в аквариуме, заполненном водой, поддерживал постоянную температуру с точностью ±1⁰С. В аквариум помещались кюветы с суспензией микроводоросли. Уровень воды в аквариуме совпадал с уровнем суспензии в кюветах. Контроль температуры обеспечивался с помощью ртутного термометра. Постоянное освещение поддерживалось лампой LED-1088 Aquarium light, спектр излучения которой совпадал со спектром поглощения Chlorella vulgaris. Компрессор М-102 подавал воздух к кюветам по системе трубок, разветвленных параллельно. В качестве кювет использовались стеклянные стаканы В-1-1000 высотой 180 мм и диаметром 95 мм.
Дозиметрия и характеристики излучения. Источник излучения – генератор Г4-141 («Иcток», г. Фpязино Моcковcкой облаcти, СССР). Прибор генерирует ЭМИ КВЧ в диапазоне 37,5–53,57 ГГц. Эксперименты проводились с шагом в 1 ГГц в диапазоне от 38 до 53 ГГц. Облучение в экспериментах проводилось в режиме непрерывной генерации с экспозицией 8 ч. Стабильность частот в режиме непрерывной генерации не превышала отклонения в 1%. ЭМИ КВЧ передавалось по системе волноводов прямоугольного сечения 5,2х2,6 мм. Система волноводов включала в себя прямой волновод длиной 14,2 см и угловой волновод длиной 2 см с поворотом на 90⁰. На конце волновода располагалась рупорная антенна прямоугольного сечения с открытым раскрывом размером 22х12,5 мм. Длина антенны 35 мм. Усиление антенны 15,3 dBi. Входное сопротивление 50 Ω. Выбран открытый рупор прямоугольного сечения, так как он создает плоский фронт волны. Раскрыв рупора зафиксирован на расстоянии 25 см над поверхностью суспензии водоросли и на расстоянии 35 см до дна кювет. Расстояние было выбрано исходя из конфигураций антенны и частот таким образом, чтобы изучаемый объект находился в дальней зоне излучения, для однородного удельного поглощения мощности излучения, что снижает влияние объектов на источник излучения. Плотность потока энергии в экспериментах составляла 11,69 мкВт/см2. При этом во время экспериментов происходило постоянное перемешивание суспензии потоком воздуха аэратора. Поэтому излучение равномерно воздействовало на весь объем суспензии. В радиусе 1 м от кювет других электрических приборов не было, кроме источника излучения, лампы и нагревателя. Контрольные эксперименты проводились в том же месте, при тех же условиях работы приборов, что и рабочие, за исключением генератора, который не работал во время контрольных экспериментов.
Методика эксперимента. Для эксперимента подготавливалось 1,2 л среды Тамия на дистиллированной воде, в которую добавляли 6 мл маточной культуры Chlorella vulgaris, оптическая плотность которой составляла D=0,378 при длине волны 560 нм. Полученную маточную суспензию делили на 4 части по 300 мл. Первую часть сразу отбирали для анализа в качестве контрольного образца. Оставшиеся три части культивировали в течение 24 ч. Первые 8 ч культивирования суспензия подвергалась воздействию ЭМИ КВЧ.
Эксперименты проводились с тремя параллельно идущими повторами. Один контрольный эксперимент по культивированию без воздействия проводился с пятью повторами. Всего проведено 17 экспериментов: по одному эксперименту для каждой частоты в диапазоне 38–53 ГГц с шагом 1 ГГц и контрольный эксперимент без облучения (таблица 1).
Методика анализа. После окончания эксперимента каждую из проб суспензии пропускали через мембранный фильтр диаметром 47 мм типа МФАС-ОС-2С. Объем суспензии 300 мл выбран, исходя из методики анализа. Полученные образцы анализировались по «Методике спектрофотометрического определения хлорофилла а» ГОСТ 17.1.4.02 – 90 [14]. Методика основана на спектрофотометрировании ацетонового экстракта проб. С помощью методики определяли концентрацию биомассы водоросли (<∆B>), содержание хлорофилла «a» (С a), «b» (C b), «c1+c2» (С с1+с2), каротеноидов (С k). Для анализа использовался спектрофотометр ПЭ-5400УФ (ООО «Экохим», г. Санкт-Петербург, Россия). Анализ экстрактов проводился на длинах волн 480, 630, 647, 664, 750 нм в соответствии с методикой [14].
Статистическая обработка данных. Для каждого эксперимента рассчитано среднее арифметическое значение показателей. Отношение среднего значения к контрольному значению в конкретном эксперименте показывает, во сколько раз увеличилась концентрация биомассы и/или пигментов. Показатели рассчитаны в относительных единицах. Для установления наличия или отсутствия стимулирующих и угнетающих эффектов рассчитан доверительный интервал по результатам пяти контрольных экспериментов.
Результаты исследования и их обсуждение
Полученные данные представлены в таблице 2 и на рисунке 1. Черными горизонтальными линиями на рисунке 1 показан доверительный интервал для контрольного значения, рассчитанный по пяти повторам эксперимента. В экспериментах параметры культивирования и излучения оставались неизменными, менялась только частота излучения, поэтому наблюдаемые эффекты связываем с изменением частоты.
Биомасса Chlorella vulgaris. На рисунке 1 представлены экспериментальные данные изменения биомассы водоросли в суспензии после культивирования в течение 1 суток. Биомасса водоросли в контрольных экспериментах возросла в 4,36±1,39 раза. При облучении с частотой 40 ГГц было обнаружено статистически значимое увеличение биомассы водоросли в 2,37 раза по сравнению с контролем (рис. 1). Для частот 38, 39, 41, 43, 47, 50 ГГц не отмечено никакого эффекта. На частотах 42, 44, 45, 46, 48, 49, 51, 52, 53 ГГц наблюдается снижение биомассы относительно контроля.
Таблица 1
Количество экспериментов и повторов опытов
|
№ экс-та |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
|
F ГГц |
0 |
38 |
39 |
40 |
41 |
42 |
43 |
44 |
45 |
46 |
47 |
48 |
49 |
50 |
51 |
52 |
53 |
|
Кол-во повторов |
5 |
3 |
3 |
3 |
3 |
3 |
3 |
3 |
3 |
3 |
3 |
3 |
3 |
3 |
3 |
3 |
3 |
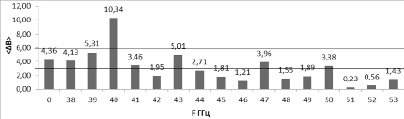
Рис. 1. Изменение концентрации биомассы Chlorella vulgaris под воздействием ЭМИ 38-53 ГГц. По оси абсцисс – частота F ГГц. По оси ординат показано, во сколько раз увеличилась концентрация биомассы после культивирования
Таблица 2
Концентрация биомассы и содержание фотосинтезирующих пигментов в суспензии Chlorella vulgaris, полученные после облучения
|
ГГц |
<∆B> |
С а |
С б |
С с1+с2 |
С k |
|
0, контроль |
4,36 |
4,12 |
3,86 |
2,88 |
3,55 |
|
38 |
4,13 |
3,07 |
2,80 |
2,35 |
3,14 |
|
39 |
5,31 |
3,73 |
1,67 |
2,64 |
1,82 |
|
40 |
10,34 |
6,31 |
2,93 |
3,54 |
3,20 |
|
41 |
3,46 |
1,08 |
1,44 |
0,86 |
1,21 |
|
42 |
1,95 |
2,67 |
1,59 |
1,37 |
1,18 |
|
43 |
5,01 |
3,41 |
3,54 |
3,14 |
2,85 |
|
44 |
2,71 |
2,20 |
2,89 |
2,29 |
2,10 |
|
45 |
1,81 |
1,55 |
2,50 |
1,72 |
1,99 |
|
46 |
1,21 |
1,08 |
1,34 |
1,02 |
1,11 |
|
47 |
3,96 |
2,95 |
3,68 |
2,61 |
4,94 |
|
48 |
1,55 |
1,41 |
0,93 |
0,79 |
1,17 |
|
49 |
1,89 |
1,62 |
2,25 |
1,56 |
1,87 |
|
50 |
3,38 |
2,38 |
0,81 |
0,76 |
0,96 |
|
51 |
0,23 |
0,30 |
0,36 |
0,25 |
0,48 |
|
52 |
0,56 |
0,62 |
1,29 |
0,60 |
0,70 |
|
53 |
1,43 |
1,31 |
1,44 |
2,12 |
1,52 |
Содержание хлорофилла a. В таблице 2 представлено изменение концентрации хлорофилла «a» в суспензии микроводоросли. Среднее значение в контрольных экспериментах составило 4,12±1,64. Доверительный интервал: 2,48–5,76. Согласно полученным данным, облучение на частотах 38, 39, 42, 43, 47 ГГц не приводило к изменению концентрации хлорофилла «а». При облучении на частоте 40 ГГц показатели превышают контрольное значение, что свидетельствует о стимулировании накопления хлорофилла «а». При частотах 41, 44, 45, 46, 48, 49, 50, 51, 52, 53 ГГц результаты ниже контрольных значений.
Содержание хлорофилла b. В таблице 2 показано изменение концентрации хлорофилла «b» в зависимости от частоты. Контрольное значение составило 3,86±1,81, доверительный интервал – 2,05–5,67. При воздействии на частотах 39, 41, 42, 46, 48, 50, 51, 52, 53 ГГц отмечено снижение концентрации. При воздействии на частотах 38, 40, 43, 44, 45, 47, 49 ГГц изменения концентрации хлорофилла b обнаружено не было.
Содержание хлорофилла c1 и с2. В таблице 2 показано изменение концентрации хлорофиллов «c1» и «c2» при ЭМИ воздействии. Контрольное значение составило 2,88±2,16, доверительный интервал – 0,72–5,04. При воздействии на частотах 51, 52 ГГц отмечено снижение прироста концентрации.
Содержание каротиноидов. В таблице 2 показано изменение концентрации каротиноидов в зависимости от частоты. Контрольное значение составило 3,55±1,57, доверительный интервал лежит в диапазоне 1,98–5,12. При воздействии на частотах 39, 41, 42, 46, 48–53 ГГц отмечено снижение прироста концентрации.
Выводы
По результатам исследования было выявлено стимулирующее действие ЭМИ КВЧ на микроводоросль Chlorella vulgaris в водной среде на частоте 40 ГГц. Увеличение концентрации биомассы водоросли за сутки составило 10,34. Показатель превышает контрольное значение в 2,37 раз.
Для сравнения полученных результатов взята работа М.Г. Гапочки [11]. В работе М.Г. Гапочки изучалось действие ЭМИ в диапазоне 37,5–53–57 ГГц. Действующие частоты: 37,5, 42,25, 46,95, 53,57 ГГц. Объекты исследования: культуры зеленой микроводоросли Scenedesmus quadricauda Breb., инфузории Spirostomum ambiguum Ehrem., ракообразного Daphnia magna Straus, нефтеокисляющих бактерий Rhodococcus erythropolis E-15, люминесцирующих бактерий Escherichia coli K12 TG1, почвенные сообщества, иммунокомпетентные клетки [11]. Обнаружены стимулирующие и ингибирующие эффекты облучения. В проведенной нами работе были обнаружены стимулирование при облучении на частоте 40 ГГц и пики концентрации биомассы, не превышающие контрольных показателей, при облучении на частотах 43, 47, 50, 53 ГГц. На частотах 42, 44, 45, 46, 48, 49, 51, 52, 53 ГГц наблюдается снижение биомассы.
Результаты сопоставлены с результатами Н.А. Суховского [10]. В работе Н.А. Суховскому удалось увеличить прирост биомассы Chlorella vulgaris в 2 раза в ЭМП (напряженность 15 кВ, длительность воздействия 72 ч). По результатам нашего исследования ускорение роста составило 2,37 раза, что показывает возможность применения ЭМИ 40 ГГц для разработки методик стимулирования Chlorella.
Перспективы дальнейших исследований. Результаты работы носят характер предварительного исследования. Они будут полезны в исследованиях ЭМИ КВЧ на Chlorella, а также для разработки методов стимулирования роста микроводоросли Chlorella vulgaris.
Необходимо изучить роль времени экспозиции на изучаемые эффекты, чтобы подобрать время экспозиции, дающее максимальный прирост биомассы, а также сравнить эффекты воздействия непрерывного и импульсного излучения.
Chlorella vulgaris применяется для восстановления водоемов при цветении [15]. Кроме того, результаты работ [7, 8] показывают возможность очистки сточных вод горнодобывающих производств от неорганического азота. Результаты работы М.Г. Гапочки показывают изменение устойчивости гидробионтов к токсикантам (фенолу, кадмию, кобальту, меди) в водных растворах при воздействии ЭМИ КВЧ. Возможно, ЭМИ КВЧ может помочь в повышении устойчивости Chlorella к высоким содержаниям соединений азота. Поэтому разработка методик стимулирования Chlorella для очистки вод является перспективным направлением исследований, так же как и изучение комбинированного действия загрязнителей (тяжелых металлов, неорганического азота и фосфора) и электромагнитного излучения на Chlorella.
Авторы выражает благодарность сотрудникам Лаборатории водных экосистем ИППЭС КНЦ РАН, лично заведующему лабораторией Денисову Дмитрию Борисовичу, кандидату биологических наук, а также ведущему инженеру Косовой Анне Львовне за помощь в подборе методики анализа хлорофилла, предоставление возможности проведения анализа на базе лаборатории.
Исследование частично финансировалось из средств гранта РФФИ № 19-05-50065 «Микрочастицы».



