Верховые болотные комплексы южноприбеломорского типа широко распространены в арктической зоне РФ [1-3]. Болотные экосистемы играют существенную роль в круговороте углерода. Являясь единственными в наземном биоме экосистемами, обеспечивающими постоянный сток углерода, они веками аккумулируют его в составе торфяной залежи. Не менее важна климатообразующая роль болот, связанная с эмиссией углекислого газа и метана, с балансом тепла и влаги [4, 5].
Одни из важнейших аспектов функционирования торфяников – биохимические процессы, протекающие в них и включающие в себя ряд отдельных циклов: минерализацию и гумификацию органического вещества, растворение и преобразование продуктов гидролиза посредством микробиологической трансформации и физико-химических процессов обмена [6, 7]. Это приводит к газообмену между торфом и атмосферой. За счет высвобождения углерода в виде метана и углекислого газа меняются состав органического вещества, молекулярная структура отдельных компонентов, протекает синтез новых соединений. В совокупности это обеспечивает устойчивость болот.
Численность и состав микроорганизмов торфа, обусловливающие скорость протекания биологических процессов, зависят не только от высокого содержания органического углерода, но и от внешних факторов, таких как: влажность, температура, минерализация и др. [8]. В торфяниках, где выявлено преимущественное образование метана из-за понижения уровня грунтовых вод вследствие осушительной мелиорации, значительно увеличивается образования диоксида углерода [9]. Температура и обводненность торфяной залежи существенно варьируют в течение года.
Цель исследования: оценка сезонной динамики численности микроорганизмов верхового болотного комплекса южноприбеломорского типа.
Материал и методы исследования
Исследования проводили на ненарушенном участке в центре грядово-мочажинного комплекса Иласского болотного массива, расположенного в Приморском районе Архангельской области (64° 19’ 43" N, 40° 36’ 45" E) и относящегося к южноприбеломорскому типу верховых болот.
Окислительно-восстановительный потенциал (ОВП) и pH торфяной залежи определяли с использованием универсального анализатора Expert-001 («Эконикс-Эксперт», Россия) с комбинированным платиновым электродом ERP-105 для измерения значений ОВП (E, мВ) в жидких и гетерогенных средах и комбинированным электродом ESK-10603 для измерения pH.
Пересчет полученных значений Eh на стандартные условия (t=25 ºC и pH=4,0) проводили с использованием следующих уравнений:
Et = E + 197 – 0,76 × (t – 25) (1)
Eh = Et + 56,2 × (pH – 4) (2)
где E (мВ) – измеренное значение окислительно-восстановительного потенциала;
197 (мВ) – поправочный коэффициент для полуэлектрода, насыщенного хлоридом серебра, чтобы показания были эквивалентны показаниям обычного водородного электрода при 25 ºC;
t (ºC) – температура торфа в момент измерения.
Отбор репрезентативных проб торфа проводили методом послойного бурения с разделением на 20-сантиметровые горизонты пробоотборником для торфяных отложений P 04.09 (EIJKELKAMP, Нидерланды) по ГОСТ 17644 – 83.
Степень разложения торфа определяли по ГОСТ 10650-2013, тип торфа – методом световой микроскопии (ГОСТ 28245-89) в проходящем свете с использованием микроскопа Altami Био 2 (Россия) в комплекте с цифровой камерой U3CMOS14000KPA, содержание влаги – гравиметрическим методом (ГОСТ 28268-89), зольность – методом сжигания (ГОСТ 11306-2013).
Содержание C, H и N в пробах определяли на анализаторе элементного состава EuroEA 3000 CHN (Eurovector, S.p.A.), а О – по разнице между общей массой и суммой других элементов.
Отбор проб торфа для микробиологических исследований: (1) в морозный период с высоким уровнем снежного покрова (март), (2) в период активного снеготаяния и максимальной обводненности болотного массива (конец мая), (3) в период летней межени (конец июля), (4) в осенний период (начало октября). Торфяной керн извлекали с заданной глубины и, используя стерильные перчатки, отбирали пробу из центральной части каждого керна в стерильную тару. Гомогенизированные пробы торфа переносили в колбы, содержащие 100 мл стерильной воды, и экстрагировали с помощью ультразвуковой обработки (ультразвуковой диспергатор УЗДН-1) в течение 2 минут при силе тока 0,44 А и частоте колебаний 22 кГц.
Микробиологические исследования проводили по общепринятым методикам [10]. Посев производили в 3–5-кратной повторности из соответствующих разведений на следующих средах: мясо-пептонный агар (МПА) для определения аммонифицирующих бактерий, утилизирующих органические формы азота; крахмало-аммиачный агар (КАА) – бактерий, усваивающих минеральные формы азота; декстрозо-пептонный агар Сабуро (ДПА) – грибов и кислотолюбивых бактерий (дрожжей); голодный агар (ГА) – олиготрофных автохтонов. Используемые методы не позволяют учесть все разнообразие жизнеспособных бактерий, но дают общую характеристику состава аэробной и факультативно-анаэробной частей микробного сообщества [11-13].
Результаты исследования и их обсуждение
Согласно проведенным исследованиям, торфяной залежи Иласского болотного массива свойственны следующие характеристики (таблица). Основная часть залежи сложена малозольным верховым торфом сфагнового типа низкой степени разложения (до 15–20%). В ботаническом торфе преобладает Sphagnum fuscum (Schimp.) H. Klinggr. На глубине ниже 240 см появляется переходный торф с более высокой степенью разложения (до 40%), образованный преимущественно травянистой мезотрофной растительностью (Scheuchzeria palustris L. и Eriophorum vaginatum L.). Доминирование олиготрофных видов согласуется с низким содержанием минеральных компонентов (таблица). Согласно полученным экспериментальным данным, средние значения зольности по горизонтам, как правило, не превышают 0,9%. Незначительное повышение (до 1,2–1,3%) наблюдается в поверхностном и придонном слоях.
Вся торфяная залежь по степени аэрации и трансформации органического вещества может быть условно поделена на несколько зон (рис. 1): акротелм (торфогенный, аэрируемый слой) зона I (от поверхности до 40 см) и катотелм (не аэрируемый слой) – зона II (ниже 40 см). В катотелме, в свою очередь, можно выделить еще 3 подзоны: зону промерзания (40–100 см), зону консервации (100–300 см) и придонную зону (300–360 см), протяженность которых в вертикальной проекции залежи определяется климатическими, гидрологическими и геологическими особенностями расположения болотного массива. По вертикальному профилю залежи происходят изменения окислительно-восстановительного потенциала (рис. 1) и элементного состава (таблица, рис. 2). Слабоокислительные условия при движении от поверхности вглубь залежи постепенно меняются на слабовосстановительные, а затем – на умеренно восстановительные.
Изменение типа, степени разложения, зольности и элементного состава торфа по глубине
|
Горизонт, см |
Тип торфа |
R,% |
Z,% |
Атомное содержание |
|||
|
N ср |
C ср |
H ср |
O ср |
||||
|
0–20 |
пушицево-сфагновый |
0–5 |
1,18± 0,02 |
0,07 |
4,01 |
6,95 |
2,59 |
|
20–40 |
сфагновый |
5–10 |
0,72± 0,01 |
0,09 |
4,32 |
7,11 |
2,35 |
|
40–60 |
сфагновый |
5–10 |
0,61± 0,01 |
0,08 |
4,20 |
7,02 |
2,45 |
|
60–80 |
пушицево-сфагновый |
5–10 |
0,85± 0,03 |
0,11 |
4,63 |
7,36 |
2,07 |
|
80–100 |
сфагновый |
10–15 |
0,91± 0,02 |
0,13 |
4,82 |
7,65 |
1,90 |
|
100–120 |
пушицево-сфагновый |
10–15 |
0,92± 0,05 |
0,10 |
4,61 |
7,30 |
2,10 |
|
120–140 |
пушицево-сфагновый |
12–17 |
0,97± 0,01 |
0,10 |
4,49 |
7,31 |
2,20 |
|
140–160 |
сфагновый |
12–17 |
0,78± 0,01 |
0,11 |
4,62 |
7,26 |
2,10 |
|
160–180 |
сфагновый |
15–20 |
0,81± 0,02 |
0,10 |
4,38 |
7,03 |
2,30 |
|
180–200 |
сфагновый |
15–20 |
0,76± 0,03 |
0,12 |
4,52 |
7,33 |
2,16 |
|
200–220 |
сфагновый |
15–20 |
1,26± 0,02 |
0,11 |
4,56 |
7,22 |
2,13 |
|
220–240 |
сфагновый |
15–20 |
0,83± 0,02 |
0,10 |
4,39 |
7,28 |
2,28 |
|
240–260 |
пушицево-сфагновый |
20–30 |
0,73± 0,01 |
0,13 |
4,70 |
7,42 |
2,01 |
|
260–280 |
пушицево-шейхцериево-сфагновый |
20–30 |
0,9± 0,03 |
0,13 |
4,75 |
7,49 |
1,96 |
|
280–300 |
шейхцериево-сфагновый |
30–35 |
0,95± 0,02 |
0,12 |
4,76 |
7,18 |
1,98 |
|
320–340 |
шейхцериево-сфагновый |
35–40 |
1,24± 0,05 |
0,13 |
4,73 |
7,40 |
1,98 |
|
340–360 |
шейхцериевый |
35–40 |
1,2± 0,01 |
0,15 |
4,64 |
7,20 |
2,03 |
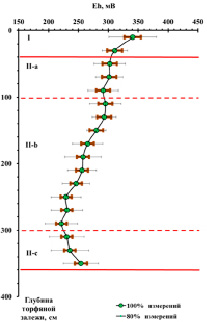
Рис. 1. Изменение окислительно-восстановительного потенциала Eh (мВ) по глубине торфяной залежи
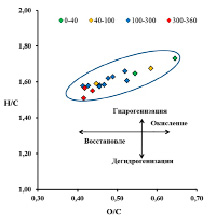
Рис.2. Диаграмма Ван Кревелена исследованных образцов торфа
Для исследования сезонной динамики численности микроорганизмов были выбраны слои, различающиеся по окислительно-восстановительному режиму: 0–10, 40–50, 100–110, 150–160, 200–210 и 300–310 см. Согласно полученным данным (рис. 3), численность аммонификаторов на исследуемом участке залежи варьировалась от 0,7·102 до 2,9·105 КОЕ/г абсолютно сухого торфа (а.с.т.). Максимальное значение во все периоды отбора приходилось на верхний слой акротелма (0–10 см). При продвижении вглубь залежи уже на нижней границе акротелма (40–50 см) наблюдаются резкое снижение их количества в 30 и более раз и дальнейшее сохранение значений на уровне 0,5–3,0·103 КОЕ/г.
Сезонные изменения численности аммонификаторов в акротелме свидетельствуют о ключевом влиянии уровня аэрации и прогрева залежи, что согласуется с исследованиями олиготрофных и эвтрофных болот Западной Сибири [14, 15]. В частности, в зимне-весенний период численность этой группы микроорганизмов практически не поменялась и составила 0,98–0,99·105 КОЕ/г. Однако повышение температуры воздуха и залежи, а также снижение уровня болотных вод (УБВ) привели к увеличению числа выращенных колоний втрое – до 2,9·105 КОЕ/г. Таким образом, максимум численности бактерий, усваивающих органический азот, приходится на июль – период максимального прогрева верхних слоев торфяной залежи, также сопровождающийся минимальными значениями уровня болотных вод (УБВ).
Численность бактерий, усваивающих минеральные формы азота, существенно ниже и варьируется в пределах от 0,9·102 до 6,3·105 КОЕ/г, в глубинной динамике прослеживаются аналогичные тенденции. Наибольшие значения, так же как и для аммонификаторов, характерны для верхнего слоя акротелма, однако снижение численности происходит не так резко. Сезонный максимум приходится на зимний период, минимальная численность в акротелме составляет 3,0·104 КОЕ/г и приходится на июль. Такая динамика, вероятно, обусловлена переходом азота из органической формы в минеральную и обратно.
Численность грибов и ацидофильных бактерий в торфяной залежи по глубине залегания изменяется аналогичным образом в пределах от 0,2·102 до 7,4·104 КОЕ/г. Скачок численности происходит в период прогрева залежи, после весеннего паводка, и достигает максимума в июле, что примерно в 7 раз выше по сравнению с майскими значениями.
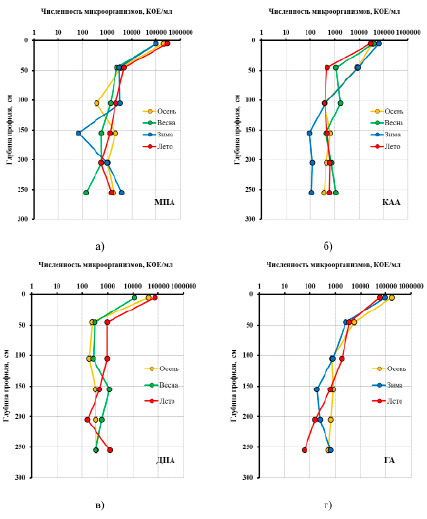
Рис. 3. Сезонная динамика изменения численности микроорганизмов по глубине залежи, выращенных на различных видах агара: а – МПА (мясо-пептонный агар); б – КАА (крахмально-аммиачный агар); в – ДПА (декстрозо-пептонный агар); г – ГА (голодный агар)
Олиготрофные автохтоны, выращиваемые на голодном агаре, – единственная группа микроорганизмов, которая проявляет максимальную активность осенью в период снижения численности аммонификаторов, грибов и дрожжей, что вполне логично. Общий рост численности эвтрофных микроорганизмов в летний период приводит к постепенному дефициту биогенных элементов и, как следствие, к снижению их численности, при этом олиготрофные автохтоны, напротив, при недостатке питательной среды начинают набирать численность, которая достигает предельных значений в октябре (1,7·105 КОЕ/г).
Данные о численности микробных сообществ в верховых болотах свидетельствуют о протекании процессов микробиологической деструкции по всей глубине залежи. Однако их интенсивность значительно снижается с глубиной. Отчасти это может быть связано с высоким содержанием в верховых торфах мохового типа сфагнанов, особенно устойчивых к биодеградации в условиях кислой среды (рН = 3,7–4,9), и сфагнолов – компонентов фенольной природы, проявляющих в анаэробных условиях высокую токсичность по отношению к микроорганизмам [14]. При этом наиболее достоверно данные тенденции позволяют объяснить участие анаэробной биоты и действие экзоферментов, что требует в дальнейшем более детального изучения.
Выводы
1. Для всех морфологических групп микроорганизмов характерно увеличение относительных колебаний сезонной численности при углублении рассматриваемой залежи. При этом наиболее сильно меняется количество амминифицирующих бактерий (от 1,9 до 28,9 раза) и нитрифицирующих бактерий (от 2,1 до 18,4 раза). Олиготрофные бактерии изменяются по глубине более однородно (от 11,1 до 2,4 раза), как и грибы с ацидофильными бактериями (от 6,4 до 3,5 раза).
2. Наибольшие количественные сезонные изменения происходят в чувствительном к воздействию сезонных изменений климатических факторов молодом верхнем слое залежи (0–40 см), поскольку он напрямую подвержен действию солнечной радиации и осадков, определяющих величину колебаний уровня болотных вод. Нижележащие и в той или иной мере изолированные слои залежи, формирование которых растянуто во времени, в меньшей мере подвержены сезонным климатическим пульсациям. При этом они могут служить источником информации о влиянии долговременных климатических воздействий.
Исследование выполнено при финансовой поддержке РФФИ в рамках Минобрнауки России в рамках темы № FUUW–2022–0067 «Особенности образования и диагенеза органического вещества в условиях водно-болотных экосистем Арктической зоны РФ».



