Наиболее распространенные в природе формы щелочноземельного бентонита для практического использования в различных сферах, как правило, требуют предварительной обработки сырья с целью улучшения технологических показателей глинопорошков. Суть дополнительного воздействия на природное сырье (активация бентонита) заключается в насыщении минеральной основы исходного материала ионами натрия. Одним из самых распространенных способов активации является обработка глины карбонатом натрия (кальцинированной содой), в ходе которой происходит замена двухзарядных катионов щелочноземельных металлов (кальция и магния) на более подвижные в водной среде однозарядные катионы натрия, содержащиеся в данной системе в избытке [1]. Анионы добавляемого реагента способны связывать ионы кальция в нерастворимый в воде карбонат кальция, способствуя смещению равновесия ионного обмена в сторону выхода ионов кальция из структуры бентонита и внедрения в него ионов натрия. Можно предположить, что использование еще более подвижного иона – катиона водорода – будет способствовать более полному вытеснению ионов кальция, а это, в свою очередь, сделает более эффективным дальнейший этап насыщения ионами натрия (процесс активации) [2, 3].
Целью работы является изучение влияния растворов минеральных кислот в процессе активации щелочноземельной бентонитовой глины на технологические характеристики природного сырья.
Материалы и методы исследования
Материалом для исследования послужили образцы бентонитовой глины месторождения «10-й Хутор» (Республика Хакасия). Минеральный состав исследуемого бентонита (объем. %): монтмориллонит – 70–72; гидрослюда – 1–2; каолинит – 7–8; кварц – 7–8; щелочной полевой шпат – 6–7; слюда – 4–5; кальцит – 1–2. Соотношение суммы ионов К+ и Nа+ к сумме ионов Ca2+ и Мg2+ – 0,17 [4]. Подготовка образцов и выполнение количественных измерений проводились в соответствии с ГОСТ 28177-89 [5].
Для получения модельных систем глину количеством 30 г смешивали с 10 мл 0,1М раствора минеральной кислоты, выдерживали в закрытой чашке Петри 24 часа. Затем образец сушили при температуре 110оС в течение 6 часов. Высушенное сырье измельчали и просеивали через сито № 05. Дальнейшую активацию бентонита проводили, смешивая глину с карбонатом натрия при комнатной температуре в следующем соотношении компонентов, мас.%: бентонит: карбонат натрия – 65–70: 20–25, остальное – вода. Смесь выдерживали в закрытой чашке Петри 24 часа, затем сушили при температуре 110оС в течение 6 часов. Высушенный материал измельчали и просеивали через сито № 05.
В качестве индикаторов происходящих изменений в процессе активации бентонитовых дисперсий проводили оценку ионообменного комплекса модельной системы (содержание подвижных форм ионов щелочноземельных металлов), коллоидальности и степени дисперсности полученных образцов.
Определение суммы катионов кальция и магния
Навеску глины массой 1 г помещали в мерную колбу на 100 мл, прибавляли 0,2 г углекислого кальция, доливали до метки 1 н раствором хлористого натрия, выдерживали 24 часа и отфильтровывали. В полученном фильтрате определяли содержание ионов кальция и магния. Для этого к пробе объемом 50 мл добавляли 5 мл аммонийного буферного раствора, индикатор (эриохром черный) и титровали 0,05 н раствором трилона Б до перехода окраски от красной к синей. Концентрацию катионов кальция и магния (X), мг∙экв на 100 г глины вычисляли по формуле:
X = (V ∙ 0,05 ∙ 100) / m ,
где V – объем раствора трилона Б, израсходованный на титрование, мл; 0,05 – нормальность раствора трилона Б; 100 – коэффициент для пересчета на 100 г глины; m – масса глины в аликвотной части раствора, г.
Определение коллоидальности проводили методом, основанным на измерении седиментационного объема, образующегося в глинистой суспензии во времени. Для этого навеску глины массой 0,5 г помещали в мерную пробирку, приливали воду до общего объема 15 мл и взбалтывали до получения однородной суспензии. Затем добавляли 0,1 г окиси магния и снова взбалтывали в течение 1 минуты. По истечении 24 часов замеряли объем образовавшегося осадка. Коллоидальность (К) в процентах вычисляли по формуле:
K = (V ∙ 100) / 15,
где V – объем осадка глины в пробирке, мл; 15 – общий объем глины и воды в пробирке, мл.
Фракционный состав бентонитовых дисперсий, размер частиц и удельную поверхность определяли методом дифракции лазерного излучения на лазерном анализаторе микрочастиц «Ласка ТД».
Результаты исследования и их обсуждение
В работе исследовалось поведение образцов бентонитовой глины в растворах минеральных кислот в качестве предварительного этапа процесса активации природного сырья.
Таблица 1
Исследуемые модельные системы
|
Модельная система |
Обозначение |
Описание |
|
Система 1 |
Исходная карьерная бентонитовая глина (пробоподготовка по ГОСТ 28177-89 [5]) |
|
|
Система 2 |
Активированный карбонатом натрия бентонит (Система 1 + Na2CO3) |
|
|
Система 3 |
Бентонит, обработанный соляной кислотой (Система 1 + HCl) |
|
|
Система 4 |
Активированный карбонатом натрия бентонит (Система 3 + Na2CO3) |
|
|
Система 5 |
Бентонит, обработанный серной кислотой (Система 1 + H2SO4) |
|
|
Система 6 |
Активированный карбонатом натрия бентонит (Система 5 + Na2CO3) |
Таким образом, ионом, вытесняющим катионы щелочноземельных металлов, выступает протон – катион водорода (H+). Обладая наибольшей подвижностью в водной среде ввиду своих минимальных размеров, протон в процессе ионного обмена должен максимально увеличить ионообменную емкость материала, переведя при этом дополнительные количества ионов кальция и магния в подвижную форму.
Исследованию подвергались 6 модельных систем, включающих бентопорошок в различном сочетании с растворами соляной, серной кислот и карбоната натрия (табл. 1).
Замена воды в модельной системе на раствор минеральной кислоты существенно меняет свойства материала. В системе 3, в которой исходная глина обрабатывалась 0,1М раствором HCl, коллоидальность составила 27,3%, в системе 5, в которой исходная глина обрабатывалась 0,1М раствором H2SO4, – 20,0%. Сумма обменных катионов в химически модифицированных бентопорошках составила: 33,5 и 35,0 мг∙экв на 100 г глины соответственно (табл. 2).
Таблица 2
Физико-химические характеристики модельных систем
|
Модельная система |
Коллоидальность, % |
[Ca2+]+[Mg2+], мг∙экв/100 г |
|
Система 1 |
23,3 |
32,5 |
|
Система 2 |
93,3 |
17,5 |
|
Система 3 |
27,3 |
33,5 |
|
Система 4 |
88,6 |
18,0 |
|
Система 5 |
20,0 |
35,0 |
|
Система 6 |
98,6 |
24,0 |
Полученные результаты показывают, что присутствие в системе избытка ионов водорода (кислая среда) способствует увеличению концентрации ионообменного комплекса бентонита (ионов, не связанных с кристаллической решеткой алюмосиликата иными, кроме ионной связи, взаимодействиями). Факт увеличения концентрации ионов кальция в обработанных кислотой системах 3 и 5 по сравнению с контрольным образцом (система 1) свидетельствует об их наличии в составе минерала.
Коллоидальность всех образцов после воздействия кислоты резко уменьшается. Это вполне объяснимо и ожидаемо, так как протон – очень плохо гидратируемый ион и не может в этом плане конкурировать с катионами металлов. Между тем, именно за счет связывания воды катионами в межслоевых пространствах структуры минералов бентонита происходит набухание материала, что является основной причиной способности глины образовывать и сохранять в водной среде устойчивую коллоидную систему [6]. Низкая коллоидальность модельных систем, обработанных кислотой, может быть связана также с тем, что кислая среда для отрицательно заряженных слоев минералов бентонитовой глины негативно сказывается на способности частиц алюмосиликата сохранять устойчивую водную дисперсию.
Для восстановления более привычного для бентонита катионного состава из ионов металлов в качестве второго этапа активации бентопорошков использовали добавление в систему ионов натрия в форме кальцинированной соды – карбоната натрия (системы 4, 6).
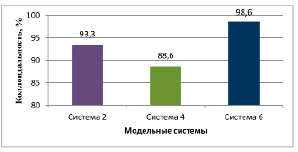
Рис. 1. Коллоидальность модельных систем
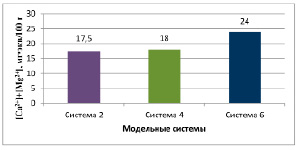
Рис. 2. Содержание обменных катионов
Определены физико-химические характеристики полученных модельных систем. В системе 4 значение коллоидальности составило 88,6%, в системе 6 – 98,6%. Сумма обменных катионов в системе 4 – 18,0, в системе 6 – 24,0 мг∙экв на 100 г глины (рис. 1, 2).
Таким образом, в обоих случаях наблюдаются связывание ионов щелочноземельных металлов и восстановление показателей коллоидальности до максимальных значений. Все это можно объяснить активно протекающими ионообменными процессами. Значит, предварительная обработка кислотой структуру алюмосиликата не повреждает, а лишь только способствует более интенсивному вымыванию катионов. Это, в свою очередь, дает возможность для более эффективного процесса обогащения бентонитового сырья ионами натрия (процесс активации).
На емкость ионного обмена глинистых частиц влияет и степень дисперсности материала. При уменьшении размера частиц глины можно ожидать и увеличение коллоидальности образцов вследствие увеличения суммарной площади поверхности системы и более свободного доступа воды к межслоевым пространствам минерала.
Модельные системы были исследованы на предмет определения размеров составляющих их частиц и удельной поверхности (табл. 3, 4).
Полученные данные показывают, что контакт бентонита с раствором кислоты способствует увеличению содержания крупных фракций частиц глины. При этом в случае обработки раствором серной кислоты этот эффект минимальный. В исследуемых образцах бентонитовой глины среди основных фракций представлены частицы размером от 2 до 5 мкм, от 5 до 20 мкм и от 20 до 50 мкм. При обработке кислотами содержание мелких частиц (фракция 2–5 мкм) значительно уменьшается (на 99% и 63% в случае воздействия соляной и серной кислот соответственно). Содержание средней фракции (5–20 мкм) практически не изменяется, а доля крупных частиц (20–50 мкм) значительно увеличивается. Последующее добавление соды, наоборот, способствует уменьшению среднего размера частиц и, соответственно, увеличению удельной поверхности дисперсной фазы системы.
Таблица 3
Фракционный состав модельных систем
|
Фракция частиц, мкм |
Содержание частиц в модельных системах, % |
||||||
|
min |
max |
1 |
2 |
3 |
4 |
5 |
6 |
|
0 |
0,50 |
0,00 |
0,00 |
0,00 |
0,00 |
0,00 |
0,00 |
|
0,50 |
1,00 |
0,00 |
0,00 |
0,00 |
0,00 |
0,00 |
0,08 |
|
1,00 |
2,00 |
0,32 |
0,09 |
0,00 |
0,12 |
0,07 |
2,87 |
|
2,00 |
5,00 |
16,49 |
6,83 |
0,90 |
8,90 |
6,08 |
39,69 |
|
5,00 |
20,00 |
79,51 |
79,22 |
65,49 |
81,06 |
78,82 |
56,61 |
|
20,00 |
50,00 |
3,68 |
13,59 |
32,17 |
9,81 |
14,71 |
0,75 |
|
50,00 |
100,00 |
- |
0,28 |
1,43 |
0,10 |
0,31 |
- |
Таблица 4
Сравнение удельной поверхности частиц бентопорошков модельных систем
|
Модельная система |
Средний диаметр частиц, мкм |
Удельная поверхность, мкм2/г |
1 |
2 |
3 |
4 |
5 |
|
847 531 |
622 393 |
412 329 |
679 745 |
601 903 |
|||
|
1 |
9,12 |
847 531 |
1,00 |
||||
|
2 |
12,91 |
622 393 |
–0,73 |
1,00 |
|||
|
3 |
18,61 |
412 329 |
–0,49 |
–0,66 |
1,00 |
||
|
4 |
11,66 |
679 745 |
–0,80 |
+1,09 |
+1,65 |
1,00 |
|
|
5 |
13,31 |
601 903 |
–0,71 |
-0,97 |
+1,46 |
–0,89 |
1,00 |
|
6 |
6,30 |
1 259 772 |
+1,49 |
+2,02 |
+3,06 |
+1,85 |
+2,09 |
Следует отметить, что в модельной системе с серной кислотой происходит значительное увеличение удельной поверхности даже по сравнению с известным способом активации бентонита кальцинированной содой [1]. В дисперсии наблюдается резкое снижение доли крупной (20–50 мкм) и средней (5–20 мкм) фракций на 95% и 28% соответственно. При этом доля мелких фракций заметно возрастает. Так, доля фракции от 2 до 5 мкм в системе 2 (активированный обычным способом бентонит) составляет 6,83%, а в системе 6, прошедшей предварительную обработку серной кислотой, доля этой фракции увеличивается практически в 6 раз (39,69%). Кроме того, в системе 6 появляются фракции еще более мелких частиц (от 1 до 2 мкм в количестве 2,87%). Наблюдаемые закономерности можно объяснить большей эффективностью ионного обмена в изучаемой системе, где присутствие сильной минеральной кислоты обеспечивает большую подвижность всех катионов в системе и более эффективную замену ионов щелочноземельных металлов на ионы натрия, что является конечной целью обогащения природного бентонитового сырья путем его химической активации.
Заключение
Добавление минеральной кислоты в систему водной суспензии щелочноземельной бентонитовой глины существенно изменяет технологические параметры минерального сырья. Растворы соляной и серной кислот снижают коллоидальность материала до минимальных значений для исследуемой системы. При этом концентрация подвижных ионов щелочноземельных металлов увеличивается. Увеличение концентраций ионов кальция и магния можно объяснить присутствием в системе ионов водорода, которые, являясь более подвижными ионами в водной среде, активно вытесняют катионы металлов из межслоевых пространств минералов бентонита.
Появление в модельных системах катионов натрия восстанавливает характерные свойства бентонитовой глины. Коллоидальность восстанавливается в ряде случаев до максимальных значений, что может означать, что бентонит в кислой среде сохраняет свою уникальную слоистую структуру, при этом за счет лучшего «вымывания» изначально входивших в его состав ионов кальция и магния ионообменная емкость материала существенно увеличивается (в условиях нашего эксперимента – на 30–40%).
Контакт бентонита с раствором минеральной кислоты способствует увеличению содержания крупных фракций частиц глины. Последующее добавление соды, наоборот, способствует уменьшению среднего размера частиц и, соответственно, увеличению удельной поверхности системы. В модельной системе с серной кислотой происходит значительное увеличение удельной поверхности даже по сравнению с известным способом активации бентонита кальцинированной содой.
Описываемая технология обработки природного минерального сырья, включающая последовательное воздействие на алюмосиликат серной кислоты и кальцинированной соды, может быть предложена как альтернативный вариант процесса обогащения щелочноземельного бентонита.
Авторы благодарят ООО «Бентонит Хакасии» за предоставленные для изучения образцы.



