Электрофоретические компоненты запасных белков в семенах злаковых и бобовых культур передаются из поколения в поколение как генетически детерминированный признак, не изменяются и остаются стабильными в зависимости от почвенно-климатических и условий возделывания, используются как универсальные генетические маркеры и сохраняют свою научную актуальность в изучении генетического разнообразия и в ускорении процесса селекции [1].
Так, часть ДНК, связанная с областью какого-либо гена или генов в геноме, является маркером. Маркеры делятся на три типа: морфологические, биохимические и ДНК-маркеры. Молекулярные маркеры классифицируются на две группы: не связанные с полимеразной цепной реакцией (RFLP) и связанные (RAPD, AFLP, SSR) [2]. С помощью молекулярных маркеров можно обеспечить более четкое выявление генетического материала in vitro. С использованием различных маркеров были обнаружены генетические вариации в последовательностях ДНК [3]. Генетическая вариация и приспособляемость к условиям окружающей среды у сортов нута высока. Также большое влияние на процессы, связанные с эволюцией сортов, оказала человеческая деятельность. К ней относятся одомашнивание, выращивание и иммиграция [4]. Несмотря на то, что это очень важно, в некоторых исследовательских работах признавалось, что содержание белка в зерне у различных сортов нута различно и генетически обусловлено. Накопление белка в зерне нута управляется 3–7 генами. Вдобавок генетически это может создать изменчивость в составе белка зерна в сортах нута [5]. Использование биохимических и молекулярных маркеров представляет преимущество перед использованием других маркеров, например фенотипических. Репродуктивность делает эти маркеры особенно привлекательными [6]. В составе зерен нута, выращенного на разных почвах, содержание альбуминов, глобулинов, глютелинов и проламинов в значительной мере различается. Гупта, используя электрофорез в SDS полиакриламидном геле, представил разницу в молекулярном весе полосок белка, различные варианты белков зерна, то есть глобулины, глютелины, альюумины и проламины наблюдались в различных вариантах. Метод электрофореза в полиакриламидном геле (SDS-PAGE) используется для разделения белков [7]. В оценке бобовых растений использовался SRAP [8, 9]. Для оценки генетического разнообразия маркеры SRAP применяются редко [10–12]. В исследовании генетической вариации нута впервые были использованы SRAP маркеры. Для оценки генетической изменчивости в нуте используются эти маркеры.
Используя SDS-PAGE, был определен полиморфизм глобулинов, проламинов и глютелинов в генотипах нута. Вообще, в зернах бобовых растений альбумины составляют 20–35 %, глобулины – 43–55 %, проламины – 0,73–2,70 % и глютелины – 11,84–32,21 % [13]. Из них альбумины растворяются в воде, глобулины – в солях, проламины – в спирте, а глютелины – в щелочи. Альбумин и глобулин вместе составляют 63–90 % от общего белка зерна. Растворимая в солях фракция (глобулины) составляет 45–50,3 % от общей массы. Среднее значение, составляющее 47,7 % растворимой фракции, является основной белковой фракцией. Исследуемый белок нута считается водорастворимой фракцией. Альбумины со своим средним значением составляют 31,2–35,5 % от общей растворимой фракции. Третьими самыми распространенными белками зерна, содержание которых варьирует между 15,1 и 20,5 %, являются глютелины [14].
В данной исследовательской работе преследовалась цель идентификации, паспортизации и изучения генетического разнообразия местных и интродуцированных генотипов нута.
Материалы и методы исследования
В исследовательской работе были использованы местные и интродуцированные из ICARDA образцы нута. В 2021 г. на Апшеронской опытной базе Института генетических ресурсов НАНА было посеяно 76 образцов, полевые испытания проводились во II–III-й декаде ноября.
Электрофоретический анализ белка глобулина проводился в отделе «Биохимическая генетика и технология» Института генетических ресурсов НАНА. Экстракцию и электрофоретический анализ в полиакриламидном геле (A-PAGE) запасных белков глобулинов из зерен образцов нута проводили с помощью нового метода, усовершенствованного на основе модифицированного метода Ф.Ф. Поперелян. Так, после измельчения образца нута и его экстракции дважды в 500 мкл 70 %-ного спирта и центрифугирования каждый раз при 3500 об./мин, экстракт промывали дважды в 500 мкл растворе 0,03 %-ного уксуса и ацетона и каждый раз после размешивания механической мешалкой его центрифугировали при скорости 3500 об./мин. После добавления к полученному в четвертый раз экстракту 500 мкл 9-молярного раствора уксус-мочевины, проводили анализ на аппарате вертикального электрофореза в глицин-ацетатном буфере (pH – 3,5).
После того, как паттерны пронумеровали, их сравнивали друг с другом в каждой зоне, а затем осуществляли нумерацию всех паттернов без учета повторов. Так, если какой-то определенный паттерн повторялся в образцах, этому паттерну новый номер не присваивался, и так проделывалось со всеми паттернами. Частота встречаемости каждого паттерна образцов нута по всем зонам вычислялась на основании индекса генетического разнообразия Нея по нижеследующей формуле [15] :
Н = 1 – ∑Рi2 ,
где H – индекс генетического разнообразия; Pi – частота каждого паттерна в зонах.
Кластерный анализ был построен с применением метода UPGMA.
Результаты исследования и их обсуждение
Одним из основных маркеров, используемых в генетической идентификации растений, являются белковые маркеры. Впервые в Азербайджане с помощью модифицированного метода, примененного для бобовых растений, был осуществлен анализ вертикального электрофореза в A-PAGE белков глобулинов, а полученные электрофореграммы условно поделили на 4 зоны: их назвали ω-, ϒ-, β- и α-глобулины. Белки с большим молекулярным весом локализованы в ω-зоне, а белки с малым молекулярным весом – в α-зоне. Белки глобулины зерен образцов нута по сравнению с белками фасоли и сои более полиморфны, и их спектры интенсивнее. Однако белки глобулины резко отличались от показателей запасных белков глиадина и глютена из зерен пшеницы (рис. 1 и 2).
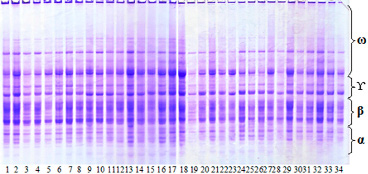
Рис. 1. Электрофореграммы белка глобулина из зерен образцов нута:
1– Flip 13-70c; 2 – Flip 13-151c; 3 – Flip 13-153c; 4 – Flip13-154c; 5 – Flip 13-194c; 6 – Flip13-227c; 7 – Flip13-234c; 8 – Flip13-240c; 9 – Flip13-247c; 10 – Flip13-250c; 11 – Flip13-251c; 12 – Flip13-253c; 13 – Flip13-258c; 14 – Flip13-261c; 15 – Flip13-277c; 16 – Flip13-278c; 17 – Flip13-282c; 18 – Flip13-308c; 19 – Flip13-314c; 20 – Flip13-320c; 21 – Flip13-330c; 22 – Flip13-335c; 23 – Flip13-336c; 24 – Flip13-338c; 25 – Flip13-340c; 26 – Flip13-343c; 27 – Flip13-356c; 28 – Flip13-358c; 29 – Flip13-364c; 30 – Flip13-369c; 31 – Flip13-376c; 32 – İLC-482c (st); 33 – Flip 82-150c; 34 – Flip 88-85c
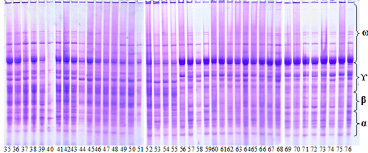
Рис. 2. Электрофореграммы белка глобулина, выделенного из зерен генотипов нута.
35 – Flip93-93c; 36 – st.Nərmin; 37 – Flip11-12c; 38 – Flip11-104c; 39 – Flip11-21c; 40 – Flip10-338c; 41 – Flip11-167c; 42 – Flip11-76c; 43 – Flip11-175c; 44 – Flip11-70c; 45 – Flip10-332c; 46 – Flip11-125c; 47 – Flip11-05c; 48 – Flip11-208c; 49 – Flip 93-93c; 50 – Flip11-32c; 51 – Flip11-66c, 52 – Flip11-205c; 53 – Flip11-140c; 54 – Flip11-08c, 55 – Flip11-198c; 56 – Flip11-11c; 57 – Flip11-209c; 58 – Flip11-215c; 59 – Flip11-45c; 60 – Flip11-72c; 61 – Flip11-210c; 62 – Flip10-318c; 63 – Flip11-16c; 64 – Flip11-58c; 65 – Flip11-138c; 66 – Flip10-345c; 67 – Flip 88-85c; 68 – Flip11-105c; 69 – Flip11-01c; 70 – İLC-482c; 71 – Flip11-216c; 72 – Flip 82-150c; 73 – Flip11-214c; 74 – Sultan, 75 – Flip11-190c; 76 – Flip11-15c
Среди исследованных образцов нута было обнаружено 23 спектра и 42 паттерна и, судя по частоте встречаемости паттернов, образуемых электрофоретическими спектрами, между ними обнаружен полиморфизм. В ω-зоне электрофореграмм запасных белков глобулина было обнаружено 7 спектров и 11 различных паттернов. В этой зоне ω-4 паттерн обнаружен в 43 образцах с частотой встречаемости 43,0 %, ω-1 паттерн – в 33 образцах с частотой встречаемости 20,0 % и ω-8 паттерн с частотой встречаемости 1,0 %. ω 4s среди всех спектров составлял самую высокую частоту встречаемости 100 %, ω3 спектр – составлял среднюю – 60,0 % , а ω1 спектр – низкую частоту встречаемости – 5,0 %.
В ϒ-зоне электрофореграмм запасных белков глобулинов наблюдалось 5 спектров и 16 паттернов. ϒ-3 паттерн обладал частотой встречаемости 43 %, ϒ-8 паттерн – 11 %, а ϒ-7 паттерн – 1 %. Среди всех спектров ϒ3s обладал самой высокой частотой встречаемости –91,0 %, ϒ4s – средней частотой встречаемости – 71 % и ϒ2s низкой – 33,0 %. В β-зоне электрофореграмм обнаружено 6 спектров и 7 паттернов. β-2 паттерн составлял частоту встречаемости 53,0 %, β-1 паттерн – 24,0 % и β-6 паттерн – самую низкую частоту встречаемости, 1 %. Была обнаружена самая высокая частота встречаемости 100 % у β4S, средняя – 87,0 % – у β3S и низкая – 28,0 % – у β6S. В α-зоне электрофореграмм было отмечено 5 спектров и 8 паттернов. α-3 паттерн составлял частоту встречаемости 36,0 %, α-1 паттерн – 29,0 %, а α-6 паттерн – 1,0 %. α2s обладал максимумом частоты встречаемости 100 %, α4S – средней частотой встречаемости 76,0 %, а α5S – низкой частотой встречаемости 45,0 %. Применив формулу Нея, между генотипами был подсчитан индекс генетического разнообразия для каждой из четырех зон. В результате проведенных подсчетов было установлено, что ϒ-зона обладала более высоким генетическим разнообразием (H = 0,786), ω-зоны (H = 0,757) и α-зоны (H = 0,761) – относительно низким генетическим разнообразием, а у β-зоны (H = 0,651) наблюдали самое низкое генетическое разнообразие (рис. 3).
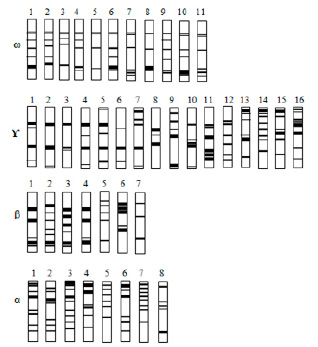
Рис. 3. Идиограмма различных паттернов ω-, ϒ-, β- и α-зон, обнаруживаемых в образцах нута

Рис. 4. Дендрограмма, отражающая генетическое расстояние между различными образцами нута на основе полиморфизма электрофореграмм белков глобулинов
После экстракции и проведенного электрофоретического анализа запасных белков глобулинов образцов нута полоски (электрофоретический спектр) между генотипами были пронумерованы на основании метода нумерации «1» и «0». Находящиеся в том же месте полоски пронумерованы на основании бинарной номенклатуры цифрой «1», а те места, где в соответствующей области полосок нет, пронумерованы цифрой «0». Используя компьютерную программу UPAGMA для определения генетической близости образцов, была построена дендрограмма, и посредством маркеров белков глобулинов изучена генетическая близость генотипов нута. Как видно из рис. 4, генотипы за номером 71, 72, 73, 74, 75 и 76 на дендрограмме классифицированы в первом кластере, образцы 52, 53, 54 – во втором, образцы за номером 69 и 70 – в третьем, номера 60 и 61 – в четвертом, а генотипы за номером 65 и 67 – в пятом кластере, и другие образцы классифицированы по два, по три, по четыре и остальные по одному кластеру. На основании полученных результатов можно прийти к заключению, что для выбора родительских форм и ускорения процесса селекции при проведении гибридизации между образцами нута, находящимися по генетическому расстоянию далеко друг от друга, целесообразно осуществление селекции с помощью маркеров.
Заключение
Проводился электрофоретический анализ в Acid-PAGE запасных белков глобулинов в зерне 76 местных и интродуцированных образцов нута Cicer Arietinum. Изучение генетического разнообразия на основе запасных белков глобулинов охарактеризовалось определением 23 спектров и 42 различных паттернов в местных и интродуцированных образцах нута. Наряду с этим были вычислены индексы генетического разнообразия электрофореграмм глобулинов (H-) образцов нута по зонам. Для определения генетической близости была использована компьютерная программа UPGMA, с помощью построения дендрограммы была определена генетическая близость генотипов нута на основе маркеров белков глобулинов.



