Удаление ионов загрязняющих веществ из стоков горно-обогатительных комбинатов представляет большой научный и практический интерес. Обычно сточные воды содержат значительное количество ионов тяжелых металлов и других токсичных соединений, которые могут представлять потенциальную угрозу для людей, животных и окружающего растительного мира. Количество загрязненных вод и почв с каждым годом увеличивается пропорционально расширению промышленной деятельности и из-за отсутствия дешевых технологий их очистки. Основной проблемой охраны окружающей среды является проблема проникновения загрязняющих веществ в поверхностные водоемы. Особенно это актуально для Камчатского края, так как реки региона, как правило, являются нерестовыми.
В последнее время наметилась тенденция перехода золотодобывающих предприятий на переработку труднообогатимого сырья. По некоторым оценкам [1] доля технологически упорных руд составляет примерно 30–40 % от общих мировых запасов золота в недрах Земли. В этом случае наиболее эффективной технологией является цианирование [2]. Но необходимо обратить внимание на накопление твердых отходов [3], содержащих такие соединения, как цианиды, тиоцианаты, ионы тяжелых металлов, высокотоксичные металлоиды мышьяк, селен и др. Хранение твердых отходов происходит на открытых площадках и подвергается воздействию атмосферных факторов – это просачивание через толщу штабеля дождевой воды в летний период, талой воды при таянии снега весной и окисление кислородом воздуха. При оценке воздействия на гидрохимическую обстановку при разработке сульфидсодержащих месторождений установлено [4, 5], что, как правило, образуются кислые дренажные воды с высокими содержаниями тяжелых металлов, для которых установлены предельно допустимые концентрации (ПДК). При цианидном выщелачивании золота отходы имеют щелочную реакцию среды.
Целью настоящего исследования является экспериментальное лабораторное моделирование состава сточных вод в районе локализации отходов цианирования золотоизвлекательных предприятий.
Материалы и методы исследования
Навески кека цианидного выщелачивания массой по 500 г помещали в пластиковые емкости объемом 2 л диаметром 140 мм. Образцы еженедельно приводили в соприкосновение с дистиллированной водой. После кратковременного интенсивного перемешивания (10 мин) пробы оставляли на сутки для осветления [6]. По истечении суток растворы из емкостей сливали декантацией, измеряли объемы, отфильтровывали через фильтры «синяя лента», в фильтратах оперативно определяли рН, сульфат-ионы, сульфид-ионы, содержание цианид- и роданид-ионов, содержание макро- и микрокомпонентов. Измерение рН проводили с использованием иономера «SevenCompact» фирмы «Mettler-Toledo Instrument (Shanghai) Co. Ltd» с универсальным электродом с точностью не хуже, чем ± 0,03 ед. рН. Определение сульфат- и сульфид-ионов – с использованием ВЭЖХ на приборе LC-20 Shimadzu (Япония), содержание цианид-и роданид-ионов титриметрически. Анализ микрокомпонентов методом ICP-MS проведен В АСИЦ ФГУП ВИМС (г. Москва) с использованием масс-спектрометра с индуктивно-связанной плазмой Elan 6100 (Perkin-Elmer, США) и атомно-эмиссионного спектрометра с индуктивно-связанной плазмой Optima 4300 DV (Perkin-Elmer, США).
Результаты исследования и их обсуждение
Известно, что одним из самых распространенных способов переработки золотосодержащих руд является цианирование [7]. Для цианирования, как правило, используют цианиды щелочных и щелочноземельных металлов [8]. Многие золотосодержащие руды содержат серебро, которое при цианировании растворяется наряду с золотом. В цианистых пульпах протекают процессы, согласно реакциям
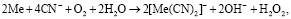 (1)
(1)
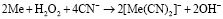 , (2)
, (2)
где Me – это Au или Ag.
Обе реакции сопровождаются накоплением гидроксильных групп, что приводит к повышению рН > 9,0 ед. В действительности растворению золота полностью соответствует реакция (1), для серебра и реакция (1), и реакция (2). Окисление золота по реакции (1) возможно благодаря снижению окислительного потенциала в присутствии цианид-иона за счет образования прочного комплексного иона [Au(CN)2]–, имеющего константу нестойкости, равную 1,1·10–41. Стандартный потенциал полуреакции 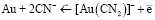 равен –0,54 В. Константа нестойкости цианидного комплекса серебра [Ag(CN)2]– равна 1,8·10–19, а стандартный потенциал полуреакции
равен –0,54 В. Константа нестойкости цианидного комплекса серебра [Ag(CN)2]– равна 1,8·10–19, а стандартный потенциал полуреакции 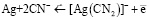 равен –0,31 В.
равен –0,31 В.
Таблица 1
Макрокомпоненты кека выщелачивания
|
Компоненты |
Na2O |
MgO |
Al2O3 |
K2O |
CaO |
TiO2 |
MnO |
Fe2O3 |
FeO |
SiO2 |
P2O5 |
|
Содержание, мас. % |
1,00 |
2,47 |
12,1 |
2,57 |
2,62 |
0,46 |
0,15 |
4,44 |
0,27 |
68,1 |
0,17 |
Необходимо отметить, что в состав золотосодержащих руд входят минералы, способные окисляться кислородом в щелочной среде в присутствии цианид-ионов, например сульфиды железа, меди, никеля и др. Помимо основных реакций при цианировании протекают нежелательные химические процессы, такие как окисление сульфидов, образование цианидных комплексов с ионами меди, никеля, цинка и т.д. Кроме этого, образующаяся при окислении сульфидов элементная сера взаимодействует с цианид-ионами по реакции
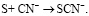 (3)
(3)
Избыток реагента подвергается гидролизу, так как цианиды щелочных и щелочноземельных металлов – это соли, образованные сильными основаниями и слабой кислотой, они гидролизуются по аниону по реакции
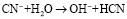 .
.
Выделение токсичной синильной кислоты приводит не только к дополнительному расходу реагента, но и к загрязнению воздушного пространства из-за летучести. Для смещения равновесия реакции гидролиза влево необходимо добавлять щелочь.
Первой стадией переработки цианистых пульп является обработка их гипохлоритом кальция. Гипохлорит кальция обеспечивает разложение цианидных комплексов цветных металлов, не затрагивая комплексные соединения благородных металлов.
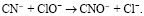
Далее цианат-ионы под воздействием природных факторов, таких как атмосферные осадки, солнечный свет, кислород воздуха, гидролизуются до образования катионов аммония и карбонат-ионов:
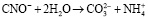 .
.
В результате протекающих физико-химических, микробиологических и криогенных процессов в штабеле отвалов отработанного материала с атмосферным кислородом и осадками происходит загрязнение поверхностных водотоков.
Кек выщелачивания представляет собой однородную, тонкодисперсную, влажную массу. Начальный уровень влажности составил 21,4 %. Усредненные данные химического состава породообразующих элементов воздушно-сухого кека выщелачивания представлены в табл. 1.
В табл. 2 представлен микрокомпонентный состав воздушно-сухого кека и равновесного с ним раствора в зависимости от времени контакта.
Степень извлечения первой порции раствора составила 58 %. Это говорит о том, что кек выщелачивания имеет высокую влагоемкость, 42 %, вероятно из-за набухания глинистой фракции. В течение следующего семидневного цикла извлечение раствора составило 76 %, затем извлечение раствора продолжало повышаться до 89 % и далее – 92 % к окончанию четвертого цикла. При оценке водного баланса за время эксперимента (30 суток) был сделан вывод, что набухание глинистой фракции происходит наиболее интенсивно в первую неделю, затем этот процесс стабилизируется и к окончанию эксперимента извлечение раствора на уровне 92 %, вероятно, связано с испарением влаги с поверхности открытой системы.
Раствор, находящийся в равновесии с кеком выщелачивания, имеет выраженную щелочную реакцию, обнаружены высокие содержания натрия и кальция в первой пробе фильтрата на уровне 110 и 130 мг/л соответственно. Содержание калия – 12 мг/л, магния – 0,24 мг/л. К четвертому циклу эксперимента концентрации указанных выше элементов снижаются в три раза и становятся равными, мг/л: натрия – 33,0; калия – 4,8; кальция – 43,0; магния – 0,11.
Установлено, что значения концентраций в фильтратах таких элементов, как Be, Р, Ti, ниже ПДКрх и ниже пределов определений, установленных для соответствующих аналитических методов. В первую неделю концентрация меди в растворе превышает ПДКрх в 2,75 раза, затем снижается и к окончанию эксперимента становится менее 0,2 мкг/л. Содержание цинка превысило ПДКрх в 1,6 раза на третьей неделе эксперимента.
Таблица 2
Микрокомпоненты твердой фазы и равновесного с ней раствора в зависимости от времени
|
Компоненты |
Твердая фаза, мг/кг |
Состав раствора, мкг/л |
ПДКрх, мкг/л |
|||
|
1 нед. |
2 нед. |
3 нед. |
4 нед. |
|||
|
Li |
35,0 |
0,85 |
0,63 |
0,735 |
0,695 |
80 |
|
Be |
0,88 |
< 0,03 |
< 0,03 |
< 0,03 |
< 0,03 |
0,03 |
|
B |
15,0 |
9,5 |
8,15 |
9,85 |
13 |
500 |
|
Sc |
17,3 |
< 0,6 |
< 0,6 |
< 0,6 |
< 0,6 |
– |
|
V |
158 |
19,5 |
< 0,7 |
< 0,7 |
13,5 |
1,0 |
|
Cr |
65,0 |
16 |
200 |
< 1,0 |
< 1,0 |
70 |
|
Co |
8,50 |
28 |
13 |
20,5 |
10,3 |
10 |
|
Ni |
13,3 |
4,80 |
4,87 |
4,10 |
5,00 |
10 |
|
Cu |
78,3 |
27,5 |
5,9 |
1,4 |
< 0,2 |
10 |
|
Zn |
58,0 |
9,95 |
5,95 |
16,0 |
7,20 |
10 |
|
Ga |
9,50 |
0,38 |
0,195 |
0,245 |
0,365 |
– |
|
As |
39,7 |
25,5 |
28,5 |
62,5 |
93 |
50 |
|
Rb |
64,0 |
6,92 |
5,6 |
6,7 |
4,75 |
100 |
|
Sr |
151 |
225 |
110 |
130 |
70 |
400 |
|
Y |
16,6 |
0,015 |
0,0083 |
0,0074 |
0,012 |
– |
|
Zr |
93,5 |
0,098 |
0,125 |
0,280 |
0,250 |
70 |
|
Mo |
27,5 |
890 |
440 |
690 |
340 |
1 |
|
Ag |
21,0 |
5,3 |
5,8 |
2,95 |
1,51 |
– |
|
Cd |
2,84 |
1,45 |
0,635 |
0,545 |
0,46 |
5,0 |
|
Sn |
1,85 |
0,18 |
0,27 |
< 0,1 |
< 0,1 |
112 |
|
Sb |
6,70 |
5,1 |
6,05 |
7,90 |
9,35 |
– |
|
Ba |
294 |
9,60 |
6,00 |
11,5 |
6,70 |
740 |
|
La |
6,15 |
< 0,05 |
< 0,05 |
< 0,05 |
< 0,05 |
– |
|
Ce |
25,5 |
0,017 |
0,017 |
0,0117 |
0,024 |
– |
|
W |
3,10 |
1,20 |
0,98 |
2,15 |
1,65 |
0,8 |
|
Au |
54,0 |
170 |
235 |
610 |
430 |
– |
|
Pb |
28,3 |
0,38 |
0,30 |
0,38 |
0,57 |
6 |
|
Bi |
0,565 |
0,009 |
0,018 |
0,013 |
0,016 |
– |
Содержание мышьяка увеличивалось от 25,5 мкг/л в начале эксперимента, и к третьей неделе его содержание превысило ПДКрх в 1,25 раза, далее превышение составило 1,86 раза. Содержание вольфрама на всем протяжении наблюдения оставалось выше ПДКрх, диапазон превышения составил 1,2–1,8 раза. Содержание молибдена снижается от 890 до 330 мкг/л (ПДКрх= 1 мкг/л). Содержание кобальта также превышает ПДКрх, но есть заметная тенденция к снижению. Хром и ванадий ведут себя нестабильно: в двух пробах обнаружены высокие содержания ванадия, в одной пробе – высокое содержание хрома. Для других элементов превышение ПДКрх не зафиксировано.
Наличие в фильтратах сульфат- и сульфид-ионов позволило определить окислительно-восстановительный потенциал системы. Среда имеет выраженную щелочную реакцию, значит, окисление сульфидной серы проходит согласно полуреакции (4), стандартный потенциал которой равен 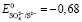 в:
в:
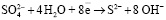 . (4)
. (4)
Расчет окислительно-восстановительного потенциала авторы вели по уравнению Нернста:
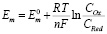 ,
,
где Em – электродный потенциал, Em0 – стандартный электродный потенциал, R – универсальная газовая постоянная, Т – температура в градусах Кельвина, F – число Фарадея, n – количество электронов, СOx и CRed – концентрации окисленной и восстановленной форм химического элемента в моль/л соответственно.
Для полуреакции (4), после подстановки значений физических постоянных и переходя от натурального логарифма к десятичному, получаем выражение
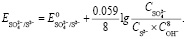 (5)
(5)
На основании экспериментальных данных по содержанию сульфат-, сульфид-ионов и рН растворов были рассчитаны значения Eh по уравнению (5). Графические зависимости указанных величин представлены на графике (рис. 1).
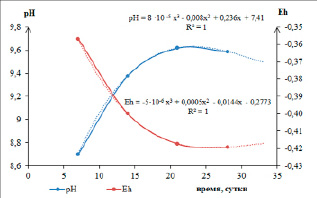
Рис. 1. Изменение рН и Eh растворов, находящихся в равновесии с твердой фазой, в зависимости от времени
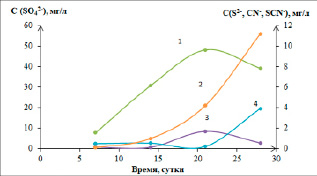
Рис. 2. Изменение концентрации сульфат-, сульфид-, цианид- и роданид-ионов в растворе, находящемся в равновесии с твердой фазой, в зависимости от времени. Концентрация сульфат-ионов (1) показана по основной оси, концентрация сульфид- (2), цианид- (3) и роданид-ионов (4) – по вспомогательной
Изменение содержания сульфат, сульфид-, цианид- и роданид-ионов представлено на графике (рис. 2).
Графоаналитическим методом установлено, что изменения рН и Eh описываются полиномом третьей степени. Это позволяет сделать краткосрочный прогноз (до 100 суток) состава раствора равновесного с материалом отвала. За время лабораторного эксперимента из твердой фазы в раствор было извлечено 39,9 % серы в пересчете на элементную. Содержание сульфат-ионов с начала эксперимента повышалось и достигло к третьей неделе величины 48 мг/л. К четвертой неделе наметилось снижение сульфат-ионов в растворе до значения 39 мг/л. В то же время содержание сульфид-ионов продолжало увеличиваться и достигло 11,2 мг/л.
Графическая зависимость (рис. 2) позволяет предположить протекание химической реакции (3), при накоплении сульфид-ионов становится возможным образование роданид-ионов.
Заключение
Проведено лабораторное моделирование физико-химических процессов, происходящих при взаимодействии атмосферных факторов с кеком цианидного выщелачивания золота. Установлено, что при хранении твердых отходов цианидного выщелачивания золотосодержащих руд на открытых площадках в результате взаимодействия с атмосферными осадками происходит формирование загрязненных дренажных вод. Результатом физико-химических взаимодействий является превышение в дренажных водах ПДК, установленных для рыбохозяйственных водоемов, для меди, кобальта, цинка, ванадия, хрома, молибдена, вольфрама. Учитывая, что подавляющее большинство водоемов Камчатского края являются нерестовыми, рекомендуется очистка дренажных вод сорбционными методами. В качестве сорбентов может быть рекомендовано использование местного минерального алюмосиликатного сырья, например цеолитов, которые имеют повышенную сорбционную емкость в нейтральных и слабощелочных средах.



