В последние десятилетия как в мире в целом, так и в России происходит спад торфодобычи и широко обсуждаются идеи восстановления болот. В противовес осушению болот для сельского хозяйства как более экологичная альтернатива предлагается развитие болотного земледелия [1]. Прежде всего, интерес к нему связан с выращиванием болотных ягод и, в ряде случаев, лекарственных растений. Однако во многих сферах применяются и другие болотные растения. В частности, на мировом рынке наблюдается устойчивый спрос на субстраты для выращивания растений на основе сфагнума. Развитие новых бизнес-моделей с включением мохообразных рода Sphagnum в перечень сельскохозяйственной продукции может открыть новые возможности для развития сильно заболоченных регионов и регионов с большими площадями осушенных и выработанных торфяников, требующих рекультивации [2]. Выращивание биомассы на влажных естественных торфяниках сохраняет торфяную почву и сводит к минимуму негативное воздействие на окружающую среду; способствует получению больших объемов биомассы мхов для промышленных производств и сельского хозяйства и расширяет спектр экосистемных услуг, оказываемых этими участками [3]. Культивирование сфагнума повышает устойчивость экосистем к климатическим изменениям, снижает выбросы CO2 в атмосферу, способствует долгосрочному промышленному использованию торфяников, сохранению древних природных и антропогенных объектов, современного биоразнообразия, регуляции водного режима прилегающих территорий, оказывает местный охлаждающий эффект на биогеоценозы [4].
Разработка эффективных способов применения сфагновых мхов в контексте болотного земледелия невозможна без понимания особенностей их продукционных процессов. Оценить протекание продукционных процессов в растениях позволяет ряд показателей, в частности линейный прирост и интенсивность фотосинтеза. Интенсивность фотосинтеза является одним из основных определяющих факторов производства биомассы, по крайней мере, у растений с C3-типом фотосинтеза, к которым относятся сфагновые мхи [5].Скорость роста отдельных видов сфагнов варьирует в широких пределах, при этом рост в длину коррелирует с приростом биомассы [6].
Перспективные с точки зрения болотного земледелия обширные заболоченные территории наиболее распространены в высоких широтах. Один из важных аспектов жизни растений в таких условиях – короткий вегетационный период, который предоставляет растениям меньше времени на формирование и запасание органического вещества. Однако для субарктических территорий характерно сочетание короткого вегетационного периода с удлиненным световым днем, что, на первый взгляд, может дать растениям возможность создавать значительное количество живой биомассы даже при непродолжительном периоде вегетации. Тем не менее, существующие исследования говорят о возможном стрессе, который мохообразные испытывают, произрастая в условиях длинного дня [7, с. 10]. Вместе с тем, для сосудистых растений на севере наиболее быстрый рост при благоприятных температурных условиях выявлен в период белых ночей [8]. Влияние белых ночей на продукционные процессы сфагновых мхов на данный момент не изучено, хотя знания об особенностях продукционных процессов в течение года крайне важны для формирования принципов промышленного выращивания сфагновых мхов в условиях высоких широт.
Цель исследования состоит в изучении особенностей ростовых процессов и количественных характеристик фотосинтетического пигментного комплекса у четырех видов сфагновых мхов, доминирующих в моховом покрове олиготрофных болот Архангельской области, в ходе вегетации в условиях искусственно созданного 7- и 24-часового фотопериода для установления специфики функционирования сфагновых мхов в условиях разной длины светового дня как элемента теоретической основы эффективного болотного земледелия в условиях заболоченных территорий высоких широт.
Материал и методы исследования
Иласский болотный массив – олиготрофное болото южноприбеломорского типа. Болото площадью более 90 км2 расположено в Приморском районе Архангельской области, в бассейне реки Северная Двина (64°19ʹ43ʺ N, 40°36ʹ45ʺ E). Образцы сфагновых мхов для проведения эксперимента отбирали в границах регрессивного грядово-мочажинного комплекса Иласского болотного массива (ИБМ). В качестве объектов исследования были выбраны виды сфагнов, преобладающие в биогеоценозах такого типа. Sphagnum fuscum (Schimp.) Klinggr. – наиболее массовый вид на грядах верховых болот и основной эдификатор, преобладающий в составе торфа. Sphagnum capillifolium (Ehrh.) Hedw. образует дерновинки, часто в смеси с другими видами, на олиготрофных болотах и в заболоченных лесах. Sphagnum majus (Russ.) C. Jens.– широко распространенный мочажинный и ковровый вид крупных олиготрофных массивов, встречающийся также в озерках. Побеги Sphagnum lindbergii Schimp. формируют ковры в мочажинах олиготрофных болот [9 c. 37–43].

Рис. 1. Выращивание сфагновых мхов in vitro
Эксперимент in vitro проводили путем выращивания сфагновых мхов в условиях искусственно созданного 7- и 24-часового фотопериода для определения длины линейного прироста и концентрации фотосинтетических пигментов (рис. 1).
Для изучения линейного прироста группы побегов отобрали в пластиковые контейнеры, заполненные водой из мочажины. Дернинки грядовых мхов (S. fuscum и S. capillifolium) высотой 10 см разместили в контейнерах объемом 1,35 л (по 2 контейнера для каждого вида) с отверстиями в дне так, чтобы они вплотную прилегали к стенкам контейнера. Для поддержания влажности мха один контейнер со S. fuscum и один – со S. capillifolium поместили в контейнер объемом 10 л, в котором поддерживали уровень болотной воды 1 см. Аналогично заполнили второй такой же 10-литровый контейнер. Среди побегов мха разместили пластиковые палочки, на которых отметили начальный уровень, на котором располагались верхушки головок мха. Побеги мочажинных мхов, в естественных условиях растущих совместно (S. majus и S. lindbergii), поместили в два пластиковых контейнера объемом 4,2 л, заполненных болотной водой так, чтобы побеги полностью находились в воде. Предварительно каждый побег был обрезан до длины 10 см.
Контейнеры, закрытые пищевой пленкой, во время эксперимента располагались под фитолампами, представляющими собой светодиодные лампы полного спектра (Uniel E27 220 В 15 Вт, 20 мкмоль/с, белый свет), вкрученные в светильники на прищепках (Светкомплект R63 E27 40Вт), расположенные на высоте 20 см над контейнерами. Освещенность у поверхности мха при таких условиях составляла около 10000 лк (летом, в естественных условиях болотного массива, освещенность может достигать 100000 лк). Температуру воздуха в помещении поддерживали на уровне 22–26ºС. В первом варианте опыта фотопериод составил 7 ч, во втором – 24 ч. Замеры линейного прироста проводили спустя 30 и 60 дней после начала эксперимента: у мочажинных мхов с помощью линейки; у грядовых – нанесением новых отметок на уровне головок мха.
Изучение пигментного состава мхов проводили в конце эксперимента (через 60 дней). Фотосинтетические пигменты экстрагировали с помощью 80%-ного ацетона. Концентрацию пигментов (хлорофиллов и каротиноидов (сумму каротинов и ксантофиллов)) в полученной ацетоновой вытяжке определяли на спектрофотометре UV-1800 Shimadzu (Япония). [10]. Определение влажности образцов мхов проводили методом высушивания до постоянной массы при t = 105˚С.
Полученные в ходе эксперимента численные значения приведены в тексте статьи и в таблицах в формате среднее значение ± стандартное отклонение, либо в виде диапазона значений. Для определения достоверности различий между выборками в программе SPSS Statistics 11 использовали критерий U Манна–Уитни – непараметрический аналог критерия Стьюдента, применяемый для малых выборок. Различия считали статистически значимыми при уровне значимости критерия (p) меньше 0,05 [11, с. 49].
Результаты исследования и их обсуждение
В ходе эксперимента были получены значения концентраций фотосинтетических пигментов (хлорофиллов a, b и каротиноидов) и их соотношения, приведенные в таблице 1. Установлено, что большая часть пигментного комплекса сфагновых мхов представлена хлорофиллом а (52–57%), концентрация которого в обоих вариантах опыта изменялась от 0,37±0,06 до 1,65±0,39 мг/г в зависимости от вида. Меньшую часть пигментного комплекса составили вспомогательные пигменты – хлорофилл b (15–28%) и каротиноиды (17–29%), концентрация которых изменялась в пределах от 0,15±0,03 до 0,71±0,18 мг/г и от 0,13±0,02 до 0,56±0,07 мг/г соответственно. Согласно полученным результатам, соотношение хлорофиллов a/b в пигментном комплексе сфагновых мхов, в основном, не превышало 3,5, а доля хлорофилла в светособирающем комплексе во всех вариантах опыта оказалась выше 60%. Соотношение хлорофиллов и каротиноидов в эксперименте достигало 4,5.
В ходе анализа экспериментальных данных различия в пигментном комплексе, связанные с длиной фотопериода, были обнаружены только у вида S. capillifolium, у которого средняя концентрация хлорофилла а при 24-часовом фотопериоде оказалась в 2 раза выше, чем при 7-часовом фотопериоде, а соотношение хлорофиллов a/b – в 1,3 раза больше (p<0,05). Для оставшихся трех видов значимых различий в пигментном комплексе по вариантам опыта выявлено не было (p>0,05). При выращивании грядовых мхов в условиях удлиненного фотопериода у этих видов была отмечена пониженная доля хлорофиллов в светособирающем комплексе по сравнению со мхами, выращиваемыми при более коротком фотопериоде, при этом разница составила 16–18 %. У мочажинных мхов доля хлорофиллов в светособирающем комплексе не различалась в обоих вариантах опыта.
В таблице 2 приведены результаты измерения линейного прироста сфагновых мхов после 30- и 60-дневного культивирования. В ходе эксперимента в ряде случаев были выявлены различия по линейному приросту как между опытами с разной длиной светового дня, так и между первым и вторым месяцем выращивания. Побеги S. majus при 7-часовом фотопериоде продемонстрировали больший прирост за второй месяц выращивания (2,00±1,11 см) по сравнению с первым (1,32±0,97 см). В варианте опыта с 24-часовым фотопериодом прирост за первый месяц (3,40±1,40 см), напротив, был больше, чем прирост за второй (2,70±1,35 см). Все выявленные различия для этого вида были статистически значимы при p<0,05. Для S. lindbergii в обоих вариантах опыта изменения прироста по месяцам не произошло (p>0,05): прирост побегов за первый и второй месяцы при 7-часовом фотопериоде составил 0,77±0,56 и 1,00±0,69 см, при 24-часовом фотопериоде – 2,30±1,07 и 2,40±1,30 см). Тем не менее, при круглосуточном освещении все значения прироста оказались выше, чем при 7-часовом фотопериоде (p<0,05).
При 7-часовом фотопериоде приросты по месяцам у грядовых видов S. fuscum и S. capillifolium не различались. Приросты за первый и второй месяцы в этом варианте опыта у S. fuscum составили 0,19±0,09 и 0,20±0,11 см, у S. capillifolium – 0,22±0,10 и 0,20±0,09 см (p>0,05). При 24-часовом фотопериоде для каждого грядового вида линейный прирост за второй месяц в среднем оказался в 2 раза больше, чем за первый (p<0,05). Грядовые виды, как и мочажинные, при 24-часовом фотопериоде росли быстрее, чем при 7-часовом (p<0,05).
Таблица 1
Средние значения и стандартные отклонения содержания и соотношения фотосинтетических пигментов в сфагновых мхах при различном фотопериоде
|
Вид |
Фотопериод |
Хл, мг/г |
Кар, мг/г |
Соотношения |
Доля Хл в ССК, % |
||
|
а |
b |
a/b |
хл/кар |
||||
|
S. lindbergii |
7 ч |
1,32±0,11 |
0,59±0,05 |
0,48±0,03 |
2,22±0,01 |
3,96±0,06 |
68 |
|
24 ч |
1,49±0,2 |
0,66±0,09 |
0,56±0,07 |
2,24±0,02 |
3,87±0,05 |
65 |
|
|
S. majus |
7 ч |
1,65±0,39 |
0,71±0,18 |
0,53±0,12 |
2,32±0,14 |
4,48±0,24 |
66 |
|
24 ч |
1,60±0,03 |
0,68±0,03 |
0,55±0,02 |
2,37±0,05 |
4,16±0,05 |
68 |
|
|
S. fuscum |
7 ч |
0,37±0,06 |
0,17±0,05 |
0,18±0,005 |
2,31±0,35 |
2,96±0,61 |
70 |
|
24 ч |
0,40±0,10 |
0,15±0,06 |
0,21±0,04 |
2,78±0,67 |
2,67±0,41 |
59 |
|
|
S. capillifolium |
7 ч |
0,31±0,06 |
0,15±0,03 |
0,13±0,02 |
1,99±0,12 |
3,47±0,38 |
74 |
|
24 ч |
0,62±0,06 |
0,24±0,03 |
0,25±0,02 |
2,60±0,08 |
3,49±0,13 |
61 |
|
Таблица 2
Средние значения и стандартные отклонения месячного прироста сфагновых мхов (см) при различном фотопериоде
|
Длина фотопериода |
Кол-во дней культивирования |
Sphagnum majus |
S. lindbergii |
S. fuscum |
S. capillifolium |
|
7 ч |
30 |
1,32±0,97 |
0,77±0,56 |
0,19±0,09 |
0,22±0,10 |
|
60 |
2,00±1,11 |
1,00±0,69 |
0,20±0,11 |
0,20±0,09 |
|
|
24 ч |
30 |
3,40±1,40 |
2,30±1,07 |
0,30±0,12 |
0,70±0,38 |
|
60 |
2,70±1,35 |
2,40±1,30 |
0,60±0,32 |
1,43±0,43 |
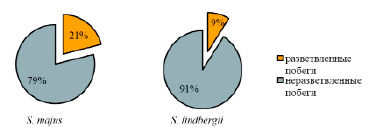
Рис. 2 Доля (%) разветвленных и неразветвленных побегов у сфагновых мхов после двухмесячного эксперимента при 24-часовом фотопериоде
Кроме того, по истечении 60 дней эксперимента наблюдали морфологические изменения исследуемых мхов. После двух месяцев выращивания мочажинных видов сфагнов при 24-часовом фотопериоде верхушки некоторых побегов разветвились, образовав 2–3 новые головки (рис. 2). Интересное наблюдение касается грядового вида Sphagnum capillifolium: при круглосуточном освещении растения этого вида начали давать зеленые боковые побеги в довольно большом количестве.
Дернинки грядовых мхов, обычно плотно растущие, спустя два месяца эксперимента оказались рыхлее, чем в самом начале. Мочажинные мхи, растущие погруженными в воду, приобрели водную форму роста, характеризующуюся крупными размерами листьев, веточек и головок. Грядовый вид S. capillifolium приобрел зеленую окраску (характерную для данного вида в затененных местообитаниях), утратив антоцианы, дающие этому виду в сильно освещенных местообитаниях красную окраску и выполняющие функцию защиты от фотоповреждения.
Проанализировав результаты эксперимента, можно предположить, что температура воздуха и освещенность, поддерживаемые в вариантах опыта, а также состав болотной воды создали условия, благоприятные для формирования первичной продукции, которые привели к изменениям морфологии мхов. Влажность воздуха и субстрата была достаточной, а для грядовых видов даже избыточной, что и привело к разрыхлению дернинок, а отсутствие света высокой интенсивности поспособствовало утрате антоциановой окраски мхами, первоначально имеющими красный цвет.
Несмотря на то что результаты существующих лабораторных исследований указывают на ингибирование фотосинтетического аппарата растений при вегетации в условиях длинного светового дня [12, 13], 24-часовой фотопериод не оказал негативного влияния на пигментный комплекс исследуемых видов сфагнов. Круглосуточное освещение ускорило рост сфагнов, при этом мочажинные виды росли в 2–11 раз быстрее грядовых. Выводы о более быстром росте мочажинных видов сфагновых мхов и о большем содержании фотосинтетических пигментов по сравнению с грядовыми согласуются с результатами проведенных ранее исследований [6, 14].
Заключение
По окончании лабораторного эксперимента было установлено, что пигментный комплекс сфагновых мхов на 52–57% был образован хлорофиллом а. Хлорофилл b и каротиноиды составляли 15–28% и 17–29% от всего пигментного комплекса соответственно. В зависимости от вида содержание хлорофилла а при обоих вариантах опыта изменялось в пределах 0,39–1,62 мг/г, содержание хлорофилла b составило 0,10–0,85 мг/г, каротиноидов – 0,13–0,62 мг/г. Соотношение хлорофиллов a/b в данном исследовании, в основном, не превышало 3,5, а доля хлорофиллов в ССК варьировала в пределах 59–74%. Соотношение хлорофиллов и каротиноидов не превышало 4,5 и оставалось постоянным у всех исследованных видов сфагновых мхов в обоих вариантах опыта. Сравнение концентраций хлорофиллов и каротиноидов и их соотношений у мхов, выращиваемых при 7-часовом и 24-часовом фотопериоде, не показало статистически значимых различий для S. fuscum, S. majus и S. lindbergii. У S. capillifolium при 24-часовом фотопериоде концентрация хлорофилла а и соотношение хлорофиллов a/b оказались выше, чем при 7-часовом. У этого вида, как и у S. fuscum, при удлиненном фотопериоде доля хлорофиллов в ССК была выше в 1,2 раза. Грядовые мхи отреагировали снижением доли хлорофиллов в ССК на удлиненный фотопериод, тогда как этот показатель для мочажинных мхов не менялся в зависимости от длины фотопериода. В лабораторном эксперименте показано, что в условиях постоянной влажности и комнатной температуры приросты у S. lindbergii при 7-часовом фотопериоде составили 0,1–2,5 см/месяц, у S. majus – 0,1–3,9 см/месяц, у S. fuscum – 0,1–0,6 см/месяц, у S. capillifolium – 0,1–0,5 см/месяц; при 24-часовом фотопериоде у S. lindbergii значения варьировали в пределах 0,5–6,1 см/месяц, у S. majus – 0,4–6 см/месяц, у S. fuscum – 0,2–1,6 см/месяц, у S. capillifolium – 0,2–2,1 см/месяц. Наибольшие значения линейного прироста все виды продемонстрировали при выращивании в условиях 24-часового периода. Различия по линейному приросту в вариантах опыта являются статистически значимыми.
Таким образом, при выращивании сфагновых мхов установлено, что в искусственных условиях продолжительность светового дня положительно влияет на продуктивность культивируемых видов сфагнов, не оказывая значительного влияния на пигментный комплекс этих растений. Полученные результаты могут быть применены при разработке методов культивирования сфагновых мхов в условиях теплиц и плантаций, однако отдельное внимание при этом стоит уделить поддержанию температуры и влажности воздуха и субстрата.



