Введение
Донбасс является маловодным индустриальным регионом. Для водоснабжения региона был построен канал Северский Донец-Донбасс, который из-за боевых действий разрушен, подача воды по каналу остановлена. Сейчас регион снабжается водой из водохранилищ и водовода Дон-Донбасс, но его пропускной способности недостаточно, вода подается по графику [1]. В настоящее время существуют проекты расширения источников водоснабжения за счет использования шахтных вод [2, 3]. Шахтная вода является сложным аналитическим объектом [4, 5], содержит большое количество солей, которые в свою очередь оказывают матричные помехи при определении содержания тяжелых металлов методом электротермической атомно-абсорбционной спектрометрии (ЭТААС) [6, 7]. Использование химических модификаторов в ЭТААС является неотъемлемым компонентом методов минимизации матричных помех [6, 8]. Модификаторы способствуют сохранению аналита до более высоких температур во время стадии пиролиза, позволяющей устранить матричные помехи [9]. Из химических элементов, применяемых в качестве перманентных модификаторов, карбиды тугоплавких металлов менее эффективны, чем металлы платиновой группы, но они позволяют достигать приемлемых пределов обнаружения и их стоимость значительно ниже. Ранее [10, 11], соединения ванадия(V) уже использовались в качестве перманентного модификатора в ЭТААС, модификатор вносили в кювету в виде аммиачного раствора NH4VO3 и виде водного раствора V2O5 (рН > 9, аммиачный раствор) для определения 25 легко- и среднелетучих элементов, в данных работах была установлена высокая термостабилизационная способность соединений ванадия(V), особенно в смеси с палладием, и указаны широкие возможности применения соединений ванадия в ЭТААС [10, 11]. Ванадий относится к тугоплавким элементам и образует устойчивые тугоплавкие карбиды, но сам ванадий определяется методом ЭТААС довольно редко.
Целью настоящей работы является разработка перманентного модификатора для анализа содержания металлов-токсикантов в шахтных водах с помощью метода ЭТААС.
Материалы и методы исследования
Растворы наночастиц способны образовывать равномерные пленки на поверхности различных изделий, что позволяет устранить проблему неравномерного покрытия поверхности [12]. Оксиды ванадия образуют коллоидные растворы, при нанесении которых на поверхность образуются равномерные пленки. Именно это свойство обуславливает эффективность применения наночастиц оксида ванадия в качестве перманентных модификаторов. Раствор для покрытия поверхности атомизатора, содержащий наночастицы оксида ванадия, синтезировался согласно методике, описанной в работе [13]; водный раствор метаванадата аммония 1 г/л готовили из метаванадата аммония (CAS No.: 7803-55-6). Размер синтезированных наночастиц определяли с помощью просвечивающего электронного микроскопа JEM-200А JEOL при ускоряющем напряжении 200 кВ. Данные порошковой рентгенограммы были получены с использованием дифрактометра ДРОН-3М с электронным управлением, с установленным Ni – фильтром для Cu Kα излучения. Для фазового анализа использовали программу Match с базой данных PDF-2 (ICCD). Для уточнения структуры методом Ле-Бейла использовали массив данных, полученных путем сканирования образца в диапазоне углов 10о ≤ 2θ ≤ 120о со скоростью 2о (2θ)/мин. Полученные данные анализировали в программе FULLPROF.2k [14] с использованием графического интерфейса WinPLOTR [15]. В качестве исходных данных для уточнения кристаллической структуры полученных соединений были взяты данные для VC [16]. ЭТААС анализ проводился на спектрофотометре Сатурн 3 с электротермическим атомизатором Графит 2. В качестве источников резонансного излучения использовали лампы с полым катодом типа ЛСП-1 и безэлектродные лампы ВСБ-2, для устранения неселективных помех использовали дейтериевый корректор фона, объем аликвоты 20 мкл. Для определения характеристической массы в мерную колбу вместимостью 10 мл вносили аликвоту стандартного раствора таллия(ІІІ) (GSO 6081) с тем, чтобы его итоговая концентрация составила 100 мкг/л, разбавляли до метки водой и тщательно перемешивали. Аликвоту 20 мкл приготовленного раствора дозировали на платформу с пиролитическим покрытием в графитовой печи и проводили измерение аналитического сигнала. Использовали интегральную интенсивность сигналов.
Результаты исследования и их обсуждение
Для определения размера наночастиц в растворе использовали метод просвечивающей электронной микроскопии. Полученные фотографии представлены на рис. 1а, из которых следует, что размер частиц составляет от 20 до 100 нм; растворы показали стабильность в течение 30 дней. Дополнительным фактором, подтверждающим получение именно коллоидного раствора оксида ванадия, является наблюдение образования конуса Тиндаля [17] в полученных растворах, данное свойство использовалось в качестве экспресс-метода подтверждения образования наночастиц оксида ванадия. Каждый раз перед проведением измерений раствор помещали в тонкостенный стакан и при пропускании через него сфокусированного светового пучка (использовали лазерную указку) наблюдали светлый конус на тёмном фоне – конус Тиндаля (рис. 1б).
При использовании соединений ванадия в качестве перманентного модификатора покрытие рабочей поверхности графитового атомизатора должно оставаться стабильным на протяжении как можно большего числа циклов измерений. Для установления термической стабильности покрытия провели эксперимент по определению наличия атомного пара ванадия в газовой фазе. В графитовый атомизатор дозировали равные количества ванадия в виде раствора наночастиц VO2, проводили высушивание растворителя при 150 °C в течение 30 секунд и пиролиз при 1100 °C в течение 1 минуты для образования карбидов, далее печь резко нагревали до температуры атомизации. Такой же эксперимент был выполнен для описанного в литературе [10] истинного раствора NH4VO3, на основе чего были построены кривые атомизации соединений ванадия (зависимость абсорбционности ванадия от температуры) (рис. 2).
Данные, представленные на рисунке 2, свидетельствуют о том, что для каждой заданной температуры атомизации значения абсорбционности ванадия больше для покрытия из метаванадата аммония, чем из раствора оксида ванадия(IV). Следовательно, соединения ванадия, образованные на графитовой поверхности атомизатора из раствора оксида ванадия(IV), удаляются из печи значительно хуже. Именно это требование (стойкость покрытия) является определяющим для перманентных модификаторов. Если принять, что в результате обжига химический состав покрытия графитовой поверхности идентичен, то наблюдаемый факт можно объяснить кинетикой процесса испарения, различием в структуре модифицирующего покрытия и состоянием поверхности платформы графитового атомизатора. Следует также учесть взаимодействия ванадия с углеродом [18]. В случае, когда раствор, используемый для получения модифицирующего покрытия, представляет собой раствор ионов, тогда вещество образует монослой. В случае раствора наночастиц после удаления растворителя образуются нанокластеры. При испарении соединений модификатора из нанокластеров, образовавшихся на стенке печи/платформы, энергия активации больше, чем при испарении атомов из монослоя, поскольку для разрушения связей между атомами нанокластера требуется дополнительная энергия [19].

Рис. 1. Микрофотографии частиц коллоидного оксида ванадия (IV) (а); Конус Тиндаля в полученном растворе на темном фоне (б) Источник: составлено авторами
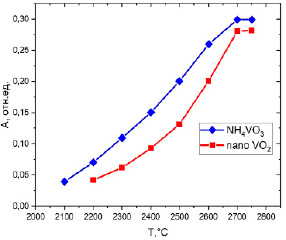
Рис. 2. Кривые атомизации соединений ванадия: модификатор на основе коллоидного раствора оксида ванадия(IV) (красная кривая); модификатор метаванадат аммония (синяя кривая) Источник: составлено авторами
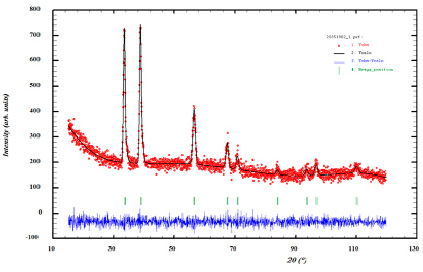
Рис. 3. Данные рентгеновской дифракции (красные точки) и рассчитанная дифракционная модель по методу Ле-Бейла (черная линия) для нанопорошка модифицирующего покрытия Источник: составлено авторами
Для понимания термохимического превращения, происходящего в атомизаторе с модифицирующим покрытием на основе наночастиц оксида ванадия(IV), были смоделированы термохимические превращения, протекающие при получении такого покрытия. В графитовый атомизатор вносились равные количества ванадия в виде раствора наночастиц VO2, проводили высушивание растворителя при 150°C в течение 30 секунд и пиролиз при 1100°C в течение 1 минуты для образования карбидов, далее печь резко нагревали до температуры 1500°C с целью удаления примесей, что ниже температуры образования атомного пара ванадия, после чего атомизатор охлаждали, извлекали платформу и покрытие счищали шпателем. Данную операцию повторяли до получения достаточного количества порошка, необходимого для проведения рентген-дифракционных исследований.
На рисунке 3 показана рентгеновская дифрактограмма порошка модифицирующего покрытия.
На основании результатов фазового анализа установлено, что наблюдаемые отражения соответствуют фазе карбида ванадия VC [16]. Решение структурной модели было выполнено с использованием алгоритма Ле-Бейла. Установлено, что данная фаза кристаллизуется по типу NaCl в кубической сингонии с пространственной группой Fm-3m(225). Параметр кубической элементарной ячейки равен a = 4.182(5) Å. Сильный фоновый шум, как видно из рисунка 3, а также слабая интенсивность линий рефлексов указывают на низкую кристалличность фазы, что косвенно свидетельствует об образовании именно наночастиц карбида ванадия VC. Кроме того, асимметрия рефлексов и их уширение связано с размерной неоднородностью карбида ванадия VC, что хорошо согласуется с данными просвечивающей электронной микроскопии (рис. 1а).
Эффективность нового модификатора оценивали на примере атомно-абсорбционного определения таллия, суперэкотоксиканта минерализованных шахтных вод, который относится к легколетучим элементам в ЭТААС. Экологическая опасность таллия в шахтных водах, обусловлена его токсичностью для животных и человека в крайне малых дозах. Таллий является одним из микроэлементов токсикантов в углях, его содержание в углях в среднем принимают 0,1-0,5 г/т [20].
Одной из важных метрологических характеристик химического модификатора является его термостабилизирующая способность. Высокая термостабилизирующая способность модификатора позволяет увеличить температуру пиролиза без потерь аналита, что способствует более полному удалению матрицы. Термостабилизирующую способность принято характеризовать максимально допустимой температурой пиролиза, которую экспериментально определяют из кривых пиролиза. Экспериментально были измерены и построены кривые пиролиза, которые приведены на рисунке 4.
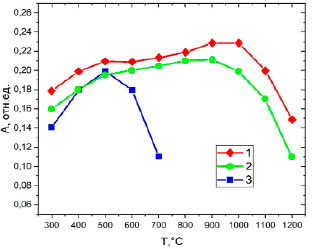
Рис. 4. Кривые пиролиза соединений таллия: 1 – с модификатором коллоидным раствором оксида ванадия(IV); 2 – с модификатором NH4VO3; 3 – без модификатора Источник: составлено авторами
Исходя из кривых пиролиза, можно утверждать, что предложенный модификатор более эффективно термически стабилизирует таллий, чем метаванадат аммония и позволяет увеличить допустимую температуру на стадии пиролиза на 400 °С. Исследуемый модификатор оказывает значительное влияние на чувствительность атомно-абсорбционного определения. Основным параметром, описывающим данное влияние, является характеристическая масса элемента. Рассчитанные значение характеристической массы mхар и относительное стандартное отклонение результатов измерения абсорбционности Sr представлены в таблице 1.
Таблица 1
Влияние химического модификатора на чувствительность и сходимость ЭТААС определения таллия в безматричных растворах
|
Химический модификатор |
mхар, пг |
Sr |
|
Без модификатора |
20 |
0,03 |
|
Раствор NH4VO3 |
22 |
0,03 |
|
Коллоидный раствор оксида ванадия(IV) |
13 |
0,03 |
Таблица 2
Влияние химических модификаторов на чувствительность и сходимость результатов ЭТААС определения таллия в хлоридной матрице (50 мкг в 20 мкл)
|
Химический модификатор |
mхар, пг |
Sr |
|
Без модификатора |
95 |
0,06 |
|
Раствор NH4VO3 |
19 |
0,05 |
|
Коллоидный раствор нано оксида ванадия(IV) |
17 |
0,07 |
Полученные значения характеристической массы для таллия примерно в два раза хуже, чем теоретически рассчитанное значение 10,2 пг [21]. Однако экспериментально эти значения характеристической массы не достигаются даже на современных приборах с полной оптимизацией всех параметров. Так, в работе [22] приводится значение характеристической массы таллия 19 пг, которое примерно в 2 раза больше теоретически возможного.
Аналогичные исследования были проведены для выяснения толерантности модификаторов на основе соединений ванадия к хлоридной матрице NaCl. Полученные результаты представлены в таблице 2.
Из данных таблицы 2 следует, что коллоидный раствор нанооксида ванадия(IV) демонстрирует высокую способность к подавлению мешающего влияния высокосолевой хлоридной матрицы. Таким образом, предложенный новый перманентный химический модификатор – коллоидный раствор наночастиц оксида ванадия(IV) – превосходит метаванадат аммония по способности термически стабилизировать легколетучий таллий, соизмерим с ним по сходимости результатов и по чувствительности определения.
Выводы
1. Исследованы высокотемпературные процессы превращения перманентного химического модификатора – коллоидного раствора наночастиц оксида ванадия(IV) в графитовой печи. Соединения наночастиц ванадия значительно лучше удерживаются в печи до более высоких температур, чем в случае ранее используемого NH4VO3, образуя более термостойкое покрытие. Рентгенограмма покрытия платформы позволяет утверждать, что после обжига образуются нанокластеры из карбида ванадия VC кубической сингонии с пространственной группой Fm-3m(225).
2. Предложен новый перманентный модификатор коллоидный раствор оксида V(IV) для ЭТААС определения Tl. По способности термически стабилизировать аналит новый модификатор превосходит NH4VO3; по чувствительности и сходимости результатов измерения аналитического сигнала коллоидный раствор оксида V(IV) не уступает ванадату аммония в безматричных растворах, однако превосходит его в высокосолевой хлоридной матрице.
3. Новый модификатор может быть применен при прямом определении содержания суперэкотоксиканта таллия, методом ЭТААС в высокосолевой шахтной воде, что является актуальной задачей для обеспечения гидроэкологической безопасности водопользования и водопотребления, планирования хозяйственной деятельности на территории Донбасса при поиске альтернативных источников водоснабжения вододефицитного региона.



