Существующие теории растворов электролитов не дают полной картины состояния молекул и ионов в произвольном растворителе. Исследователи сталкиваются с большими трудностями при нахождении таких ключевых характеристик ионов в растворе как число сольватации, радиус сольватированного иона и энергия межмолекулярных взаимодействий.
Ранее [1-3] была предложена плазмоподобная теория электролитов, которая описывает раствор ионогена как систему зарядов, колеблющихся с плазменной частотой, зависящей как от свойств самого электролита, так и от макроскопических параметров среды. Авторами было показано, что данная теория удовлетворительно описывает диссипативные свойства водных растворов неорганических солей.
Целью данной работы было проверить справедливость плазмоподобной теории электролитов в неводных растворителях, в качестве которых были выбраны четыре н-спирта (этанол, пропанол, бутанол и пентанол). В качестве электролита была выбрана хлороводородная кислота, в качестве измеряемого параметра - эквивалентная электропроводность. Хлороводород был выбран не случайно, поскольку, как известно, ион водорода обладает специфическим эстафетным механизмом переноса в растворителях, и в настоящее время нет теории, достоверно описывающей его транспортные свойства.
Экспериментальная часть
Все спирты марки х.ч. были предварительно обезвожены согласно стандартным методикам [4-6], окончательно высушены над молекулярными ситами (3Å), хранились в них же под вакуумом. Содержание воды по Карлу-Фишеру [7] не превышало 0,01%. Хлороводород был получен взаимодействием хлорида калия (хч) с концентрированной серной кислотой (хч), осушен пропусканием через две склянки с кислотой и под вакуумом пропускался через колбу со спиртом. Растворы готовились методом последовательных разбавлений по массе, исходные концентрации были установлены четырехкратным титрованием 0.1М водным раствором гидроксида калия (хч) под атмосферным давлением.
Установка для измерения электропроводности растворов электролитов состояла из трех основных элементов: измерительной части, кондуктометрической ячейки и термостата [8].
Для измерений использовалась вакуумная ячейка из пирекса с тремя плоскопараллельными круглыми платиновыми электродами, покрытыми платиновой чернью. Измерение сопротивления растворов проводилось при частоте 1000 Гц. Для поддержания температуры в термостате использовалась схема с применением высокоточного регулятора температуры ВРТ-3 [9]. Точность поддержания температуры составляла ±0,01 К. Константа ячейки была установлена измерением сопротивления водных растворов KCl исследуемого диапазона концентраций. Полученные значения эквивалентной электропроводности приведены в табл. 1.
Таблица 1.
Экспериментальные данные эквивалентной электропроводности хлороводорода в н-спиртах
при различных температурах (λ [См·см2·моль-1], С [моль/л]).
|
1. Этанол |
||||||||||||||||||||||
|
278К |
288К |
298К |
308К |
318К |
328К |
|||||||||||||||||
|
С·104 |
λ |
С·104 |
λ |
С·104 |
λ |
С·104 |
λ |
С·104 |
λ |
С·104 |
λ |
|||||||||||
|
980,8 |
24,48 |
970,6 |
28,61 |
960,2 |
33,46 |
949,8 |
37,60 |
938,9 |
41,83 |
927,5 |
45,02 |
|||||||||||
|
490,4 |
26,53 |
485,2 |
31,16 |
480,1 |
37,10 |
474,9 |
42,03 |
469,4 |
46,83 |
463,7 |
50,85 |
|||||||||||
|
245,2 |
28,81 |
242,6 |
35,72 |
240,0 |
42,04 |
237,4 |
48,27 |
234,7 |
55,09 |
231,8 |
58,67 |
|||||||||||
|
122,6 |
33,23 |
121,3 |
39,93 |
120,0 |
47,64 |
118,7 |
55,03 |
117,3 |
62,47 |
115,9 |
69,03 |
|||||||||||
|
61,30 |
34,10 |
60,66 |
44,36 |
60,01 |
53,17 |
59,36 |
62,60 |
58,68 |
71,90 |
57,96 |
79,80 |
|||||||||||
|
30,65 |
37,59 |
30,32 |
48,29 |
30,00 |
59,23 |
29,68 |
69,00 |
29,33 |
80,50 |
28,98 |
91,34 |
|||||||||||
|
15,32 |
38,90 |
15,16 |
50,80 |
15,00 |
63,11 |
14,68 |
76,35 |
14,67 |
88,34 |
14,49 |
102,00 |
|||||||||||
|
7,661 |
41,64 |
7,581 |
54,20 |
7,500 |
67,97 |
7,419 |
80,70 |
7,334 |
95,24 |
7,244 |
113,93 |
|||||||||||
|
3,831 |
42,91 |
3,791 |
55,55 |
3,750 |
69,01 |
3,710 |
82,48 |
3,667 |
98,61 |
3,622 |
116,12 |
|||||||||||
|
1,915 |
43,97 |
1,895 |
56,94 |
1,875 |
69,81 |
1,855 |
84,91 |
1,833 |
101,80 |
1,811 |
120,71 |
|||||||||||
|
0,958 |
44,60 |
0,948 |
57,05 |
0,938 |
70,40 |
0,928 |
86,33 |
0,917 |
103,94 |
0,906 |
123,88 |
|||||||||||
|
0,479 |
44,79 |
0,474 |
57,50 |
0,469 |
70,90 |
0,464 |
87,71 |
0,458 |
104,21 |
0,453 |
125,00 |
|||||||||||
|
0 |
46,27 |
0 |
59,67 |
0 |
84,65 |
0 |
91,05 |
0 |
109,41 |
0 |
131,90 |
|||||||||||
|
2. Пропанол |
||||||||||||||||||||||
|
278К |
288К |
298К |
308К |
318К |
328К |
|||||||||||||||||
|
С·104 |
λ |
С·104 |
λ |
С·104 |
λ |
С·104 |
λ |
С·104 |
λ |
С·104 |
λ |
|||||||||||
|
3393 |
6,05 |
3359 |
7,09 |
3325 |
8,18 |
3290 |
8,84 |
3256 |
9,82 |
3222 |
10,60 |
|||||||||||
|
846,8 |
7,50 |
838,4 |
9,23 |
829,8 |
11,60 |
821,2 |
12,60 |
812,6 |
14,10 |
804,2 |
16,10 |
|||||||||||
|
423,4 |
8,77 |
419,2 |
10,80 |
414,9 |
13,10 |
410,6 |
15,10 |
406,3 |
17,20 |
402,1 |
18,90 |
|||||||||||
|
211,7 |
9,25 |
209,6 |
11,70 |
207,5 |
14,50 |
205,3 |
18,20 |
203,2 |
20,60 |
201,0 |
22,20 |
|||||||||||
|
105,8 |
10,60 |
104,8 |
14,10 |
103,7 |
17,30 |
102,6 |
20,50 |
101,6 |
23,50 |
100,5 |
27,42 |
|||||||||||
|
52,92 |
12,20 |
52,39 |
15,70 |
51,86 |
19,40 |
51,32 |
24,90 |
50,79 |
29,20 |
50,26 |
32,91 |
|||||||||||
|
26,46 |
13,60 |
26,20 |
17,80 |
25,93 |
24,20 |
25,66 |
30,00 |
25,39 |
34,90 |
25,13 |
39,79 |
|||||||||||
|
13,23 |
14,80 |
13,10 |
19,10 |
12,97 |
25,70 |
12,83 |
32,60 |
12,70 |
41,40 |
12,56 |
48,20 |
|||||||||||
|
6,615 |
16,21 |
6,549 |
21,00 |
6,482 |
27,40 |
6,414 |
34,60 |
6,348 |
44,90 |
6,282 |
52,59 |
|||||||||||
|
1,653 |
18,60 |
1,637 |
24,00 |
1,620 |
32,00 |
1,603 |
41,20 |
1,586 |
52,00 |
1,570 |
63,50 |
|||||||||||
|
0,827 |
20,40 |
0,818 |
25,90 |
0,810 |
35,30 |
0,802 |
44,40 |
0,793 |
54,40 |
0,785 |
69,01 |
|||||||||||
|
0 |
23,24 |
0 |
29,07 |
0 |
38,78 |
0 |
50,10 |
0 |
59,90 |
0 |
78,36 |
|||||||||||
|
3. Бутанол |
||||||||||||||||||||||
|
278К |
288К |
298К |
308К |
318К |
328К |
|||||||||||||||||
|
С·104 |
λ |
С·104 |
λ |
С·104 |
λ |
С·104 |
λ |
С·104 |
λ |
С·104 |
λ |
|||||||||||
|
897,1 |
4,85 |
889 |
5,72 |
880,9 |
6,54 |
872,8 |
7,10 |
864,7 |
7,72 |
856,6 |
7,96 |
|||||||||||
|
448,6 |
5,46 |
444,5 |
6,62 |
440,5 |
7,54 |
436,8 |
8,37 |
432,3 |
8,94 |
428,3 |
9,05 |
|||||||||||
|
224,3 |
5,86 |
222,3 |
7,34 |
220,2 |
8,63 |
218,2 |
9,77 |
216,2 |
10,50 |
214,2 |
10,70 |
|||||||||||
|
112,1 |
6,43 |
111,1 |
8,15 |
110,1 |
9,95 |
109,1 |
11,40 |
108,1 |
12,40 |
107,1 |
12,80 |
|||||||||||
|
56,07 |
7,71 |
55,56 |
9,88 |
55,06 |
12,00 |
54,55 |
14,00 |
54,04 |
15,40 |
53,54 |
15,90 |
|||||||||||
|
28,04 |
8,92 |
27,78 |
11,80 |
27,53 |
14,50 |
27,28 |
17,50 |
27,02 |
19,60 |
26,77 |
20,70 |
|||||||||||
|
14,02 |
10,50 |
13,89 |
13,70 |
13,76 |
17,10 |
13,64 |
20,70 |
13,51 |
23,70 |
13,38 |
25,60 |
|||||||||||
|
7,009 |
12,40 |
6,945 |
15,59 |
6,880 |
20,49 |
6,819 |
25,30 |
6,755 |
29,40 |
6,690 |
32,41 |
|||||||||||
|
3,504 |
12,60 |
3,473 |
17,30 |
3,440 |
23,00 |
3,409 |
28,90 |
3,378 |
34,70 |
3,350 |
39,01 |
|||||||||||
|
1,752 |
12,90 |
1,736 |
18,30 |
1,720 |
24,60 |
1,704 |
32,20 |
1,689 |
40,90 |
1,673 |
46,50 |
|||||||||||
|
0,876 |
13,30 |
0,868 |
18,59 |
0,860 |
25,60 |
0,852 |
34,40 |
0,844 |
43,90 |
0,837 |
52,90 |
|||||||||||
|
0,438 |
13,70 |
0,434 |
18,80 |
0,430 |
26,09 |
0,426 |
36,20 |
0,422 |
46,90 |
0,418 |
56,41 |
|||||||||||
|
0,219 |
14,00 |
0,217 |
19,50 |
0,215 |
27,40 |
0,213 |
38,50 |
0,211 |
51,09 |
0,209 |
64,50 |
|||||||||||
|
0 |
15,08 |
0 |
19,58 |
0 |
27,95 |
0 |
41,69 |
0 |
57,34 |
0 |
75,86 |
|||||||||||
|
4. Пентанол |
||||||||||||||||||||||
|
278К |
288К |
298К |
308К |
318К |
328К |
|||||||||||||||||
|
С·104 |
λ |
С·104 |
λ |
С·104 |
λ |
С·104 |
λ |
С·104 |
λ |
С·104 |
λ |
|||||||||||
|
1330 |
2,50 |
1318 |
2,90 |
1306 |
3,36 |
1294 |
3,70 |
1282 |
3,83 |
1270 |
3,65 |
|||||||||||
|
664,9 |
2,51 |
659,0 |
2,93 |
653,0 |
3,25 |
646,9 |
3,44 |
640,8 |
3,47 |
634,9 |
3,28 |
|||||||||||
|
332,4 |
2,88 |
329,5 |
3,35 |
326,5 |
3,68 |
323,4 |
3,86 |
320,5 |
3,85 |
317,5 |
3,60 |
|||||||||||
|
166,2 |
3,24 |
164,7 |
3,80 |
163,3 |
4,27 |
161,7 |
4,51 |
160,2 |
4,56 |
158,7 |
4,28 |
|||||||||||
|
83,10 |
3,89 |
82,37 |
4,60 |
81,62 |
5,25 |
80,85 |
5,65 |
80,10 |
5,71 |
79,36 |
5,23 |
|||||||||||
|
41,55 |
4,48 |
41,18 |
5,44 |
40,81 |
6,13 |
40,43 |
6,59 |
40,05 |
6,70 |
39,68 |
6,41 |
|||||||||||
|
20,77 |
5,44 |
20,59 |
6,70 |
20,40 |
7,74 |
20,21 |
8,58 |
20,02 |
9,01 |
19,84 |
8,68 |
|||||||||||
|
10,39 |
6,63 |
10,29 |
8,37 |
10,20 |
9,91 |
10,10 |
11,00 |
10,01 |
11,60 |
9,918 |
11,20 |
|||||||||||
|
5,193 |
8,11 |
5,147 |
10,60 |
5,100 |
12,80 |
5,052 |
14,40 |
5,005 |
15,40 |
4,959 |
15,20 |
|||||||||||
|
2,596 |
8,74 |
2,573 |
11,60 |
2,550 |
14,60 |
2,526 |
16,90 |
2,502 |
19,30 |
2,479 |
19,60 |
|||||||||||
|
1,293 |
9,50 |
1,282 |
12,80 |
1,270 |
16,60 |
1,258 |
19,80 |
1,246 |
22,00 |
1,235 |
22,90 |
|||||||||||
|
0,649 |
10,30 |
0,644 |
14,40 |
0,638 |
18,60 |
0,632 |
22,91 |
0,626 |
26,61 |
0,620 |
28,80 |
|||||||||||
|
0 |
11,89 |
0 |
17,21 |
0 |
23,27 |
0 |
29,73 |
0 |
35,39 |
0 |
39,83 |
|||||||||||
Погрешность определения константы ячейки не превышала 0,25%, суммарная погрешность определения эквивалентной электрической проводимости не превышала 1,4%.
Расчет эквивалентной электропроводности производился по уравнению плазменно-гидродинамической теории электролитов [10]:
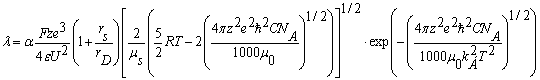 (1)
(1)
где F - постоянная Фарадея, z - эффективный заряд, e - элементарный заряд, ε - диэлектрическая постоянная среды, R - универсальная газовая постоянная, Т - температура в К, ħ - постоянная Планка, С - эквивалентная концентрация электролита, моль/л, NA - постоянная Авогадро,
kБ - постоянная Больцмана, U - энергия водородной связи растворителя, μ0 - приведенная масса несольватированных ионов, μs - приведенная масса сольватированных ионов (катиона и аниона), α - степень диссоциации электролита, rD - дебаевский радиус экранирования равный [10]:
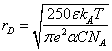 (2)
(2)
rs - приведенный радиус сольватированных ионов [11,12]
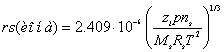 (3)
(3)
![]()
где ns - число сольватации равное [13-16]:
![]() (4)
(4)
В качестве степени диссоциации электролита нами было выбрано выражение:
![]() (5)
(5)
Основные трудности при расчете электропроводности возникли в связи с двумя факторами:
1. Ион водорода, в отличие от ионов металлов, в протогенных растворителях даже теоретически не может быть представлен в индивидуальном состоянии из-за его малого размера, поэтому не представляется возможным рассчитывать значение μ0 (приведенной массы несольватированных ионов электролита) исходя из массы протона, равной единице. Необходимо делать определенные допущения о массе и радиусе иона водорода на основании знания его сольватации в соответствующих системах.
2. Энергия межмолекулярного взаимодействия молекул растворителя неизвестна для подавляющего большинства растворителей. Для спиртов она складывается из энергий специфического (водородной связи) и неспецифического (гидрофобного) взаимодействия.
Разберем эти проблемы отдельно.
Сольватация протона в спиртах. Проблеме сольватации иона водорода в спиртах посвящено большое количество публикаций. Наиболее интересные результаты были получены в [17,18], где спиртовые растворы неорганических кислот исследовались методом ИК-Фурье-спектроскопии. Исследуя непрерывное поглощение симметричной водородной связи в области 2000 см-1, авторы получили, что в широком диапазоне концентраций (до 4-6 моль/л) сольватное число иона водорода в спиртах от метанола до бутанола находится в пределах 2÷2,5. Здесь необходимо учесть, что ИК-спектроскопия чувствительна только к ближнему окружению иона, т.е. может дать информацию лишь о составе первой сольватной оболочки.
Таким образом, можно предположить в рамках плазмоподобной теории электролитов, что минимально сольватированному состоянию протона соответствует состояние с ns = 2. Как будет видно в дальнейшем, в низших спиртах такое предположение вполне оправдано.
Ключевым параметром для расчета электропроводности является значение радиуса «несольватированного» протона. Расчеты с использованием кристаллографического радиуса атома водорода 0,98 приводят к неправдоподобным результатам. В данной публикации для расчетов использовался радиус протона равный:
rs (H+) = 0.26Å + 2Rs
где Rs - радиус молекулы растворителя, r (H+) = 0.26Å [19]. Это приближенно соответствует строению симметричной водородной связи между протоном и двумя молекулами растворителя.
Энергия межмолекулярного взаимодействия (U) . Ранее значения U при 298К и радиусы молекул воды и н-спиртов были вычислены методом множественной регрессии [20]. В данной публикации эти цифры были приняты за основу, а значения энергии при других температурах могут быть найдены из знания предельных электропроводностей следующим образом.
Таблица 2.
Параметры сольватации HCl в н-спиртах
|
T, K |
ns(H+) |
ns(Cl-) |
Ms(H+) |
Ms(Cl-) |
μs(HCl) |
rs(H+), 1010м |
rs(Cl-), 1010м |
rs(HCl), 1010м |
U (6), кДж/моль |
|
|
EtOH |
||||||||||
|
278 |
1,388 |
5,978 |
64,84 |
310,49 |
53,64 |
1,61 |
2,63 |
1,00 |
34,36 |
|
|
288 |
1,410 |
6,000 |
65,84 |
311,49 |
54,35 |
1,59 |
2,57 |
0,98 |
31,18 |
|
|
298 |
1,459 |
6,049 |
68,10 |
313,75 |
55,96 |
1,57 |
2,52 |
0,97 |
27,96 |
|
|
308 |
1,447 |
6,038 |
67,58 |
313,23 |
55,59 |
1,53 |
2,46 |
0,94 |
26,75 |
|
|
318 |
1,463 |
6,054 |
68,31 |
313,96 |
56,11 |
1,50 |
2,41 |
0,93 |
25,08 |
|
|
328 |
1,477 |
6,067 |
68,92 |
314,57 |
56,54 |
1,48 |
2,36 |
0,91 |
23,41 |
|
|
PrOH |
||||||||||
|
278 |
1,644 |
8,115 |
99,66 |
522,41 |
83,69 |
1,49 |
2,54 |
0,94 |
46,73 |
|
|
288 |
1,707 |
8,178 |
103,41 |
526,17 |
86,43 |
1,48 |
2,49 |
0,93 |
43,35 |
|
|
298 |
1,773 |
8,243 |
107,35 |
530,11 |
89,27 |
1,46 |
2,44 |
0,91 |
38,96 |
|
|
308 |
1,840 |
8,311 |
111,40 |
534,16 |
92,18 |
1,45 |
2,39 |
0,90 |
35,57 |
|
|
318 |
1,909 |
8,380 |
115,56 |
538,32 |
95,14 |
1,44 |
2,35 |
0,89 |
33,82 |
|
|
328 |
1,980 |
8,451 |
119,81 |
542,57 |
98,14 |
1,42 |
2,31 |
0,88 |
30,81 |
|
|
BuOH |
||||||||||
|
278 |
1,935 |
9,502 |
144,22 |
738,65 |
120,66 |
1,44 |
2,44 |
0,90 |
56,97 |
|
|
288 |
1,938 |
9,504 |
144,38 |
738,81 |
120,78 |
1,40 |
2,38 |
0,88 |
51,37 |
|
|
298 |
2,065 |
9,631 |
153,79 |
748,22 |
127,57 |
1,40 |
2,34 |
1,65 |
45,90 |
|
|
308 |
2,131 |
9,698 |
158,71 |
753,15 |
131,09 |
1,39 |
2,30 |
0,86 |
38,50 |
|
|
318 |
2,197 |
9,764 |
163,57 |
758,01 |
134,54 |
1,37 |
2,25 |
0,85 |
34,15 |
|
|
328 |
2,262 |
9,829 |
168,38 |
762,81 |
137,93 |
1,35 |
2,21 |
0,84 |
30,93 |
|
|
AmOH |
||||||||||
|
278 |
2,286 |
11,070 |
202,15 |
1009,67 |
168,43 |
1,40 |
2,37 |
0,88 |
64,62 |
|
|
288 |
2,347 |
11,132 |
207,57 |
1015,09 |
172,33 |
1,38 |
2,32 |
0,87 |
55,92 |
|
|
298 |
2,412 |
11,196 |
213,26 |
1020,79 |
176,41 |
1,36 |
2,27 |
0,85 |
50,12 |
|
|
308 |
2,477 |
11,262 |
219,01 |
1026,53 |
180,50 |
1,35 |
2,23 |
0,84 |
46,19 |
|
|
318 |
2,546 |
11,330 |
225,04 |
1032,56 |
184,77 |
1,33 |
2,19 |
0,83 |
44,18 |
|
|
328 |
2,653 |
11,437 |
234,47 |
1041,99 |
191,40 |
1,35 |
2,19 |
0,83 |
43,01 |
|
Если в (1) подставить значение C = 0, то получим выражение для расчета энергии межмолекулярного взаимодействия.
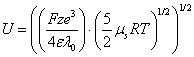 (6)
(6)
Таким образом, становится возможным расчет энергии межмолекулярного взаимодействия при любой температуре (табл. 2).
Расчет эквивалентной электропроводности. На основании найденных параметров сольватации хлороводорода были рассчитаны значения его эквивалентной электропроводности в соответствии с уравнением (1). В качестве критерия соответствия теории эксперименту было выбрано соотношение λэксп/λтеор, где теоретические значения - это значения, полученные по уравнению (1), а экспериментальные - это данные полученные нами. На рис. 1 представлены графики зависимости соотношения λэксп/λтеор во всем диапазоне концентраций для четырех исследованных спиртов в изучаемом диапазоне температур.
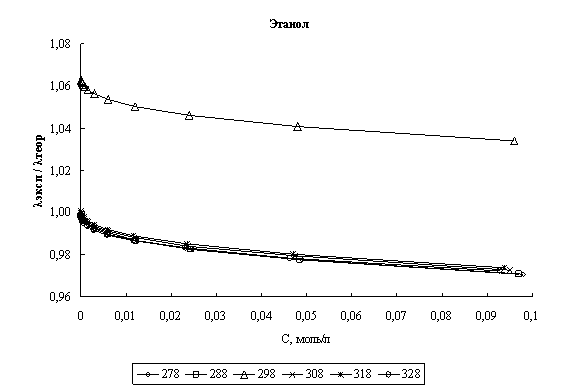
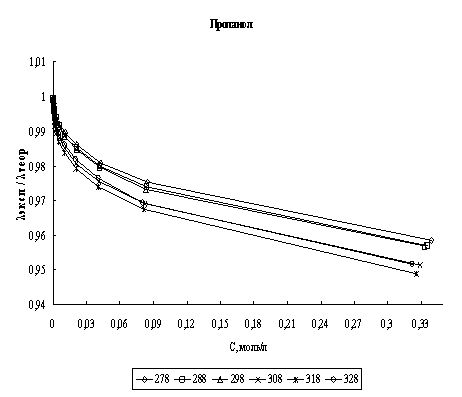
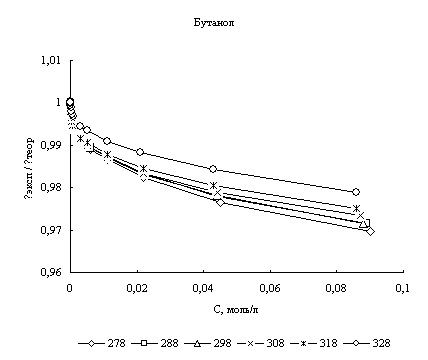
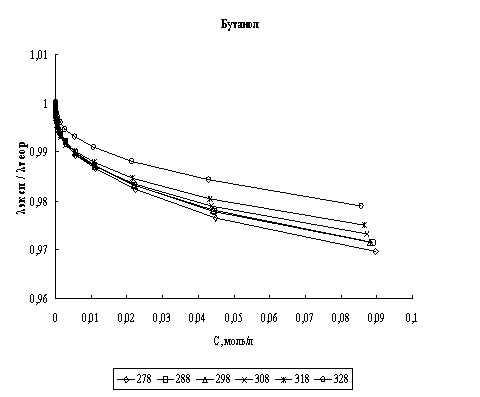
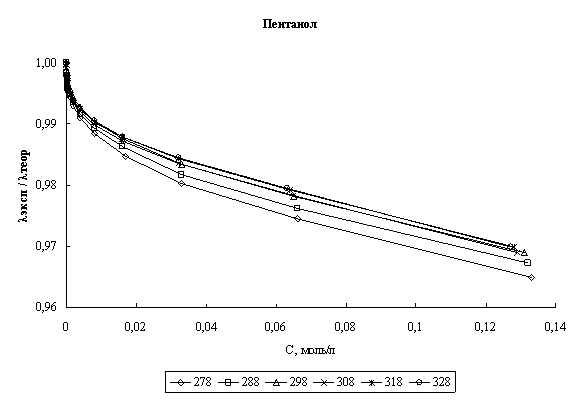
Рис. 1. Концентрационная зависимость соотношения λэксп/λтеор в различных спиртах при различных температурах
Как видно из графика, лишь для этилового спирта соотношение расчетных и литературных значений превышает единицу. Это объясняется тем фактом, что для этанола при 298К было взято литературное значение энергии межмолекулярного взаимодействия (27,96 КДж/моль), а для всех остальных спиртов значение энергии было получено по ур. (3) из знания предельной электропроводности HCl в этих спиртах. Очевидно, что в таком случае соотношение λэксп/λтеор при бесконечном разбавлении
(C = 0) будет в точности равно единице (см. ур. 3).
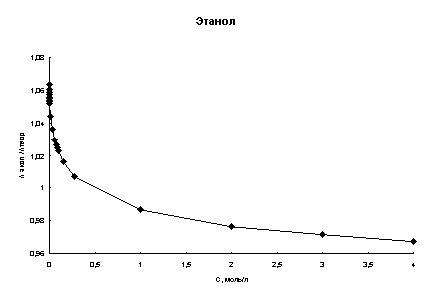
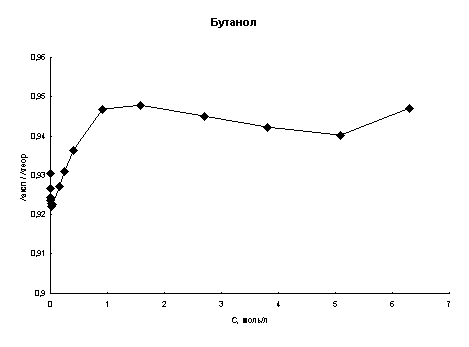
Рис. 2. Концентрационная зависимость соотношения λэксп/λтеор в этаноле и бутаноле при высоких концентрациях хлороводорода (Т=298К)
Также для полноты картины были проведены расчеты эквивалентной электропроводности в области высоких концентраций кислоты. В качестве литературных были выбраны данные из [21]. На рис. 2 показаны графики концентрационной зависимости λэксп/λтеор при 298К для этанола и бутанола.
Анализируя рис. 1 и 2 можно сказать, что расхождение между экспериментальными и расчетными величинами даже при высоких концентрациях составляет порядка нескольких процентов во всех спиртах. Это говорит о том, что в рамках сделанных предположений плазмоподобная теория электролитов хорошо описывает электропроводность хлороводорода в данных четырех н-спиртах.
СПИСОК ЛИТЕРАТУРЫ
- Балданов М.М., Танганов Б.Б., Мохосоев М.В. Плазмоподобное состояние растворов электролитов и диссипативные процессы // Доклады АН СССР. - 1989. - Т. 308. - №2. - С. 397-400.
- Балданов М.М., Танганов Б.Б., Мохосоев М.В. Электропроводность растворов и кинетическое уравнение Больцмана // Журнал физической химии. - 1990. - Т.64. - №1. - С. 88-94; Russian J.Phys.Chem. -1990.-V.64(1).-P.46-49.
- Балданов М.М., Балданова Д.М. Жигжитова С.Б., Танганов Б.Б. Плазменно-гидродинамическая теория растворов электролитов и электропроводность // Доклады АН ВШ России.-2006.- № 1. -С.25-32.
- Вайсбергер А., Проскауэр Э., Риддик Дж., Тупс Э. Органические растворители /Пер. с англ. М.: Издатинлит.- 1958.- 519 с.
- Гордон А., Форд Р. Спутник химика. - М.: Мир.-1976.- 541 с.
- Крешков А.П. Аналитическая химия неводных растворов. -М.:Химия.- 1982.-120 с.
- Танганов Б.Б. Биамперометрическое определение содержания воды в неводных растворителях - модифицированный метод К.Фишера// Сб. "Химия и хим. технология", с.46-50 (Рукоп.депонир.в ОНИИТЭХИМ,Черкассы,1984, №976хп-Д84)
- Пацация Б.К. Подвижность и ассоциация однозарядных ионов в апротонных растворителях при 233 - 318 К. Дисс....канд. хим. наук: Иваново. 1991. 180с.
- Кинчин А.Н., Колкер А.М., Крестов Г.А. Калориметрическая установка с безжидкостной термостатирующей оболочкой для измерения теплот растворения веществ при низких температурах. // Ж. физ. химии. 1986. Т.60. С.782-783.
- Балданов М.М., Балданова Д.М. Жигжитова С.Б., Танганов Б.Б. Плазменно-гидродинамическая теория растворов электролитов и электропроводность // Доклады АН ВШ России.-2006.- № 1. -С.25-32
- Балданов М.М., Танганов Б.Б., Иванов С.В. Дисперсионное уравнение Власова и радиусы сольватированных ионов в метаноле// Журнал общей химии.- 1994.-Т.64.- №1.- С.32-34.
- Балданов М.М., Балданова Д.М., Жигжитова С.Б., Танганов Б.Б. К проблеме радиусов гидратированных ионов // Доклады АН ВШ России.-2006.-Вып.2.-С.32-37.
- Балданов М.М., Танганов Б.Б., Мохосоев М.В. Неэмпирический расчет сольватных чисел ионов в растворах // ДАН СССР. - 1989.- Т.308.- №1.- С.106-110.
- Балданов М.М., Танганов Б.Б. К проблеме сольватных чисел и масс сольватированных ионов в спиртовых растворах // Журнал физической химии. - 1992. - Т.66. - №4. - С.1084-1088; Russian J.Phys.Chem. - 1992. - V.66(4)/-P.572-574.
- Балданов М.М., Танганов Б.Б., Мохосоев М.В. Неэмпирический расчет сольватных чисел ионов в растворах // Межвузовский сб. "Проявление природы растворителя в термодинам.свойствах растворов".- Иваново.- 1989.-С.66-70.
- Балданов М.М., Танганов Б.Б. Расчет сольватных чисел ионов в неводных средах // Журнал общей химии. - 1992. - Т.63. - №8. -С.1710-1712.
- Russian Chemical Bulletin, Vol. 47, No. 12, December. I998
- A. A. Pankov, V. Yu. Borovkov, and V. B. Kazartskii. Dokl Akad. Nauk SSSR, 1981, 258, 902 [Dokl Chem., 1981, 258 (Engl. Transl.)].
- Э.Я. Мэлвин-Хьюз. Физическая химия (книга II).-М.: Издатинлит, 1962.-С.756.
- Танганов Б.Б. Взаимодействия в растворах электролитов: моделирование сольватационных процессов, равновесий в растворах полиэлектролитов и математическое прогнозирование свойств химических систем (монография). // М.: Изд. «Академия естествознания», 2009. - 141 с.
- Новый справочник химика и технолога. Химическое равновесие. Свойства растворов. // СПб.: Изд. НПО "Профессионал", 2004. - 907, 913 с.



