Одним из ценных компонентов пищи, обладающим сорбционными свойствами по отношению к ионам тяжелых металлов, является пектин. Пектиновые вещества присутствуют почти повсеместно во всех высших растениях. Для рационального использования пектина необходимо всестороннее изучение его физико-химических свойств.
В нашу задачу входило исследование цитрусового пектина, полученного после промышленной переработки плодов на сок. Так как пектиновые вещества представляют собой природный ионообменник, изучалась кинетика и сорбционная способность пектина in vitro по отношению к ионам свинца, а также влияние температуры на сорбционную емкость. Известно, что свинец как тяжелый металл связывается с карбоксильными, фосфатными группами биомолекул. При этом он снижает активность ферментов и, купируя метаболические процессы, вызывает сильную интоксикацию организма.[1] Установлено, что кроме физической адсорбции катионов активными центрами пектина, происходит и хемосорбция - образование комплексных соединений пектата свинца. [4]
Сорбционная способность выражается количеством ионов тяжелого металла, связывающихся с 1г пектина. Количество связавшихся ионов свинца определялось по разнице между вносимым и остаточным количеством в расчете на 1г пектина.
Изменение концентрации ионов свинца в водной фазе растворов при контакте с цитрусовым пектином от времени сорбции отражено в таблице 1.
При обработке пектина стандартным раствором основного ацетата свинца образуется рыхлый осадок пектата свинца. Его отфильтровали, а содержание в надосадочной жидкости в различные моменты времени (10-60мин) определяли методом комплексонометрического титрования. Титрование проводилось в среде аммиачного буферного раствора под контролем металлохромного индикатора хромогена. [3]
В реакциях образования пектатов металлов участвуют два вещества и, чтобы учесть изменения концентрации одного из реагирующих веществ (ионов металла), при минимальном влиянии концентрации другого вещества (пектина), использовали метод изолирования Оствальда [2]. Согласно этому методу, реакция проводится с избытком одного из реагентов (пектина) и тогда скорость пропорциональна концентрации другого реагента, взятого в недостатке (ионы металла).
Таблица 1
Изменение концентрации ионов свинца в водной фазе раствора
|
Время, мин |
Количество ионов Pb2+, мг/г |
Концентрация иона Pb2+ в растворе, ммоль/л |
|
0 (ст. р-р) |
103,8 |
5,00 |
|
10 |
88,0 |
4,25 |
|
20 |
83,0 |
4,00 |
|
30 |
73,5 |
3,55 |
|
40 |
71,4 |
3,44 |
|
50 |
67,0 |
3,20 |
|
60 |
67,0 |
3,20 |
Линейность зависимости lgC от времени и постоянство констант скорости в различные отрезки времени свидетельствует о первом порядке реакции взаимодействия пектина с ионами свинца. Средняя величина константы скорости равна 1,325х10-3мин-1
В течение 1 часа максимальное извлечение Pb2+ составляет 64% от равновесной концентрации, что в пересчете на 1г сорбента равно 67 мг ионов свинца.
Сорбция в зависимости от природы адсорбента, особенности его поверхности может подчиняться уравнению Фрейндлиха или Ленгмюра.
Для поиска этой подчиненности рассчитывали на основе полученных данных величину экспериментальной адсорбции, согласно зависимости:
![]() ,
,
где ΔС - изменение концентрации иона Pb2+ в растворе, n - объем раствора (мл), m - масса адсорбента (пектина), г
Нахождение констант уравнения Ленгмюра (А∞ и b) и констант уравнения Фрейндлиха (К, 1/n) осуществляли по графическим зависимостям ![]() и lgАЭКС. =f(lgΔC), соответственно [5].
и lgАЭКС. =f(lgΔC), соответственно [5].
В таблице 2 приведены найденные величины адсорбции.
На рисунке представлены соответствующие изотермы сорбции.
По характеру изученных изотерм и данным табл. 2 можно сделать вывод, что функциональная зависимость сорбции от концентрации катионов свинца подчиняется уравнению Фрейндлиха (А=КС1/ n), описывающего сорбционный процесс на неоднородных пористых поверхностях. Коэффициенты уравнения для изотермы сорбции следующие: К = 0,5; 1/n = 0,9.
Для изучения влияния температуры на сорбционные свойства пектина проводили: замораживание модельных растворов при температуре минус 180С и температурную обработку при 99-1000С в течение 1 часа.
Проведенные исследования показали, что процент сорбционной способности пектина относительно его протекания при комнатной температуре уменьшился на 22,6% при термической обработке и на 1,2% при замораживании.
Таблица 2
Соотношение экспериментальной величины адсорбции ионов Pb2+ на пектине с расчетными
|
ΔС, ммоль/л |
АЭКС. , ммоль/г |
АЛ., ммоль/г |
Аф. , ммоль/г |
АЭКС./ АЛ. |
АЭКС./ Аф. |
|
0,75 |
0,375 |
0,570 |
0,386 |
0,658 |
0,972 |
|
1,00 |
0,500 |
0,740 |
0,500 |
0,676 |
1,000 |
|
1,45 |
0,725 |
1,040 |
0,699 |
0,697 |
1,037 |
|
1,56 |
0,780 |
1,109 |
0,746 |
0,702 |
1,045 |
|
1,80 |
0,900 |
1,259 |
0,846 |
0,714 |
1,060 |
|
|
Ср. = 0,689 |
Ср. = 1,022 |
|||
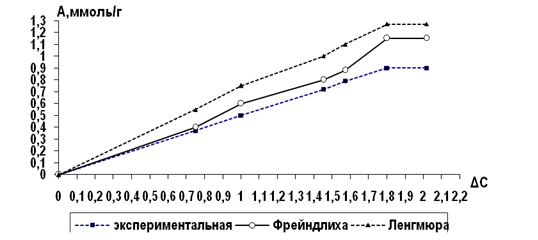
Изотермы сорбции Рb2+ цитрусовым пектином
Полученные данные позволяют рекомендовать цитрусовые пектины в качестве энтеросорбентов для выведения ионов свинца из организма при свинцовой интоксикации.
Относительное сохранение сорбционных свойств пектина при консервировании холодом или термической обработке позволяет рекомендовать его в качестве пищевой добавки к продуктам лечебного и профилактического действия. При этом его преимущество по сравнению с неприродными сорбентами в отсутствии токсичности и хорошей эвакуации из кишечника.
Выводы:
- Установлен факт высокой комплексообразующей способности пектина из цитрусовых по отношению к катионам свинца. Максимальная степень извлечения 64% от исходной концентрации Pb2+ в течении времени сорбции 60 мин.
- Изучение кинетики образования пектата свинца показало, что реакция протекает по первому порядку с величиной константы скорости равной 1,325х10-3 мин-1
- Показано, что сорбционный процесс на поверхности энтеросорбента подчиняется уравнению Фрейндлиха.
- Установлено относительное сохранение сорбционной активности пектина при термической обработке и при замораживании.
СПИСОК ЛИТЕРАТУРЫ
- Агоджанян Н.А.// Химические элементы в среде обитания и экологический портрет человека. М., 2001. - 250 с.
- Денисов Е.Т.// Кинетика гомогенных химических реакций. М.,1978. - 368 с.
- Нилина В.В.// Пектин. Методы контроля в пектиновом производстве. Киев.1992. - 180 c.
- Решетников В.И. // Химико-фармацевтический журнал. - 2003.- Т 37. № - 5. С. 28 - 32.
- Фролов Ю.Г.// Поверхностные явления и дисперсные системы. М., 1982. - 400 c.



