Многообразие мышечных функций отражается в особенностях архитектуры мышечных волокон. Архитектура скелетной мышцы - важный детерминант функциональных характеристик мышцы [1, 7, 8]. Морфологически мышцы человека можно разделить на мышцы с параллельным расположением волокон относительно оси активности мышцы и перистые мышцы, волокна которых расположены под некоторым углом относительно оси сухожильного комплекса и места прикрепления к апоневрозу или вхождения в сухожилие [8]. Волокна мышцы упакованы в связки, или иначе в пучки, которые простираются от проксимального до дистального сухожилия мышцы. Перистые мышцы имеют длинные сухожилия и апоневроз, которые обладая существенной податливостью [9], демпфируют возможности мышцы, вызывая изменения длины волокна. Таким образом, сила сокращающихся волокон мышцы, генерирующих силовые возможности, изменяется на уровне пучка мышцы. Угловая конструкция мышцы оказывает существенное влияние на передачу силы от волокон мышцы к ее сухожилию: чем выше угол перистости волокна, тем выше силовой потенциал мышцы [8, 16].
Угол перистости волокна изменяется в зависимости от величины изометрического сокращения мышцы. Несколько исследований показали [например, 17, 21, 24], что изометрическое сокращение изменяет длину и угол перистости волокон мышцы и величина этих изменений при сокращении определяется силой, развиваемой мышцей и последовательно расположенного сухожилия: чем выше сила сокращения и более податливое сухожилие, тем больше степень укорочения волокна и увеличение угла перистости относительно состояния покоя [8, 20, 21]. Попытки определить геометрию расположения мышечных волокон или пучков у человека в основном ограничивались прямым анатомическим анализом фрагментов, полученных путем рассечения трупных препаратов [12, 33]. Однако данные относительно архитектуры бальзамированных мышц человека не отражают истинных размеров волокон in vivo и архитектурных изменений активно сокращающихся мышц, наблюдаемых в условиях in vivo или in situ, поскольку архитектура мышцы изменяется даже в изометрических условиях сокращения мышцы [6, 7].
Морфологические измерения мышц могут быть получены на микроскопическом уровне, определяемом по площади поперечного сечения отдельного мышечного волокна при анализе биопсийной пробы мышцы, и на макроскопическом уровне при оценке площади поперечного сечения или объеме мышцы, используя компьютерную и магнитно-резонансную томографию. Метод магнитно-резонансной томографии является «золотым стандартом» в исследовании размера мышц у человека [21, 24], благодаря высокому контрасту в отображениях между тканями, отличающихся молекулярными свойствами. Однако использование магнитно-резонансной томографии ограничивается большими клиническими требованиями и высокой стоимостью этих исследований. Это указывает на важность использования неинвазивных методов определения архитектуры мышц у живых субъектов и, в частности у человека для анализа изменений механики сокращения скелетных мышц.
В связи с этим одним из доступных и неинвазивных методов, позволяющих визуализировать структуру мышцы и определять изменения ее архитектуры, т.е. регистрировать изменения угла перистости и длины волокон мышцы в определенном ее участке при некотором суставном угле конечности и при определенном уровне напряжения мышцы (21, 24), может быть метод ультразвукового сканирования [6, 24]. Первоначально метод ультразвукового сканирования (М-режим) использовался для оценки кожно-жировой складки и толщины мышцы [11, 15]. Фактически, Ikai и Fukunaga [15] были первыми, сообщившими о возможности использования ультразвука в исследованиях скелетных мышц у человека и, в частности измерении размера мышц (площади поперечного сечения) и толщины кожно-жирового слоя.
С развитием ультразвуковой технологии и совершенствованием ультразвукового оборудования и разработкой метода В-режима ультразвукового сканирования появилась возможность визуализировать изображения мышцы и получать количественную и качественную информацию об особенностях ее строения, иными словами, появился альтернативный метод в реальном времени визуализировать мышцу в условиях in vivo и исследовать изменения ее архитектуры [21, 24, 28]. В настоящее время метод B‑режима ультразвукового сканирования мышц нашел широкое применение в различных областях и используется в клинической практике [11, 20, 25, 28], в спортивной медицине [29], в возрастной физиологии [32, 33].
Кроме того, изучение архитектуры скелетной мышцы важно, поскольку представляется возможность оценить степень адаптации мышечного аппарата у человека в ответ на увеличенную или на сниженную функциональную нагрузку [18, 25, 27]
Целью настоящей работы являлось количественное исследование методом ультразвукового сканирования мышечной архитектуры (длины и угла перистости волокон) разных головок трехглавой мышцы голени (ТМГ) у здоровых лиц и пациентов с опорно‑двигательными нарушениями в условиях in vivo при пассивном и активном состояниях.
МЕТОДИКА
Испытуемые
В исследовании приняли участие 16 добровольцев, которые были разделены на две группы. Первую, контрольную, группу составили 8 здоровых мужчин (возрастом 52 ± 3.6 года) с нормальным физическим развитием, без признаков заболеваний мышечной системы. Все испытуемые вели обычный образ жизни и имели нормальное физическое и нервно-психическое развитие. Во вторую группу вошли 8 пациентов (4 мужчин и 4 женщины) возрастом 55 ± 3.4 года с нарушениями опорно‑двигательной функции различной этиологии, связанной длительным периодом обездвиживания, вызванного иммобилизацией конечности в послеоперационный или послетравматический период, длительным постельным режимом вследствие острого нарушения мозгового кровообращения и его последствий, а также больные с облитерирующим атеросклерозом сосудов нижних конечностей (слабость в конечностях), последствиями детского церебрального паралича, ишемической миелопатией, радикулопатией на фоне заболеваний позвоночника (остеохондроз), мышечно-тоническими нарушениями.
Исследования выполнены на базе Федерального Государственного Учреждения «Клиническая больница № 1» Управления Делами Президента Российской Федерации. Экспериментальные процедуры проводились в соответствии с Хельсинской Декларацией и все испытуемые дали письменное согласие на их проведение после полной информации о процедурах и задачах настоящего исследования.
Архитектура мышц
Для исследования архитектуры медиальной икроножной мышцы (МИМ), латеральной икроножной мышцы (ЛИМ) и камбаловидной мышцы (КМ) в реальном времени использовали В-режим изображения ультразвуковой системы (модель «SoloLine Elegra», Siemens, Germany) с электронным линейным датчиком 7.5 МГц, длиной сканирующей поверхности
60 мм и толщиной 10 мм[1]. Для лучшего акустического сцепления сканирующую поверхность датчика и кожную поверхность мышцы покрывали специальным гелем и датчик ориентировали по средне‑сагиттальной оси мышцы. Качество ультразвукового изображения мышечного пучка достигалось регулировкой глубины и яркости ультразвукового сигнала. Во время ультразвуковых исследований испытуемых инструктировали - «полностью расслабить мышцы конечности».
Во время ультразвукового исследования получали фрагментарное и панорамное изображения продольного или поперечного сечения мышцы. Для получения фрагментарного изображения продольного сечения мышцы датчик фиксировался перпендикулярно к поверхности мышцы и продольно в области наибольшей анатомической площади поперечного сечения мышцы с «захватом» анэхогенной линии маркера, расположенного по окружности голени. Для получения фрагментарного изображения поперечного сечения мышцы датчик располагался перпендикулярно к поверхности мышцы и вдоль поперечной оси мышцы. Для получения панорамного изображения продольного сечения мышцы датчик плавно перемещался по продольной оси в направлении от проксимального к дистальному концу мышцы, а для получения фрагментарного изображения поперечного сечения мышцы датчик перемещался по окружности задней поверхности голени в поперечном направлении вдоль маркера. Маркер представлял собой медную проволоку (Ø 1.5 мм) в мягкой пластиковой оболочке и располагался по окружности голени на уровне (см. ниже), соответствующем наибольшей анатомической площади поперечного сечения мышцы. Во время сканирования применяли минимальное давление датчика на кожные покровы, чтобы избежать давления на мышцу. Полученные изображения записывались на жесткий диск с формированием файла для дальнейшего анализа.
Визуализация изображения МИМ, ЛИМ и КМ осуществлялась в условиях покоя (пассивное состояние) и при развитии усилия, составляющего 50 % от МПС (активное состояние) при нейтральной позиции в коленном и голеностопном суставах (угловая позиция - 90º).
Измерение длины и угла пучков
Ультразвуковые изображения МИМ, ЛИМ и КМ в пассивном (условия покоя) и активном (усилие 50 % МПС) состояниях были получены на уровнях, составляющих 30 % (МИМ и ЛИМ) и 50 % (КМ) расстояний между подколенной складкой и центром боковой лодыжки конечности при положении в голеностопном суставе 90º [17]. Каждый уровень соответствовал максимальной анатомической площади поперечного сечения соответствующей мышцы [7]. На этом уровне была определена ширина МИМ и ЛИМ; для КМ - большая толщина отмечалась в латеральной части мышцы. На этих уровнях закреплялся маркер, который являлся ориентиром во время исследования, чтобы датчик во время измерений не смещался. В этом положении было получено продольное ультразвуковое изображение и визуализировались волокна. Визуализировалось одно волокно и, перемещая сканирующую головку по поверхности мышцы вдоль маркера, получали панорамное изображение целого волокна.
Длина (L) волокна мышцы (рис. 1) определялась как расстояние между местом прикрепления волокна у поверхностного апоневроза до места его вхождения в глубокие слои апоневроза [6, 16, 17, 24]. Визуализируя по ультрасонограмме волокна по их длине от поверхностного к глубокому апоневрозу, можно проверить правильность сканирования волокна [16].
Угол (Θ) перистости волокна определялся как угол, создаваемый линией, проведенной от точки прикрепления волокна у поверхностного слоя апоневроза к месту прикрепления волокна к глубокому слою апоневроза [6, 16, 24] (рис. 1 и 2).
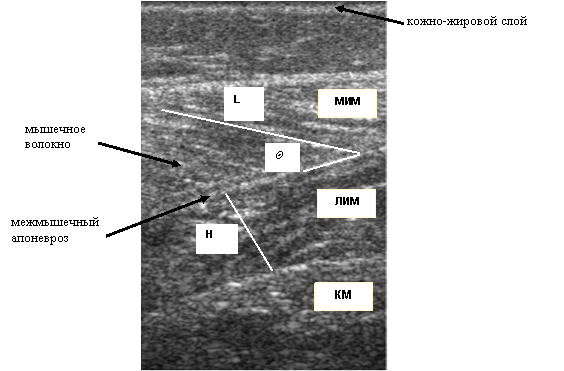
Рис. 1. Ультразвуковые изображения продольного сечения медиальной икроножной мышцы (МИМ), латеральной икроножной мышцы (ЛИМ) и камбаловидной мышцы (КМ) от одного испытуемого. Представлена архитектурная особенность длины (L), угла (Q) перистости волокна и расстояния (H) между глубоким и поверхностным апоневрозом
Измерение толщины мышцы
Толщина мышцы (H) измерялась как расстояние между поверхностным и глубоким слоями апоневроза мышцы [6, 17, 24] (рис. 1).
Ультразвуковые изображения - L, Θ перистости волокна и Н мышцы записывались на жесткий диск («SoloLine Elegra», Siemens, Germany) с формированием файла для дальнейшего анализа с использованием пакета программ «Magic View 300» (Siemens, Германия) и с архивацией данных в системе «Sinet» (Siemens, Germany). У каждого испытуемого измерялись три пучка (волокна), затем полученные данные усреднялись и анализировались. Коэффициент вариации трех измерений находился в диапазоне 0-2 %.
Измерение силы
Для определения суставных моментов во время выполнения произвольных изометрических сокращений ТМГ использовали изокинетический динамометр (модель «CYBEX®II», USA). Все измерения были выполнены на правой конечности. Во время измерения суставного момента, развиваемого ТМГ, стопа исследуемой конечности относительно жестко фиксировалась на специальной платформе изокинетического динамометра. При этом ось вращения платформы совмещалась с осью вращения в голеностопном суставе. Стопа фиксировалась в нейтральной анатомической позиции (угол в голеностопном суставе - 90º).
Перед тестовой процедурой испытуемый выполнял стандартную разминку и 3-5 субмаксимальных сокращений для ознакомления с тестовой процедурой. Затем испытуемого инструктировали «как можно сильнее сократить мышцу» и измеряли максимальный суставной момент (максимальную произвольную силу - МПС). Учитывался лучший результат из трех попыток.
Статистика
При обработке полученных результатов исследования рассчитывали среднюю и стандартную ошибку средней (М±m); различие между показателями оценивали с помощью t-критерия Стьюдента, и уровень достоверности р < 0.05 признавался как существенный.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
На рисунке 2 представлены оригинальные записи ультразвуковых изображений продольного среза МИМ (слева; вверху) и ЛИМ и КМ (слева; внизу) у человека в условиях покоя (слева) и при усилии 50 % МПС (справа). Выявлены особенности архитектуры мышц и их изменения при напряжении. При визуализации изображения четко просматривается подкожно-жировой слой, верхний и нижний слои апоневроза мышцы, а также упакованные в пучки мышечные волокна, которые простираются от поверхностного к глубокому слою апоневроза. Пучки внутримышечных волокон размещены наклонно относительно их сухожилия и хорошо видно (рис. 2, справа), как угол перистости (pennation angle) и длина волокон изменяются при сокращении мышцы. Архитектура мышц представлена почти параллельно идущими эхонегативными (гипоэхогенными) мышечными волокнами и эхопозитивными (гиперэхогенными) линейными структурами, расположенными между верхним и нижним слоями апоневроза мышцы. Хорошо определяются L и Θ перистости волокна и толщина мышцы. Мышечные волокна КМ в проксимальных отделах имеют параллельное и веерообразное расположение, а в дистальных отделах наблюдаются участки с параллельным расположением мышечных волокон.
В таблице 1 представлены усредненные данные L, Θ перистости волокон, Н МИМ, ЛИМ и КМ в условиях покоя (пассивное расслабленное состояние). Ультразвуковые изображения разных головок мышц-разгибателей стопы в группе пациентов сравнивались с группой контроля. В МИМ и ЛИМ L волокон у пациентов с опорно‑двигательными нарушениями была больше по сравнению с группой здоровых лиц (контрольной группы), тогда как в КМ различий между группами не обнаруживалось (рис. 3). Величина Θ перистости волокон МИМ, ЛИМ и КМ существенно не отличалась как между разными головками ТМГ, так и между группами. H МИМ и ЛИМ у пациентов с опорно‑двигательными нарушениями существенно не отличалась от контрольной группы, и лишь в КМ отмечалось увеличение (на 12.2 %) по сравнению с контрольной группой (табл. 2; рис. 3).
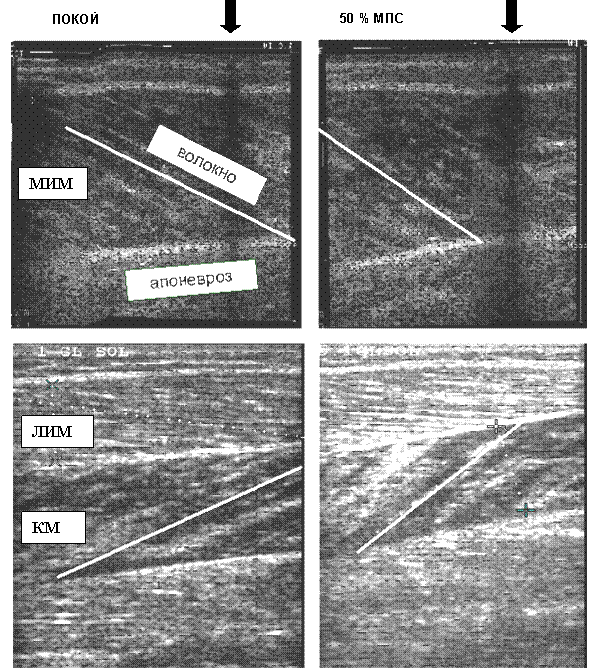
Рис. 2. Сонограммы МИМ, ЛИМ и КМ
Ультразвуковые изображения продольных срезов МИМ, ЛИМ и КМ в расслабленном состоянии (пассивном, слева) и во время изометрического сокращения (активном состоянии, справа) при нейтральном положении голеностопного сустава. Стрелка указывает на тень от маркера, расположенного между ультразвуковым датчиком и мышцей. Белая линия на ультразвуковом изображении - угол перистости волокна, проходящая от глубокого к поверхностному слою апоневроза.
Как следует из анализа ультразвуковых изображений, L и Θ перистости волокон изменялись при переходе от пассивного к активному состоянию. Степень изменения L волокна МИМ, ЛИМ и КМ была различной (рис. 3). Влияние условий (пассивное или активное состояние) на L волокна были более существенны в МИМ и ЛИМ (рис. 3, А). Другими словами, L волокон в МИМ и ЛИМ были большими как при активном, так и пассивном состояниях, чем в КМ (табл. 1). При активном состоянии изменения L волокна в МИМ контрольной группы были большими по сравнению с группой пациентов с опорно‑двигательными нарушениями. Изменений L волокна в КМ между группами не было отмечено (табл. 2; рис. 3).
Таблица 1. Усредненные данные длины (L), угла перистости (Θ) волокон и толщины (H) разных головок трехглавой мышцы голени
|
Группы |
L, (мм) |
Θ, (град) |
H, (мм) |
|
Медиальная икроножная мышца (МИМ) |
|||
|
контроль |
32.7 ± 1.7 |
24.6 ± 1.2 |
14.8 ± 1.6 |
|
пациенты |
37.7 ± 2.1 |
20.6 ± 2.8 |
13.7 ± 1.4 |
|
Латеральная икроножная мышца (ЛИМ) |
|||
|
контроль |
35.2 ± 3.3 |
18.8 ± 1.7 |
13.2 ± 2.1 |
|
пациенты |
39.2 ± 4.4 |
19.1 ± 2.6 |
12.2 ± 1.4 |
|
Камбаловидная мышца (КМ) |
|||
|
контроль |
29.7 ± 1.5 |
24.5 ± 1.4 |
12.3 ± 0.7 |
|
пациенты |
29.0 ± 3.1 |
24.4 ± 4.6 |
13.8 ± 2.1 |
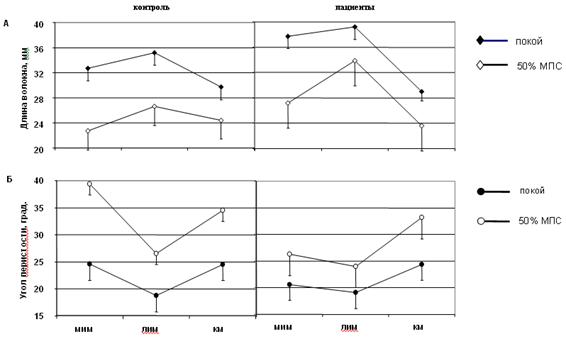
Рис. 3. Длина (А) и угол наклона (Б) мышечных волокон МИМ, ЛИМ и КМ как функция покой‑напряжение при нейтральном положении голеностопного сустава
Из анализа полученных данных следует, что Θ перистости волокна также изменялся во время изометрического сокращения мышцы и эти изменения были не идентичны как между разными головками ТМГ, так и между группами здоровых лиц и пациентов с моторными нарушениями (рис. 3, Б). Показатели Θ перистости волокон разных головок ТМГ демонстрировали большую вариацию в контрольной группе по сравнению с группой пациентов с моторными нарушениями. Так, Θ перистости волокна в контрольной группе при переходе от пассивного к активному состоянию мышцы колебался от 60.2 % (для МИМ) до 40.8 % (для КМ), а у пациентов с моторными нарушениями - от 27.7 до 36.1 % соответственно (табл. 2; рис. 3). Более того, если в контрольной группе наименьшие изменения Θ перистости волокна отмечается в ЛИМ и КМ, то у пациентов с опорно‑двигательными нарушениями наблюдается прямо противоположная картина: наименьшие изменения отмечались в МИМ и ЛИМ и наибольшие - в КМ (36.1%; табл. 2).
При пассивном состоянии в контрольной группе не обнаружено различий в Θ перистости волокон между ЛИМ и КМ, а в группе пациентов с опорно‑двигательными нарушениями - между МИМ и ЛИМ. При активном состоянии Θ перистости волокна изменялся в ЛИМ и КМ и эти изменения были более выражены в контрольной группе по сравнению с группой пациентов (табл. 2). Средняя величина Θ перистости волокон МИМ, ЛИМ и КМ при активном состоянии в контрольной группе увеличилась на 60.2, 40.9 и 40.8 %, тогда как в группе пациентов с опорно‑двигательными нарушениями это увеличение было значительно меньшим и составило 2.7, 25.7 и 36.1 % соответственно (табл. 2).
При переходе от пассивного к активному состоянию H КМ (рис. 4) у пациентов с опорно‑двигательными нарушениями практически не изменилась (составила в среднем 3.3%), в ЛИМ слегка увеличилась (на 10.7%), а в МИМ - уменьшилась (-4.4 %). Тогда как группа контроля в аналогичных условиях обнаруживала увеличение H МИМ в среднем на 9.4 %, в ЛИМ и КМ - на 21.9 % (p<0.05) и 17.9 % (p<0.05) соответственно (табл. 2; рис. 4).
Таблица 2. Изменение длины (L), угла перистости (Θ) волокон и толщины (H) разных головок трехглавой мышцы голени при переходе от пассивного состояния к активному
|
Группы |
L, (∆%) |
Θ, (∆%) |
H, (∆%) |
|
Медиальная икроножная мышца (МИМ) |
|||
|
контроль |
-30.6 |
60.2 |
9.4 |
|
пациенты |
-27.9 |
27.7 |
-4.4 |
|
Латеральная икроножная мышца (ЛИМ) |
|||
|
контроль |
-24.4 |
40.9 |
21.9 |
|
пациенты |
-13.5 |
25.7 |
10.7 |
|
Камбаловидная мышца (КМ) |
|||
|
контроль |
-17.8 |
40.8 |
17.9 |
|
пациенты |
-18.6 |
36.1 |
3.6 |
Примечание: ∆, % = ![]() х 100
х 100
ОБСУЖДЕНИЕ
Основной результат настоящего исследования, состоит в том что i) впервые описывается изменение архитектуры и функции медиальной икроножной мышцы (МИМ), латеральной икроножной мышцы (ЛИМ) и камбаловидной мышцы (КМ) у здоровых лиц и пациентов в условиях in vivo в покое и во время изометрического подошвенного сгибания (50 % МПС), ii) архитектура МИМ, ЛИМ и КМ (длина волокна и угол перистости) у человека в условиях in vivo существенно изменяется как функция угла голеностопного сустава в условиях покоя, iii) впервые количественно описано взаимоотношение архитектуры разных головок мышц‑разгибателей стопы во время изометрического сокращения при постоянном (установленным) суставном угле, используя ультразвуковое сканирование.
Архитектура мышцы вместе с ее внутренними свойствами, такими как композиция волокон, затрагивает функциональные характеристики мышцы: максимальную силу сокращения и максимальную скорость укорочения [1, 2, 26], поэтому информация относительно архитектуры мышц является крайне важной при изучении функций мышцы. Как показывают результаты настоящего исследования, полученные в условиях in vivo, что компьютеризированная сонография обеспечивает детальное описание изменений в архитектуре разных головок ТМГ при установленном суставном угле, наблюдающееся в условиях покоя и во время изометрического сокращения мышцы. Настоящее исследование показало надежность техники ультразвукового сканирования и обеспечивает возможность измерения длины, угла перистости мышечного пучка, толщины мышцы, которые являются представительскими, и не искажает изучаемые параметры мышцы при перемещении датчика.
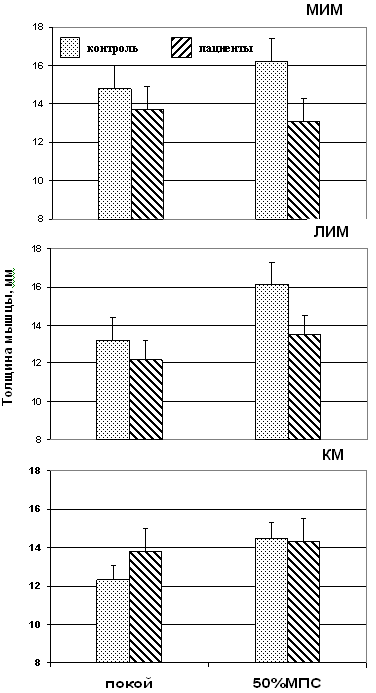
Рис 4. Толщина МИМ, ЛИМ и КМ в расслабленном (пассивном) и во время изометрического усилия (активном) состояниях при нейтральном положении голеностопного сустава
Ранее выполненные исследования показали, что различия в максимальной силе и максимальной скорости укорочения МИМ и КМ определены преимущественно их архитектурными свойствами [12, 17, 32]. ЛИМ имеет самые большие длины волокон в целой ТМГ. Это означает, что число саркомеров в этой мышце наибольшее, обеспечивая мышце высокий скоростной потенциал [12, 32]. С другой стороны, МИМ характеризуется более короткой длиной, но большими углами перистости волокон. Таким образом, МИМ может упаковать большее количество волокон в пределах некоторого объема, и, следовательно, имеет большой потенциал для развития силы. Это согласуется с данными, что физиологическая площадь поперечного сечения МИМ в 2.5 раз больше, чем у ЛИМ, тогда как различие в объеме между МИМ и ЛИМ составляет всего лишь в 1.7 раза [7]. Более того, максимальная скорость укорочения волокна/мышцы определяется также и составом (типом) волокон, формирующих данную мышцу [30], но поскольку состав волокон МИМ и ЛИМ в среднем одинаков [14], то максимальная скорость укорочения и максимальная сила, развиваемая мышцей, определяется преимущественно архитектурными свойствами.
Пациенты с нарушениями опорно‑двигательной функции выполняют крайне мало быстрых, интенсивных, движений в своей повседневной двигательной деятельности и, соответственно не вовлекают в активность быстрых и развиваемых большую силу мышечного сокращения волокон типа II [3, 19]. Обычно атрофию мышц, отмечаемую при длительном «неупотреблении» мышечного аппарата, связывают с уменьшением массы мышцы и мышечных волокон [19], особенно размеров волокон типа II [19], площади поперечного сечения (или объема) мышцы [18, 24]. Однако поскольку большинство мышц у человека перистые [5], то более корректно при интерпретации феномена атрофии мышц и ее функциональных сдвигов, необходимо учитывать и принимать во внимание изменения внутренней организации мышцы, т.е. мышечную архитектуру.
В нашем исследовании при ультразвуковом сканировании МИМ, ЛИМ и КМ в группе здоровых лиц и пациентов с нарушениями опорно‑двигательной функции обнаружены существенные различия в архитектуре мышц. Ультразвуковое отображение показывает, что «неупотребление» вызывает существенные изменения внутренней архитектуры МИМ, ЛИМ и КМ. В группе пациентов с нарушениями опорно‑двигательной функции обнаружено уменьшение длины и угла перистости волокон, что подтверждается ранее полученными данными [22]. Уменьшение длины волокон мышцы предполагает потерю не только последовательно, но и параллельно расположенных саркомеров [25, 27]. Функциональным последствием уменьшенной длины волокна мышцы может быть более низкий уровень генерирования силы сокращения пациентами с нарушениями опорно‑двигательной функции; уменьшение абсолютного количества последовательно расположенных саркомеров способствует тому, что величина максимально возможного сокращения целого волокна будет снижена. Меньший угол перистости волокна во время сокращения мышцы в группе пациентов с нарушениями опорно‑двигательной функции позволяет предположить, что это дает частичную компенсацию за потерю силы в более эффективной передаче развиваемой волокном силы к сухожилию мышцы.
Слабость мышц в пассивном состоянии (в состоянии покоя) представляет проблемы в системе управления произвольным движением. Слабые мышцы, возможно, укорачиваются на меньшую длину, чем их оптимальная длина волокна до того как сухожилие становится достаточно растянутым, чтобы выдержать большее напряжение при этих длинах волокна и при этих условиях волокна менее способны генерировать силу. Как ранее было показано, интрафузальные волокна мышцы могут стать слабыми и при физиологических длинах, что уменьшает способность веретен мышцы действовать как преобразователи длины мышцы [4, 23]. Слабость экстрафузальных волокон также уменьшает чувствительность датчиков к изменению длины мышечного волокна и, следовательно, снижается рефлекторная роль проприорецептивных путей, приписанных центростремительным волокнам [10, 13].
В заключение, полученные результаты показывают, что компьютеризированная сонография обеспечивает детальное описание изменений в архитектуре (угол перистости, длину волокна) мышцы у человека в состоянии покоя и при ее сокращении. Процедура надежна, обеспечивает возможность измерения угла перистости мышечного волокна и не искажает мышцу при перемещении датчика. Основные, новые, результаты исследования - то, что мышечная архитектура разных головок ТМГ значительно различается, что, по‑видимому, отражает их разную функциональную роль в произвольных движениях.
Метод ультразвукового сканирования мышц является высокоинформативным и доступным методом оценки архитектуры скелетных мышц у человека и может быть использован в комплексе с другими методами для оценки функционального состояния мышц и для изучения механизмов, определяющих изменения под влиянием различных факторов, а сравнительное изучение архитектуры мышц у пациентов с различными моторными нарушениями важно для понимания процессов, происходящих у здоровых лиц под влиянием действия различных факторов, в том числе микрогравитации, спортивной тренировки, при различных заболеваниях и при проведении лечебных и реабилитационных мероприятий.
Автор выражает большую благодарность Н.К. Витько (зам. главного врача ФГУ «Клиническая больница № 1» УД Президента РФ, д.м.н.) за предоставленную возможность выполнить данное исследование. Особую признательность автор выражает Кузьминой М.М, врачу высшей категории, к.м.н. за выполненные ультразвуковые исследования (зав. отделом ультразвуковой диагностики - А.Г. Зубанов, к.м.н. и зав. ультразвуковым кабинетом - Назаренко В.А., к.м.н.)
Наконец, автор выражают благодарность всем пациентам и добровольцам, которые участвовали в этом исследовании и без их участия не было бы возможности получить фактический материал.
СПИСОК ЛИТЕРАТУРЫ:
- AlexanderR.McN., VernonA. The dimensions of knee and ankle muscles and the forces they exert // J. Human Mov. Studies. - 1975. - 1. - P. 115-123.
- Bodine S.C., Roy R.R., Meadows D.A., Zernicke R.F. Sacks R.D., Fournier M., Edgerton V.R. Architectural, histochemical, and contractile characteristics of a unique biarticular muscle: the cat semitendinosus. // J. Neurophysiol. - 1982. - 48. - P. 192-201.
- BurkeR.E. Motor units: anatomy, physiology, and functional organization // Handbook of physiology (Brooks V.B., ed.). Section 1. The Nervous system. V. II. Motor control. part 1, - 1981. - P. 345-422.
- Elek J., Prochazka A., Hulliger M., Vincent S. In-series compliance of gastrocnemius muscle in cat step cycle: do spindles signal origin-to-insertion length? // J. Physiol. - 1990. - 429. - P. 237-258.
- Feneis H. Zur Funktion schräggefürten Muskelfanern // Årtz. Woch.-Schr. - 1946. Bd. 1. - 15/16. - S. 231.
- FukunagaT., IchinoseY., ItoM., KawakamiY., Fukashiro S. Determination of fascicle length and pennation in a contracting human muscle in vivo. // J. Appl. Physiol. - 1997, - 82. - P. 354-358.
- FukunagaT, RoyR.R., ShellockF.G., HodgsonJ.A., LeeP.L., Kwong-FuH., EdgertonV.R. Physiological cross-sectional area of human leg muscles based on magnetic resonance imaging // J.Orthop. - 1992. - 10. - P. 926-934.
- GansC., BockW.J. The functional significance of muscle architecture - a theoretical analysis // Ergeb. Anat. Entwicklungsgesch. - 1965. - 38. - P. 115-142.
- Griffiths R.I. Shortening of muscle fibres during stretch of the active cat medial gastrocnemius muscle: the role of tendon compliance. // J. Physiol. - 1991. - 436. - P. 219-236.
- Hagbarth K.E., Nordin M, Bongiovanni L.G. After-effects on stiffness and stretch reflexes of human finger flexor muscles attributed to muscle thixotropy. // J. Physiol. - 1994. - 482. - P. 215-223.
- HeckmattJ., PierN., DubowitzV. Assessment of quadriceps femoris muscle atrophy and hypertrophy in neuromuscular disease in children. // J. Clin. Ultrasound. - 1988. - 16. - P. 177-181.
- Huijing Р.А. Architecture of the human gastrocnemius muscle and some functional consequences. Acta Anat. 1985. - 123. - P. 101-107.
- Jahnke M.T., Proske U., Struppler A. Measurements of muscle stiffness, the electromyogram and activity in single muscle spindles of human flexor muscles following conditioning by passive stretch // Brain Res. 1989. - 493. - P. 103-112.
- Johnson М.А., Polgar J., Weightman D., Appleton D. Data оn the distribution of fibre types in thirty-six human muscles: an autopsy study. // J. Neurol. Sci. - 1973. - 18. - P. 111-129.
- IkaiM., FukunagaT. Calculation of muscle strength per unit cross-sectional area of human muscle by means of ultrasonic measurement. // Int. Z. Angew. Physiol. - 1968. - 26. - P. 26-32.
- KawakamiY., AbeT., FukunagaT. Muscle-fiber pennation angles are greater in hypertrophied than in normal muscles. // J. Appl. Physiol. 1993. - 74. - P. 2740-2744.
- KawakamiY., IchinoseY., FukunagaT. Architectural and functional features of human triceps surae muscle during contraction. // J. Appl. Physiol., 1998. - 85. - P. 398-404.
- Kawakami Y., Akima H., Kubo K., Muraoka Y., Hasegawa H., Kouzaki M., Imai M., Suzuki Y., Gunji A., Kanehisa H., Fukunaga T. Changes in muscle size, architecture, and neural activation after 20 days of bed rest with and without resistance exercise // Eur. J. Appl. Physiol. - 2001. - 94. - P. 7-12.
- Lexell J., Taylor C., Sjöström M. What is the cause of ageing atrophy? Total number, size and proportion of different fiber types studied in whole vastus lateralis muscle from 15- to 83-years-old men // J. Neurol. Sci. - 1988. - 84. - P. 275-294.
- LieberR.L., SteinmanS., BarachI., ChambersH. Structural and functional changes in spastic skeletal muscle. // Muscle Nerve. - 2004. - 29. - P. 615-627.
- MaganarisC.N., BaltzopoulosV., SargeantA.J. In vivo measurements of the triceps surae architecture in man: implications for muscle function. // J. Physiol. 1998. - 512. - P. 603-614.
- Maganaris C.N. In vivo tendon mechanical properties in young adults and healthy elderly // Plasticity of the Motor System: "Adaptations to Increased Use, Disuse and Ageing". Manchester Metropolitan Univ. - 2001. - P. 13-14.
- Morgan D.L., Prochazka A., Proske U. The after-effects of stretch and fusimotor stimulation on the responses of primary endings of cat muscle spindles // J Physiol. - 1984. - 356. - P. 465-477.
- NariciM.V., BinzoniT., HiltbrandE., FaselJ, TerrierF., CerretelliP. In vivo human gastrocnemius architecture with changing joint angle at rest and during graded isometric contraction // J. Physiol. 1996. - 496. - P. 287-297.
- Narici M.V., Capodaglio P. Changes in muscle size and architecture in disuse-atrophy. In: Muscle Atrophy: Disuse and Disease, (ed. Capodaglio P., Narici M.V.). Pavia, Italy: PI-ME Press. - 1998. - P. 55-63.
- Powell P., Roy R.R., Kamin P., Bello M.A., Edgerton V.R. Predictabiliry of skeletal muscle tension from architectural determinations in guinea pig hindlimbs. // J. Appl. Physiol. - 1984. - 57. - P. 1715-1721.
- Reeves N.D. Influence of simulated microgravity on human skeletal muscle architecture and function // J. Gravit. Physiol., - 2002. - 9. - P. P-153-P-154.
- SchwennickeA., BargfredeM., ReimersC.D. Clinical, electromyographic, and ultrasonographic assessment of focal neuropathies // J. Neuroimaging. -1998. - 8. - P. 136-143.
- SipiläS., SouminenH. Muscle ultrasonography and computed tomography in elderly trained and untrained women. // Muscle Nerve. - 1993. - 16. - P. 294-300.
- SpectorВ.А., GardinerР.F., ZernickeR.F., RoyR.R., EdgertonV.R. Muscle architecture and force-velocity characteristics of cat soleus and medial gastrocnemius: implications for motor control. // J. Neurophysiol. - 1980. - 44. - P. 951-960.
- SpoorC.W., vanLeewenJ.L., vanderMeulenW.J.T.M., HusonA. Active force-length relationship of human lowerleg muscles estimated from morphological data: a comparison of geometric muscles models. // Eur. J. Morphol. - 1991. - 20. - P. 137-160.
- Wickiewicz Т.L., Roy R.R., Powell Р.L., Edgerton V.R. Muscle architecture of the human lower limb. // Clin. Orthop. - 1983. - 179. - P. 275-283.
- YoungA., StokesM., RoundJ.M., EdwardsR.H.T. the effects of high-resistance training on the strength and cross-sectional area of the human quadriceps. // Eur. J. Clin. Invest. - 1983. - 13. P. 411-417.
[1]Ультразвуковое исследование выполнено М. Кузьминой, к.м.н., врач высшей категории



