Принцип рационального природопользования предусматривает минимизацию потребления свежей воды на технологические нужды за счет высокоэффективной очистки сточных вод и организации оборотного водоснабжения.
Машиностроительные и металлообрабатывающие производства являются значительными потребителями водных ресурсов, забирающими из водных источников около 12% свежей воды от общего расхода промышленностью страны. Около половины этого количества расходуется на нужды гальванического производства. Применяемые методы очистки сточных вод от ионов тяжелых металлов (Cd2+, Сo2+, Сu2+, Mn2+, Zn2+, Pb2+, Ni2+, Сr3+) свидетельствуют о серьезном загрязнении природной среды и расточительном отношении к ресурсам.
Наиболее распространен реагентный метод, основанный на переводе ионов тяжелых металлов в малорастворимые гидроксиды. В последние годы разработан и получает распространение сульфидный метод, предусматривающий осаждение тяжелых металлов в форме сульфидов. В патентной литературе имеются сведения об эффективности осаждения тяжелых металлов в виде фосфатов.
Целью настоящей работы является сравнение эффективности гидроксидного, сульфидного и фосфатного метода очисти сточных вод от ионов тяжелых металлов.
Остаточное содержание ионов тяжелых металлов в сточных водах после осаждения их в форме гидроксидов, сульфидов и фосфатов равно растворимости осадка над раствором. Расчет растворимости гидроксидов проведен с учетом образования гидроксокомплексов (на примере двухзарядных катионов)
![]()
![]()
![]()
![]()
Для фосфатов и сульфидов учитывались реакции гидролиза анионов:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
Константы равновесия соответствующих реакций и произведения растворимости (ПР) взяты по литературным данным.
Растворимость гидроксидов металлов (S) описывается уравнением:
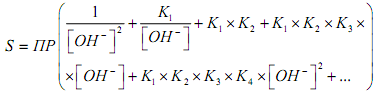
где К1, К2, ... - ступенчатые константы образования гидроксокомплексов.
Для растворимости фосфатов получено выражение
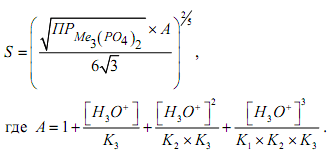
В этом выражении К1, К2, К3 - ступенчатые константы диссоциации фосфорной кислоты.
Растворимость сульфидов описывается уравнением:
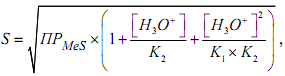 ,
,
где К1, К2 - ступенчатые константы диссоциации сероводорода.
Аналогичным образом получены соответствующие уравнения для растворимости солей трехзарядных катионов (Fe3+ , Сr3+).
Полученные значения S (моль/л) пересчитывались на содержание ионов данного металла в мг/л. Степень очистки сточных вод (СО) характеризовали степенью достижения требований ПДК для водоемов хозяйственно-питьевого водопользования (СОхпв) и рыбохозяйственного назначения (СОрхн) в соответствии с формулой
![]() .
.
При значениях СО≥100% очистка сточных вод до требований ПДК достигается, при СО<100% - нет.
Результаты расчетов представлены в табл.
Как следует из полученных данных, сульфидный метод обеспечивает очистку сточных вод в интервале рН, допустимого для сброса сточных вод во все водоемы (6,5-8,5) практически для всех металлов, кроме марганца.
Фосфатный метод обеспечивает аналогичную очистку сточных вод при рН≤8,5 для Pb2+, Fe3+ и Cr3+, а в более щелочных средах (при рН≤11) для Co2+, Cu2+ и Mn2+, причем только для водоемов хозяйственно-питьевого водопользования. При рН >11 дополнительно могут быть осаждены также ионы Ni2+, Zn2+ и Fe2+.
Таблица. Сопоставительный анализ реагентных методов
|
Ион металла |
Гидроксидный метод |
Фосфатный метод |
Сульфидный метод |
||||||
|
Интервал рН |
СОхпв, % |
СОрхн, % |
Интервал рН |
СОхпв, % |
СОрхн, % |
Интервал рН |
СОхпв, % |
СОрхн, % |
|
|
Cd2+ |
11-13 |
<1 |
<1 |
>11 |
1 |
5 |
6,5-8,5 |
>100 |
>100 |
|
Co2+ |
10-12 |
67 |
7 |
10-11 |
>100 |
14 |
6,5-8,5 |
>100 |
>100 |
|
Cu2+ |
8-12 |
>100 |
<1 |
7,5-8,5 |
>100 |
<1 |
6,5-8,5 |
>100 |
>100 |
|
Mn2+ |
11,2-12,5 |
100 |
10 |
9-10,5 |
>100 |
12 |
>11 |
100 |
<1 |
|
Ni2+ |
9,7-10,7 |
<1 |
<1 |
>11 |
100 |
10 |
7,0-8,5 |
>100 |
>100 |
|
Pb2+ |
10,5-11,5 |
<1 |
2 |
8-10 |
100 |
>100 |
6,5-8,5 |
>100 |
>100 |
|
Zn2+ |
9-11 |
33 |
<1 |
>11 |
100 |
1 |
6,5-8,5 |
>100 |
>100 |
|
Fe2+ |
10,5-11 |
>100 |
>100 |
>11 |
100 |
30 |
7,5-8,5 |
>100 |
>100 |
|
Fe3+ |
5,5-8,5 |
>100 |
>100 |
6,5-11 |
>>100 |
>>100 |
6,5-8,5 |
>100 |
>100 |
|
Cr3+ |
8,5-10 |
>100 |
>100 |
7,5-11 |
>100 |
>100 |
Переход в Cr(OH)3 |
||
Гидроксидный метод эффективен для удаления только ионов Fe3+, однако в более щелочных средах могут быть удалены Cu2+ (для водоемов хозяйственно-питьевого водопользования), Fe2+ и Cr3+.
Таким образом, наиболее эффективным методом является сульфидный; фосфатный метод может быть использован только для определенного состава сточных вод; гидроксидный метод, получивший наибольшее распространение, не обеспечивает необходимой степени очистки сточных вод.
Библиографическая ссылка
Красногорская Н.Н., Сапожникова Е.Н., Набиев А.Т., Головина А.В., Легушс Э.Ф., Пестриков С.В. ФИЗИКО-ХИМИЧЕСКОЕ СОПОСТАВЛЕНИЕ РЕАГЕНТНЫХ МЕТОДОВ ОЧИСТКИ СТОЧНЫХ ВОД ОТ ИОНОВ ТЯЖЕЛЫХ МЕТАЛЛОВ // Успехи современного естествознания. 2004. № 2. С. 114-115;URL: https://natural-sciences.ru/ru/article/view?id=12326 (дата обращения: 04.02.2026).



