Хроническая сердечная недостаточность (ХСН) является самым распространенным, тяжелым и прогностически неблагоприятным осложнением заболеваний сердечно-сосудистой системы. ХСН определяют как «патофизиологический синдром, при котором в результате того или иного заболевания сердечно-сосудистой системы происходит снижение насосной функции сердца, что приводит к дисбалансу между гемодинамической потребностью организма и возможностями сердца» [6]. Общепризнанными механизмами формирования ХСН в настоящее время считаются нарушение сократительной функции и ремоделирование миокарда [7, 9, 10]. В появлении и развитии симптомов ХСН важную роль играют активация симпатоадреналовой системы в сочетании с повышением активности ренин-ангиотензин-альдостероновой системы, приводящими к задержке воды и ионов натрия в клетках, вазоконстрикции и снижению сократительной функции левого желудочка [2]. Согласно современной нейрогуморальной модели патогенеза ХСН, ее развитие происходит по единым патофизиологическим законам вне зависимости от этиологии повреждения. Это увеличивает степень актуальности исследований, посвященных различным экспериментальным моделям ХСН.
В 90-x годах XX-го века доказана роль бета-1- и бета-2-адренорецепторов в патогенезе ХСН с участием внутриклеточного каскада Gs-белок/аденилатциклаза (AC)/цАМФ/протеинканаза А (PKA) [2]. Опубликован также ряд исследований [1, 3], подтверждающих возможное участие серотонина и ряда его рецепторов в патофизиологии ХСН. Известно, что серотониновые и адренергические рецепторы работают через сходные мембранные посредники. Однако, в зависимости от действующего фактора, каждый тип рецепторов может вносить свой вклад в развитие патологического процесса. В связи с этим исследования, посвященные моделям ХСН на лабораторных животных, представляются актуальными для развития стандартов лечения ХСН. Установлено, что наличие диастолической и систолической дисфункций у пациентов с ХСН зависит от увеличения концентрации серотонина в плазме крови и в тромбоцитах [9].
Инотропный эффект сердечной мышцы является одним из существенных параметров, изменяющихся при возникновении и развитии ХСН. Показано опосредованное 5HT4 рецепторами усиление инотропного эффекта на полосках миокарда пациентов, перенесших инфаркт, и у животных в различных моделях ХСН [3, 5] а также увеличение экспрессии 5НТ2b-рецепторов у мышей с экспериментальной гипертрофией левого желудочка [8].
Целью данного исследования явилось исследование экспериментальной модели ХСН, основанной на воздействии серотонина и катехоламинов на сердечно-сосудистую систему крысы, и исследование влияния агонистов серотониновых рецепторов на силу сокращения миокарда левого желудочка.
Материалы и методы исследования
Модель ХСН (опыт) создавалась ежедневным последовательным внутрибрюшинным введением растворов изопротеренола (неселективный агонист бета-1- и бета-2-адренорецепторов; Isoproterenol, Sigma) и флуоксетина (селективный ингибитор обратного захвата серотонина; Fluoxetine; Sigma) в дозах 30 мг/кг 10 взрослым крысам самцам линии Вистар в течение 7 дней. Контрольной группе животных (n = 10) в те же сроки вводился 0,9 % раствор NaCl.
Исследование сократимости миокарда проводили на установке Power Lab 4 AD Instruments Australia. Для этого у 10 наркотизированных уретаном (800 мг/кг) крыс препарировали сердце, вырезали полоски миокарда левого желудочка длиной 4–5 мм и диаметром 0,8–1 мм. Реакцию силы и амплитудно-временные характеристики сокращения полосок миокарда на серотонин, агонисты 5-HT2b рецепторов BW 723C86 гидрохлорид, (Tocris) и 5НТ4-рецепторов цизаприд (Tocris) оценивали в трех последовательно возрастающих концентрациях: 0,1 μМ, 1,0 μМ и 10,0 μМ.
Для морфологического подтверждения эффективности модели проводили гистологическое исследование препаратов левого желудочка. У 10 наркотизированных уретаном (800 мг/кг) крыс препарировали сердце, фиксировали в формалине и ряде спиртов, после чего проводили заливку материала в парафин. Срезы толщиной 3–5 нм изготавливали на микротоме MICROM400HE. Далее препараты окрашивали гематоксилином и эозином и по Ван Гизону. Морфологически наличие ХСН оценивали по следующим признакам: фиброз, инфильтрация, площадь поперечного сечения кардиомиоцитов. Интенсивность фиброза и инфильтрации определяли по трехбалльной шкале (0 – отсутствие, 1 – незначительный, 2 – умеренный, 3 – выраженный). Оценку площади поперечного сечения кардиомиоцитов проводили на установке Carl Zeiss Mirex с помощью программы Panoramic Viewer 1.15.
Для статистической обработки результатов исследования сократимости миокарда использовали t-критерий Стьюдента. Обработку результатов гистологического исследования проводили с использованием статистической системы R (R Development Core Team, 2011).
Результаты исследования и их обсуждение
В ответ на серотонин в концентрации 0,1 μМ/л миокард левого желудочка (ЛЖ) животных опытной группы увеличивает силу сокращения на 52 %, что не отличается от реакции миокарда желудочка у контрольной группы животных. При увеличении концентрации серотонина до 1 μМ сила сокращения левого желудочка животных опытной группы увеличивается только на 46 %, что значительно меньше, чем в контрольной группе (289 %), где сила сокращений увеличилась в 2,89 раз выше по сравнению с опытом. Серотонин в концентрации 10 μМ/л вызывает увеличение силы сокращений у опытных животных на 83 %, при этом в контрольной группе реакция в 2,14 раз выше, чем у опытной. Не установлена дозозависимость положительного инотропного действия серотонина на миокард ЛЖ у крыс модели ХСН. Таким образом, у крыс опытной группы положительный инотропный эффект существенно, в 2,5–6 раз, ниже по сравнению с контролем (рис. 1).
Ранее было показано, что влияние серотонина на сократимость миокарда может быть реализовано через серотониновые рецепторы 5HT2b и 5HT4 типов [8, 11]. В настоящем исследовании установлено, что агонист 5-HT2b рецептора BW 723C86 гидрохлорид в концентрации 0,1 μМ/л увеличивает силу сокращений левого желудочка опытных крыс на 55 %, что не отличается статистически значимо от реакции у контрольных животных. При увеличении концентрации агониста 5-HT2b до 1,0 μМ/л, реакция левого желудочка опытных животных увеличилась до 100 %, однако в сравнении с предыдущей концентрацией агониста, различия статистически незначимы. Увеличение концентрации агониста до 10,0 μМ/л вызвало повышение силы сокращения левого желудочка у опытных животных на 274 %. Однако разница в реакции по сравнению с предыдущей концентрацией агониста также не установлена (рис. 2).
Следует отметить, однако, что наблюдается тенденция к увеличению положительного инотропного действия агониста 5-HT2b рецепторов. Обращает на себя внимание отсутствие различий в реакции миокарда левого желудочка на агонист 5HT2b рецепторов между опытными и контрольными животными.
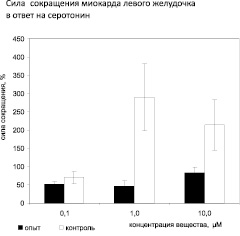
Рис. 1. Сила сокращения миокарда левого желудочка на серотонин. Примечание: Различия контрольной группы по отношению к опытной статистически достоверны: * – p < 0,05
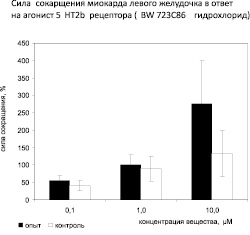
Рис. 2. Сила сокращения миокарда левого желудочка на агонист 5HT2b рецептора (BW 723C86 гидрохлорид). Примечание: Различия контрольной группыпо отношению к опытной статистически достоверны: * – p < 0,05
Ранее было показано участие 5HT2b рецепторов в формировании гипертрофии миокарда [8]. Представляется важной оценка вклада этого рецептора в регуляцию сократимости миокарда.
Согласно полученным в настоящем исследовании результатам, агонист 5HT2b рецептора оказывает положительный инотропный эффект на миокард левого желудочка крыс и этот эффект не изменяется у крыс модели ХСН в сравнении с контролем.
Реакция миокарда левого желудочка опытных животных на агонист 5HT4 рецептора цизаприд в концентрации 0,1 μМ/л составляет 55 %, что значительно меньше по сравнению с реакцией миокарда контрольных животных, составляющей 116 %. Увеличение концентрации агониста до 1,0 μМ/л не вызывает значимого изменения реакции левого желудочка, которая составляет 40 %. Однако у контрольных животных реакция заметно выше – 148 %. Максимальная концентрация цизаприда (10 μМ/л) увеличивает силу сокращения левого желудочка у опытных животных на 58 %, а у контрольных – на 150 % (р < 0,05). Следовательно, агонист 5HT4-рецепторов увеличивает силу сокращения миокарда левого желудочка у животных модели ХСН и в контроле. При этом отсутствует зависимость реакции сокращения от концентрации как у контрольных, так и у опытных животных (рис. 3).
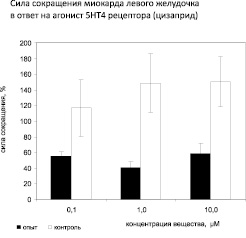
Рис. 3. Сила сокращения миокарда левого желудочка на агонист 5HT4 рецепторов (цизаприд). Примечание: Различия контрольной группы по отношению к опытной статистически достоверны: * – p < 0,05
Морфологические исследования показали, что на препаратах левого желудочка, окрашенных по Ван Гизону, у опытной группы животных наблюдаются выраженный фиброз, явления инфильтрации и увеличение площади поперечного сечения кардиомиоцитов, при отсутствии данных изменений в контрольной группе (рис. 4). Анализ результатов гистологического исследования демонстрирует статистически значимое преобладание фиброза у опытной группы животных (p < 0,05) (табл. 1). При этом инфильтрация наблюдалась существенно реже, чем фиброз (табл. 2).
Таблица 1
Фиброз миокарда левого желудочка у крыс с хронической сердечной недостаточностью, окрашенного по Ван Гизону
|
Фиброз, баллы |
Опыт |
Контроль |
p-level |
||
|
абс. данные (кол-во полей зрения) |
в % |
абс. данные (кол-во полей зрения) |
в % |
||
|
0 |
0 |
0 |
6279 |
98,6 |
0,001 |
|
1 |
5328 |
46,7 |
88 |
1,4 |
0,001 |
|
2 |
5128 |
44,9 |
0 |
0 |
- |
|
3 |
945 |
8,2 |
0 |
0 |
- |
Отношения шансов развития инфильтрации в опытной группе животных составили OR = 2,15 (95 %-й доверительный интервал 1,97–2,35; p < 0,0001). В связи с этим при оценке значений площади сечения кардиомиоцитов нами сравнивались логарифмы средних значения величин. По результатам регрессионного анализа, площадь сечения клеток животных опытной группы статистически значимо превышает таковую для контрольной группы (OR = 1,47; p-value = < 2e–16).
Таблица 2
Инфильтрация миокарда левого желудочка у крыс с хронической сердечной недостаточностью, окрашенного по Ван-Гизону
|
Инфильтрация, баллы |
Опыт |
Контроль |
p-level |
||
|
абс. данные (кол-во полей зрения) |
в % |
абс. данные (кол-во полей зрения) |
в % |
||
|
0 |
0 |
0 |
0 |
0 |
- |
|
1 |
1530 |
13,4 |
749 |
11,8 |
> 0,05 |
|
2 |
1017 |
8,9 |
0 |
0 |
0,001 |
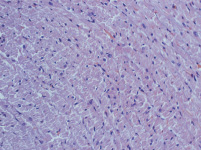
Миокард левого желудочка крысы контрольной группы
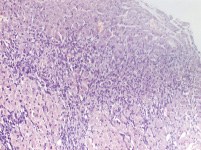
Миокард левого желудочка крысы опытной группы
Рис. 4. Фиброз миокарда левого желудочка окрашенного по Ван Гизону
Роль 5HT4 и 5HT2b серотониновых рецепторов в развитии ХСН и изменение инотропного эффекта сердечной мышцы у больных ХСН по сравнению со здоровыми в реакции в ответ на агонисты этих рецепторов и серотонин показана ранее [11]. Известно также, что большинство сердечных заболеваний сопровождается развитием фиброза в миокарде [12]. На использованной в настоящем исследовании изопротеренол-флуоксетиновой (ISO-FLU) модели ХСН были изучены морфофункциональные признаки данной патологии и вклада в ее развитие 5HT4 и 5HT2b рецепторов серотонина.
В настоящем исследовании показано, что серотонин в концентрации 0,1–1,0 μМ у крыс опытной группы увеличивает силу сокращений миокарда левого желудочка на 46–83 %, что значительно ниже по сравнению с реакцией на серотонин в миокарде контрольных животных. У опытных крыс положительный инотропный эффект существенно снижен в 2,5–6 раз, что соответствует опубликованным ранее данным о том, что ХСН характеризуется ослаблением инотропного эффекта сердечной мышцы [9].
Реакция сердечной мышцы на агонист 5HT2b рецепторов в зависимости от группы не меняется. Феномен требует дальнейшего изучения. 5-HT2b рецепторы характерны для гипертрофии миокарда, вызванной введением изопротеренола, что объясняется регулированием интерлейкина-6, интерлейкина-1-бета, фактором некроза опухоли альфа, которые являются продуктами фибробластов [8]. Ранее показанная роль 5-HT4 рецептора в формировании XСН [9] подтверждается результатами настоящего исследования, показавшими, что реакция мышцы на 5HT4 агонист в опыте, как и на серотонин, изменяется от 2,5 до 6 раз сильнее по сравнению с контролем.
Физиологическая функция сердечной мышцы и хроническая сердечная недостаточность контролируются взаимоотношением кардиомиоцитов, внеклеточного матрикса и его компонентов и в т.ч. фибробластов, которые, как принято считать, при помощи различных факторов роста и межклеточных взаимодействий с кардиомиоцитами напрямую нарушают работу сердца [4]. Гистологическое исследование позволило констатировать наличие выраженных морфологических изменений у крыс опытной группы. Это соответствует полученным ранее результатам о том, что стимуляция 5-HT2b рецепторов в фибробластах стимулирует выделение ими различных факторов роста и ведет к развитию гипертрофии миокарда [8].
Увеличение площади поперечного сечения кардиомиоцитов, явления инфильтрации, а также выраженный фиброз в сердечной мышце указывают на то, что гипертрофия миокарда в модели носит патологический характер, в противовес возможной физиологической гипертрофии [4]. Инфильтративные изменения в миокарде левого желудочка опытной группы указывает на наличие воспалительных процессов. Сочетание морфологических и функциональных признаков позволяет сделать вывод об эффективности используемой в настоящем исследовании модели ХСН.
Данное исследование свидетельствует о значительных изменениях в функционировании 5HT4 и 5HT2b рецепторов у крыс опытной группы. Таким образом, согласно данным, полученным ранее и в настоящем исследовании, можно предположить наличие связи между взаимодействием серотонина и серотониновых рецепторов, изменением морфологии кардиомиоцитов и функциональными изменениями рецепторов миокарда левого желудочка при ХСН.
Выводы
1. В миокарде левого желудочка крыс изопротеренол-флуоксетиновой модели ХСН выявлено преобладание признаков фиброза, инфильтрации и увеличение площади поперечного сечения.
2. У крыс в изопротеренол-флуоксетиновой модели ХСН снижается реакция силы сокращения миокарда на серотонин и агонист 5-НТ4 рецепторов.
Библиографическая ссылка
Мазитов Т.М., Нигматуллина Р.Р., Исламов Р.Р. МОРФОФУНКЦИОНАЛЬНЫЕ ПОКАЗАТЕЛИ ЛЕВОГО ЖЕЛУДОЧКА СЕРДЦА КРЫС В ИЗОПРОТЕРЕНОЛ-ФЛУОКСЕТИНОВОЙ МОДЕЛИ ХРОНИЧЕСКОЙ СЕРДЕЧНОЙ НЕДОСТАТОЧНОСТИ // Успехи современного естествознания. 2013. № 6. С. 44-49;URL: https://natural-sciences.ru/ru/article/view?id=32468 (дата обращения: 14.02.2026).



