Экономическая зона России Берингова моря многие десятилетия является одним из основных районов промысла отечественных рыбаков. В различные периоды суммарный российский вылов только донных рыб, в зависимости от величины их запасов и интенсивности промысла, составлял здесь более 100 тыс.т. в год [2, 6, 8].
В 1983 г. в Беринговом море в зоне России были организованы и начали проводиться донные траловые съемки, в основу которых был положен экосистемный подход [9, 10]. После длительного перерыва крупномасштабные комплексные исследования в Беринговом море ФГУП «ТИНРО-Центр», наряду со съемками в конце 1990–х – начале 2000 гг., продолжил в 2005, 2008, 2010 и 2012 гг.
Материалы и методы исследования
Учетные донные траловые съемки в экономической зоне России в северо-западной части Берингова моря проводились в 2005, 2008, 2010 и 2012 гг. на научно- исследовательских судах типа СТМ (средний траулер морозильщик) проекта 833 НИС «ТИНРО» и НИС «Профессор Кагановский» с экипажем на каждом судне в количестве 51-55 человек, включая научный состав 12-16 чел., в зависимости от объема работ научной экспедиции. Донные траловые съемки выполнялись по стандартной схеме траловых станций и методике [1,7]. Путь, пройденный судном с тралом от касания грунта до отрыва от него, определялся с помощью электронной картографической системы (ЭКС) «ТРАНЗАС». В процессе траления положение трала контролировалось прибором «Игла» (2005 и 2008 гг.), «Simbia 110-2» (2010 г.) и «SIMRAD FS 20/25» (2012 г.). Все съемки по времени охватывали летне-осенний период с июля по сентябрь-октябрь, но проводились они с некоторыми временными расхождениями (07.08-12.10.2005, 10.07–06.09.2008, 17.07–25.08.2010 и 08.07-26.08.2012 гг.). За рассматриваемые годы выполнено 817 донных тралений. Расчет численности и биомассы донных рыб проводился стандартным методом площадей и его модификаций [1] с использованием площадей многоугольников, соответствующих каждому тралению (ячейки Дирхле-Вороного или полигоны Тиссена). При этом, учитывались основные батиметрические диапазоны в градациях через 50 или 100 м. между изобатами в пределах шельфа и материкового склона на глубинах до 1000 м. Для каждого вида рассчитывалась средневзвешенная величина их уловов в штучном и весовом выражениях на1км2. Биологические анализы и массовые промеры рыб выполнялись по стандартным методам ихтиологических исследований.
Результаты исследования и их обсуждение
В экономической зоне России Берингова моря по последним уточненным данным в учетных траловых уловах в 2005-2012 гг. встречено 116 донных и придонных видов рыб из 19 семейств. Видовой состав в летне-осенний период в разные годы изменялся, что в значительной мере связано с редкими и малочисленными видами, которые в траловых уловах в районе работ встречаются не часто. Среди отмеченных в уловах таксономических групп наибольшим количеством видов в экономической зоне России Берингова моря обладают непромысловые рыбы – семейства: Cottidae (рогатковые) – 23 (19,8 % от всех встреченных в уловах), Zoarcidae (бельдюговые) – 16 (13,8 %), Liparidae (липаровые) – 8 (6,9 %) и Agonidae (морские лисички) – 11 (10,3 %). Достаточно широко представлено и семейство Pleuronectidae (камбаловые) – 14 (12,1 %) (табл. 1).
Таблица 1
Видовой состав уловов донной и придонной ихтиофауны в экономической зоне России Берингова моря в 2005-2012 гг.
|
Таксон |
Западно-Беринговоморская зона |
Олюторско-Наваринский район |
Анадырский залив |
Чукотская зона |
|
Rajidae |
9 |
9 |
3 |
1 |
|
Squialidae |
1 |
1 |
1 |
- |
|
Osmeridae |
1 |
1 |
1 |
- |
|
Moridae |
1 |
1 |
- |
- |
|
Gadidae* |
2 |
2 |
2 |
2 |
|
Macrouridae |
3 |
3 |
- |
- |
|
Sebastidae |
6 |
6 |
1 |
1 |
|
Anoplopomatidae |
1 |
1 |
- |
- |
|
Hexagrammidae |
2 |
2 |
1 |
- |
|
Cottidae |
23 |
21 |
20 |
14 |
|
Hemitripteridae |
3 |
3 |
3 |
2 |
|
Psychrolutidae |
4 |
4 |
3 |
- |
|
Agonidae |
11 |
11 |
9 |
7 |
|
Cyclopteridae |
3 |
3 |
3 |
3 |
|
Liparidae |
8 |
8 |
3 |
3 |
|
Bathymasteridae |
1 |
1 |
1 |
1 |
|
Zoarcidae |
16 |
12 |
7 |
7 |
|
Stichaeidae |
7 |
6 |
5 |
5 |
|
Pleuronectidae |
14 |
14 |
11 |
9 |
|
Всего |
116 |
109 |
74 |
55 |
Примечание.* Gadidae без минтая.
Относительно высоким количеством видов выделялись еще три таксономические группы – Stichaeidae (стихеевые) – 7 (6,0 %), Rajidae (скаты) – 9 (7,8 %) и Sebastidae (морские окуни) – 6 (5,2 %) видов. Остальные же семейства в уловах были представлены не более 3-4 видами донных рыб [2, 4, 5].
Биомасса донных и придонных рыб в экономической зоне России Берингова моря в течение всех рассматриваемых лет находится на довольно высоком уровне. При этом отчетливо прослеживаются разнонаправленные тенденции в ее межгодовой динамике. В разных частях Берингова моря в зоне России такая разнонаправленность происходит не всегда синхронно. Так, у рогатковых и бельдюговых сохраняется тенденция снижения запасов, независимо от межгодовых особенностей условий среды и сроков траловых съемок. Биомасса скатовых после минимальных оценок в 2010 г. вновь резко возросла. Только у камбаловых (Pleuronectidae) и тресковых (Gadidae) биомассы неизменно были высокими, что позволило им сохранять доминирующее положение в донном ихтиоцене (табл. 2).
Таблица 2
Состав ( %) и биомасса (тыс.т) донных рыб в экономической зоне России Берингова моря в 2005-2012 гг.
|
Таксон |
Годы наблюдений |
|||||||
|
2005.07.08-12.10 |
2008.17.07-25.08 |
2010.10.07-01.09 |
2012.08.07-26.08 |
|||||
|
тыс. т |
% |
тыс. т |
% |
тыс. т |
% |
тыс. т |
% |
|
|
Dalatidae |
26,3 |
2,6 |
8,4 |
0,8 |
7,7 |
0,8 |
21,9 |
2,0 |
|
Rajidae |
79,8 |
7,8 |
66,3 |
5,8 |
47,0 |
4,7 |
96,4 |
8,7 |
|
Macrouridae |
107,7 |
10,5 |
158,3 |
13,9 |
146,2 |
14,5 |
133,0 |
12,2 |
|
Gadidae* |
205,3 |
20,0 |
329,9 |
29,0 |
399,2 |
39,7 |
312,3 |
28,6 |
|
Scorpaenidae |
1,4 |
0,1 |
3,8 |
0,4 |
1,7 |
0,2 |
3,1 |
0,3 |
|
Cottidae |
193,9 |
18,9 |
157,2 |
13,8 |
90,2 |
9,0 |
96,9 |
8,9 |
|
Psychrolutidae |
7,5 |
0,8 |
8,3 |
0,7 |
6,1 |
0,5 |
10,8 |
1,0 |
|
Liparidae |
7,8 |
0,9 |
10,6 |
0,9 |
5,1 |
0,5 |
7,7 |
0,7 |
|
Zoarcidae |
66,9 |
6,5 |
44,3 |
3,9 |
25,4 |
2,5 |
34,2 |
3,1 |
|
Pleuronectidae |
312,5 |
30,5 |
334,9 |
29,4 |
264,2 |
26,3 |
356,8 |
32,7 |
|
Прочие |
14,8 |
1,4 |
15.5 |
1,4 |
12,6 |
1,3 |
19,4 |
1,8 |
|
Всего, тыс. т. |
1023,9 |
100 |
1137,9 |
100 |
1005,4 |
100 |
1092,5 |
100 |
|
Кол-во трал. |
206 |
194 |
212 |
205 |
||||
|
Площадь, км² |
144066 |
145659 |
149304 |
141930 |
||||
|
Биомасса, т/км² |
7,3 |
7,8 |
5,8 |
7,7 |
||||
Примечание.* Gadidae без минтая.
Но, если у камбаловых биомасса семейства обеспечивалась группой видов, то в семействе тресковых основу составлял только один вид – треска Gadus macrocephalus.
Тенденции изменения биомассы рыб различных семейств, характерные для всей экономической зоны России в северо-западной части Берингова моря в целом, не проявлялись синхронно по отдельным районам.
Так, в Олюторско-Наваринском районе в 2005-2012 гг. прослеживается устойчивый прирост биомассы донных и придонных видов рыб, что подтверждается и относительными оценками обилия [7]. Основу биомассы сообщества донных рыб (более 80 %) в течение всего периода исследований здесь составляли четыре семейства – тресковые, камбаловые, макрурусовые (Macrouridae) и рогатковые. При этом межгодовая динамика их запасов имеет разные тенденции, что приводит к изменениям в структуре донного ихтиоцена. У тресковых, несмотря на более низкие оценки запасов в 2012 г. (152,9 тыс. т) по сравнению с 2010 г. (198,8 тыс. т), в течение всего периода наблюдений прослеживался общий положительный тренд. Это не в последнюю очередь связано с интенсивностью летних миграций трески в северном направлении и ее перераспределением между корякским шельфом (Олюторско-Наваринский район) и Анадырским заливом. Аналогичные изменения запасов отмечены и у камбаловых, общий прирост биомассы которых в 2012 г. был обеспечен увеличением численности нескольких видов этого семейства (табл. 3).
Таблица 3
Состав ( %) и биомасса (тыс. т) массовых видов камбал в Олюторско-Наваринском районе в 2005-2012 гг.
|
Виды |
2005 |
2008 |
2010 |
2012 |
||||
|
тыс. т |
% |
тыс. т |
% |
тыс. т |
% |
тыс. т |
% |
|
|
Atheresthes evermanni |
6,6 |
6,6 |
23,8 |
18,8 |
13,9 |
15,6 |
15,3 |
10,3 |
|
Atheresthes stomias |
41,1 |
40,8 |
47,3 |
37,4 |
36,7 |
41,2 |
26,7 |
17,9 |
|
Hippoglossoides spp. |
20,8 |
20,7 |
7,7 |
6,1 |
8,4 |
9,4 |
11,5 |
7,7 |
|
Hippoglossus stenolepis |
2,5 |
2,5 |
9,5 |
7,5 |
5,0 |
5,6 |
26,4 |
17,7 |
|
Glyptocephalus zachirus |
0,1 |
0,1 |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
0,1 |
|
Lepidopsetta polyxystra |
10,2 |
10,1 |
11,0 |
8,7 |
5,9 |
6,6 |
29,2 |
19,6 |
|
Limanda aspera |
1,4 |
1,4 |
0,6 |
0,5 |
0,5 |
0,6 |
4,2 |
2,8 |
|
Limanda sakhalinensis |
1,3 |
1,3 |
0,4 |
0,3 |
0,1 |
0,2 |
0,2 |
0,2 |
|
Myzopsetta proboscidea |
0,6 |
0,6 |
0,2 |
0,2 |
0,0 |
0,0 |
0,4 |
0,3 |
|
Pleuronectes quadrituberculatus |
8,5 |
8,4 |
12,2 |
9,6 |
4,5 |
5,0 |
11,9 |
8,0 |
|
Reinhardtius hippoglossoides |
7,6 |
7,5 |
13,5 |
10,7 |
13,9 |
15,6 |
22,9 |
15,4 |
|
Всего камбаловых |
100,7 |
100 |
126,4 |
100 |
89,1 |
100 |
148,9 |
100 |
Из камбаловых следует отметить изменение биомассы ценных в промысловом отношении представителей семейства – белокорого Hippoglossus stenolepis, черного Reinhardtius hippoglossoides палтусов и двухлинейной камбалы. Lepidopsetta polyxystra. Значительный прирост биомассы этих видов в 2012 г. произошел на фоне снижениия численности азиатского Atheresthes evermanni и американского Atheresthes stomias стрелозубых палтусов, доминировавших в уловах по результатам предыдущих исследований [3, 5, 8]. Сокращение биомассы рогатковых явилось следствием снижения запасов многоиглого керчака Myoxocephalus polyacanthocephalus. Что касается бельдюговых, то у этого семейства после двукратного снижения биомассы к 2008 г., в дальнейшем произошла стабилизация ее на низком уровне.. Но, несмотря на отмеченные изменения в биомассах, кардинальных перестроек в структуре донного ихтиоцена не произошло. В течение всего рассматриваемого периода в сообществе донных рыб преобладали семейства, представители которых имеют промысловую значимость (тресковые, камбаловые и макрурусовые). Изменялось лишь положение этих трех групп среди доминантов, на долю которых приходилось более 60 % учтенной биомассы. Среди макрурусов абсолютно преобладал малоглазый макрурус Albatrossia pectoralis (76,7-94,3 % биомассы семейства), который образует плотные скопления на материковом склоне (глубины более 500 м). У второго представителя семейства – пепельного макруруса Coryphaenoides cinereus несмотря на многочисленность, вследствие его небольших размеров, биомасса обычно не превышала 10 тыс. т в год (за исключением 2010 и 2012 гг.). В семействе тресковых в течение всех рассматриваемых лет преобладала треска (72-100 % биомассы семейства), встречающаяся в пределах шельфа в широком диапазоне глубин. Второй вид семейства, представитель сублиторального комплекса – навага только в 2005 г. имела высокую биомассу (28,1 % семейства). У камбаловых, в отличие от тресковых и макрурусовых, основа биомассы формировалась за счет нескольких массовых видов Из десятка видов, более трети учтенной биомассы приходилось на долю американского стрелозубого палтуса Atheresthes stomias, образующего наиболее плотные скопления на внешнем крае шельфа и в верхнем отделе материкового склона (глубины от 300 до 400 м). Всего же стрелозубые палтусы в 2005-2010 гг. составляли до 50 % и более биомассы камбаловых и только в 2012 г. было отмечено снижение биомассы (28,2 %) в связи с миграциями их в западную часть Берингова моря.
Суммарная биомасса камбаловых в рассматриваемые годы практически всегда превышала 100 тыс. т и варьировала синхронно с межгодовыми изменениями обилия стрелозубых палтусов. Так, в 2005 и 2008 гг. в сообществе донных рыб камбаловые преобладали над тресковыми, но в 2010 и 2012 гг. они значительно уступали им. У остальных массовых видов семейства изменения биомассы имели разнонаправленные тенденции или их тренд был нечетко выражен. После 2005 г. у двух наиболее массовых видов – палтусовидной Hippoglossoides spp. и двухлинейной Lepidopsetta polyxstra камбал произошло снижение запасов. Но, если у двухлинейной камбалы в 2012 г. отмечен прирост запасов, превысивший уровень их в 2005 г., что, вероятно, связано с задержкой ее выхода в мелководные районы территориальных вод России, то у палтусовидной они остались низкими. Смещение скоплений двухлинейной камбалы на большие глубины, судя по данным за июль 2012 г., обусловлено низким температурным фоном в пределах внутреннего шельфа. Величина отрицательных температурных аномалий в придонном слое возрастала на малых глубинах, что может быть следствием наличия здесь шельфовых водных масс остаточного зимнего охлаждения.
У более глубоководной желтобрюхой камбалы Pleuronectes quadrituberculatus в 2008 г. отмечен прирост биомассы, который сохранился и в 2012 г. Практически аналогичные изменения характерны для ценных в промысловом отношении представителей семейства – белокорого и черного палтусов. Значительный прирост биомассы этих видов в 2012 г. был вызван снижением численности азиатского и американского стрелозубых палтусов, преобладавших в составе семейства в 2005-2010 гг.
Для рогатковых, также входящих в список доминирующих видов в донном ихтиоцене, по результатам исследований в указанные годы ситуацию можно оценить как менее стабильную. Если в 2005 г они являлись третьей по значимости группой в составе донного сообщества (21,1 %), то в последующем сместились на четвертую позицию, а их доля снизилась до 10,5 % (2012 г.). Основу биомассы этой группы (более 60 %) составляли два наиболее массовых вида, населяющих элиторальную зону – многоиглый керчак Myoxocephalus polyacanthocephalus и белобрюхий получешуйник Hemilepidotus jordani (табл. 4).
Таблица 4
Состав ( %) и биомасса (тыс.т) массовых видов рогатковых в Олюторско-Наваринском районе в 2005-2012 гг.
|
Виды |
2005 |
2008 |
2010 |
2012 |
||||
|
тыс. т |
% |
тыс. т |
% |
тыс. т |
% |
тыс. т |
% |
|
|
Gymnacanthus detrisus |
1,2 |
1,2 |
2,0 |
2,1 |
1,6 |
2,3 |
2,4 |
3,8 |
|
Gymnacanthus galeatus |
14,3 |
14,4 |
9,9 |
10,2 |
1,9 |
2,7 |
7,4 |
11,7 |
|
Hemilepidotus gilberti |
0,1 |
0,1 |
0,8 |
0,8 |
0,4 |
0,6 |
0,3 |
0,5 |
|
Hemilepidotus jordani |
31,4 |
31,7 |
16,3 |
16,9 |
11,6 |
16,3 |
14,7 |
23,2 |
|
Melletes papillio |
6,9 |
7,0 |
0,3 |
0,3 |
0,1 |
0,1 |
0,2 |
0,3 |
|
Myoxocephalus polyacanthocephalus |
36,8 |
37,1 |
43,5 |
45,0 |
46,9 |
66,1 |
27,2 |
42,9 |
|
Myoxocephalus verrucosus |
3,9 |
3,9 |
2,6 |
2,7 |
0,2 |
0,3 |
1,5 |
2,4 |
|
Icelus spiniger |
1,3 |
1,3 |
0,9 |
0,9 |
1,0 |
1,4 |
0,5 |
0,8 |
|
Triglops pingeli |
0,3 |
0,3 |
2,4 |
2,5 |
2,1 |
3,0 |
0,6 |
0,9 |
|
Другие рогатковые |
2,9 |
3,0 |
18,0 |
18,6 |
5,2 |
7,2 |
8,6 |
13,5 |
|
Всего рогатковых |
99,1 |
100 |
96,7 |
100 |
71,0 |
100 |
63,4 |
100 |
Биомасса первого вида до 2010 г. имела стабильную тенденцию роста, компенсируя сокращение численности менее значимых видов, но в 2012 г. произошло значительное ее снижение. У белобрюхого получешуйника в течение всего периода наблюдений, несмотря на межгодовые изменения, прослеживался общий тренд снижения биомассы. Аналогичные тенденции наблюдались у бородавчатого керчака Myoxocephalus verrucosus и еще двух широко распространенных видов – беринговоморского шлемоносца Gymnacanthus galeatus и бычка-бабочки Melletes papillio. При этом биомасса типичного представителя сублиторали бычка-бабочки в последние три года остается стабильно низкой. У представителей элиторали беринговоморского шлемоносца и бородавчатого керчака в летний период в мелководных районах тенденция снижения биомассы имеет устойчивый характер.
В семействе рогатковых в Олюторско-Наваринском районе в 2008 и 2010 гг. снижение биомассы шлемоносных, получешуйниковых бычков и бородавчатого керчака, составлявших основу биомассы семейства, восполнилось увеличением запасов многоиглого керчака. В 2012 г. общее снижение биомассы семейства было обусловлено сокращением запасов последнего вида. У массовых мелкоразмерных групп бычков родов Icelus и Triglops каких-либо выраженных трендов изменения биомассы не наблюдалось. Подобные изменения биомассы были присущи в эти годы различным представителям семейств бельдюговых и скатов, широко распространенных в Олюторско-Наваринском районе (табл. 5).
Таблица 5
Состав ( %) и биомасса (тыс.т) массовых видов бельдюговых и скатовых в Олюторско-Наваринском районе в 2005-2012 гг.
|
Виды |
2005 |
2008 |
2010 |
2012 |
||||
|
тыс. т |
% |
тыс. т |
% |
тыс. т |
% |
тыс. т |
% |
|
|
Bathyraja aleutica |
6,65 |
22,01 |
6,07 |
20,31 |
7,33 |
31,71 |
9,2 |
22,81 |
|
Bathyraja parmifera |
19,71 |
65,31 |
17,75 |
59,41 |
6,10 |
26,41 |
20,7 |
51,21 |
|
Bathyraja violacea |
2,62 |
8,71 |
3,03 |
10,11 |
6,80 |
29,41 |
4,5 |
11,11 |
|
Другие скаты |
1,22 |
4,0 |
3,05 |
10,2 |
2,9 |
12,5 |
6,0 |
14,3 |
|
Всего скатов |
30,2 |
100 |
29,9 |
100 |
23,1 |
100 |
40,4 |
100 |
|
Lycodes brevipes |
15,57 |
74,52 |
7,77 |
69,82 |
4,29 |
44,72 |
4,3 |
42,22 |
|
Lycodes diapterus |
1,06 |
5,12 |
0,26 |
2,32 |
- |
- |
1,4 |
13,72 |
|
Lycodes palearis |
2,57 |
12,32 |
1,59 |
14,32 |
1,85 |
19,32 |
1,6 |
15,72 |
|
Другие ликоды |
1,7 |
8,1 |
1,55 |
13,6 |
3,46 |
36,0 |
2,9 |
28,4 |
|
Всего ликодов |
20,9 |
100 |
11,1 |
100 |
9,6 |
100 |
10,2 |
100 |
1 – от суммарной скатов, 2 – от суммарной зоорцид.
В 2012 г. для скатов отмечено почти двукратное увеличение запасов. Более 50 % учтенной биомассы пришлось на долю щитоносного ската Bathyraja parmifera. Биомасса бельдюговых после двукратного снижения к 2008 г. стабилизировалась на низком уровне, а основу ее составлял коротконогий ликод Lycodes brevipes (42,2-74,5 %).
На основании вышеизложенного следует сказать, что у доминирующих в составе донного ихтиоцена таксономических групп и видов, в межгодовой динамике прослеживались противоположные тенденции. Если у рогатковых и бельдюговых отмечался устойчивый тренд снижения запасов, а у тресковых и камбаловых прослеживалась тенденция роста, то у скатовых и макрурусовых четко выраженных тенденций по Олюторско-Наваринскому району в целом не проявлялось, несмотря на значительные колебания их обилия. Тем не менее, при раздельном анализе ихтиоцена на шельфе и материковом склоне изменения, происходящие в сообществе донных рыб, прослеживаются более контрастно и часто имеют противоположные тенденции, чем в целом по всему району исследований.
В пределах шельфа (до глубины 200 м) в течение всего рассматриваемого периода исследований отмечен рост биомассы донных рыб с 276,0 тыс. т (2005 г.) до 330,9 тыс. т (2012 г.). Этот прирост не был обеспечен синхронным увеличением запасов всех групп придонной ихтиофауны и происходил на фоне изменений структуры донного ихтиоцена. В пределах шельфа Олюторско-Наваринского района основу сообщества донных рыб составляли рогатковые, камбаловые и тресковые, но взаимное положение этих групп менялось. Произошло сокращение биомассы рогатковых и снижение их доли в составе донного ихтиоцена (с 35,7 до 18,1 %), что привело к утрате ими статуса доминирующей группы. Практически такие же изменения в уровне запасов были характерны скатовым и бельдюговым. У камбаловых, несмотря на разнонаправленные изменения численности отдельных массовых видов семейства, изменения их положения в донном ихтиоцене не произошло (рис. 1),. Незначительное снижение на шельфе отмечено и у трески, тем не менее, она осталась преобладающим видом сообщества донных рыб, в результате чего тресковые (43,8 %) сохранили доминирующее положение. У тресковых, несмотря на более низкие оценки запасов в 2012 г. (152,9 тыс. т) по сравнению с 2010 г. (198,8 тыс. т), в течение всего периода наблюдений прослеживался положительный тренд изменения биомассы. Это не в последнюю очередь связано с интенсивностью летних миграций трески в северном направлении и ее перераспределением между корякским шельфом и Анадырским заливом. В течение трех лет наблюдений (2005 г. –55,98 млн экз., 2008 г. – 95,8 млн. экз. и 2010 г. – 128,7 млн экз.) миграционная активность трески в пределы корякского шельфа нарастала. Соответственно, в Олюторско-Наваринском районе произошел прирост биомассы вида, что в 2008 г. отчасти было обеспечено и появлением урожайного поколения, которое на размерном полигоне проявилось пиком (20-32 см, с модальной группой 29-30 см) и хорошо прослеживалось в последующие годы (рис. 2). В результате, к 2012 г. в условиях снижения миграционной активности при практически полном отсутствии рекрутов, произошло сокращение численности и биомассы трески (69,61 млн. экз. или 152,9 тыс. т). Снижение биомассы трески к 2012 г. было компенсировано приростом биомассы двухлинейной камбалы и белокорого палтуса, в результате чего камбаловые (24,3 %) стали субдоминирующим семейством на корякском шельфе (Олюторско-Наваринский район).
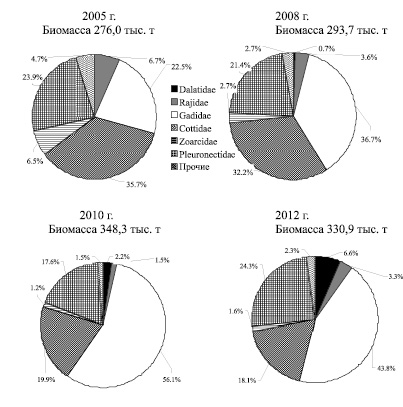
Рис. 1. Состав донных ихтиоценов на шельфе Олюторско-Наваринского района на глубинах 20-200 м в 2005 – 2012 гг.
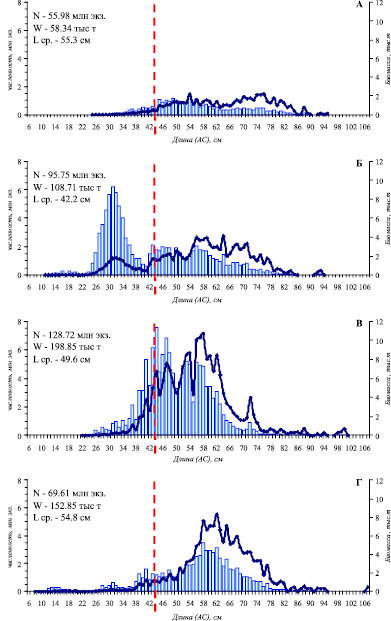
Рис. 2. Распределение трески по длине (столбики) и массе (изогнутая линия) в Олюторско-Наваринском районе по результатам донных траловых съемок в 2005 (А), 2008 (Б), 2010 (В) и 2012 (Г) гг. Пунктирная линия – промысловая мера
На материковом склоне биомасса донных и придонных видов рыб после сокращения запасов в 2010 г. (218,6 тыс. т), в 2012 г. (269,7 тыс. т) вернулась к величине биомассы в 2008 г. (265,6 тыс. т). Несомненно, в первую очередь это обеспечивалось относительно стабильным уровнем запасов макрурусовых (158-133 тыс. т), несмотря на наметившуюся тенденцию снижения биомассы малоглазого макруруса. Как и на шельфе, уменьшение биомассы макрурусовых на материковом склоне, компенсировалось приростом биомассы камбаловых (25,4 %) и скатовых (10,9 %), что повысило статус этих семейств в структуре ихтиоцена материкового склона (рис. 3).
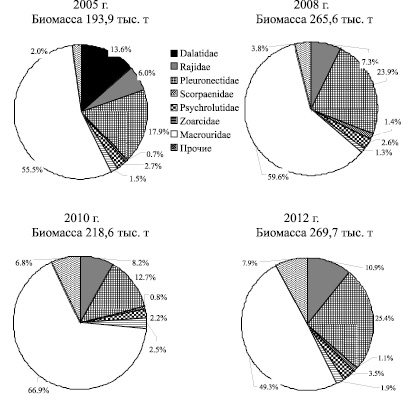
Рис. 3. Состав донного ихтиоцена на материковом склоне Олюторско-Наваринского района на глубинах 201-750 м в 2005 – 2012 гг.
Рост биомассы белокорого и черного палтусов происходил на фоне снижения ее у обоих видов стрелозубых палтусов. Биомасса семейства скатовых возросла в основном за счет роста биомассы крупноразмерных представителей семейства – щитоносного и алеутского Bathyraja aleutic скатов.
В донном ихтиоцене Анадырского залива рост биомассы трески стал наиболее значимым изменением [7]. Даже в условиях снижения интенсивности ее миграций в северо-западную часть моря в 2012 г., биомасса трески была достаточно высокой (159,0 тыс. т), что явилось следствием высокой численности трески (2005 г. – 93,9, 2008 г. – 89,16, 2010 г. – 78,4 и 2012 г. – 73,98 млн. экз.). Численность пополнения трески младших размерных групп в 2005, 2008 гг. длиной 24-36 см и в 2010 г. длиной 28-40 см составляла значительную долю общей численности трески. В 2012 г. из-за слабого пополнения молодью и снижения численности крупной половозрелой трески общая численность трески заметно снизилась. Уменьшение численности трески длиной 38-52 см явно проявилось в 2008 г., после появления урожайного поколения 2003 г.рождения. Последующие новые генерации, судя по изменениям размерного состава (длины и массы), являются менее многочисленными. Это отразилось и на общей численности трески в 2010 и 2012 гг. (рис. 4).
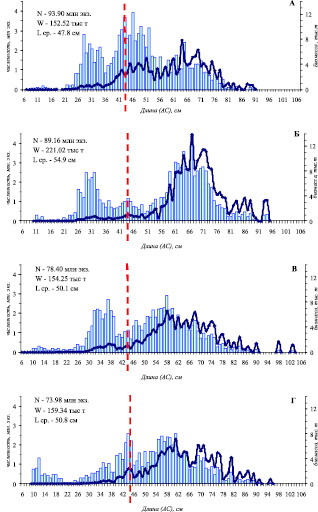
Рис. 4. Распределение трески по длине (столбики) и массе (изогнутая линия) в Анадырском заливе по результатам донных траловых съемок в 2005 (А), 2008 (Б), 2010 (В) и 2012 (Г) гг. Пунктирная линия – промысловая мера
В Анадырском заливе семейство камбаловых, несмотря на резкое сокращение запасов трех наиболее массовых видов, по-прежнему, остается доминирующей группой (7). Так, биомасса северной палтусовидной камбалы сократилась почти в два раза с 81,3 (2005 г.) до 58,0 тыс. т (2012 г.) и более, чем на порядок снизились биомассы американского (33,8 и 2,1 тыс. т) и азиатского (9,2 и 1,8 тыс. т соответсвенно) стрелозубых палтусов. Эти снижения были полностью компенсированы приростом биомассы желтобрюхой камбалы Pleuronectes quadrituberculatus (с 35,3 до 99,8 тыс. т), встречающейся практически во всей центральной части Анадырского залива. Следует отметить продолжение, отмеченного еще в 2010 г., роста запасов черного (2008 г. – 11,4 тыс. т, 2010 г. – 13,1 тыс. т и 2012 г. – 17,9 тыс. т) и белокорого (4,9, 5,1 и 7,6 тыс. т соответственно) палтусов.
В условиях неравномерного снижения биомассы разных видов и групп, соответственно, и в структуре донного ихтиоцена в Анадырском заливе происходили постоянные изменения. В его составе поочередно доминировали тресковые и камбаловые. Если у первых, как отмечалось, семейство было представлено одним видом, преобладающим в ихтиоцене на глубинах менее 100 м, то у вторых несколькими. Состав видов семейства, формирующих основу биомассы, изменялся. Палтусовидная камбала Hippoglossoides spp, стабильно доминирующая среди остальных видов семейства камбаловых в 2005 г.(36,6 %), 2008 (22,9 %) и 2010 гг. (22,9 %), в 2012 г. уступила желтобрюхой камбале Pleuronectes quadrituberculatus (16.7, 27.2, 22.0 и 48,0 % соответственно) (табл. 6). Изменения биомассы палтусовидной камбалы в эти годы происходили на фоне снижения, а желтобрюхой – повышения биомассы семейства. У еще одного значимого вида семейства – двухлинейной камбалы высокая биомасса отмечена только в 2005 г. (31,8 тыс. т), а в последующие годы запасы ее постепенно снижались. Как и в Олюторско-Наваринском районе, здесь было отмечено снижение запасов стрелозубых палтусов. В 2012 г. произошло трехкратное снижение их биомассы.
Таблица 6
Состав ( %) и биомасса (тыс. т) массовых видов камбаловых в Анадырском заливе в 2005-2012 гг.
|
Виды |
2005 |
2008 |
2010 |
2012 |
||||
|
тыс. т |
% |
тыс. т |
% |
тыс. т |
% |
тыс. т |
% |
|
|
Atheresthes evermanni |
9,2 |
4,3 |
24,3 |
11,7 |
25,2 |
17,0 |
8,8 |
4,2 |
|
Atheresthes stomias |
33,8 |
16,0 |
12,0 |
5,8 |
30,5 |
20,6 |
10,4 |
5,0 |
|
Hippoglossoides spp. |
81,3 |
38,4 |
72,9 |
35,0 |
33,9 |
22,9 |
58,0 |
27,9 |
|
Hippoglossus stenolepis |
0,2 |
0,1 |
4,9 |
2,4 |
5,1 |
3,4 |
7,6 |
3,7 |
|
Lepidopsetta polyxystra |
31,8 |
15,0 |
24,2 |
11,6 |
6,5 |
4,4 |
4,3 |
2,1 |
|
Pleuronectes quadrituberculatus |
35,3 |
16,7 |
56,8 |
27,2 |
32,5 |
22,0 |
99,8 |
48,0 |
|
Reinhardtius hippoglossoides |
15,9 |
7,5 |
11,4 |
5,5 |
13,1 |
8,9 |
17,9 |
8,6 |
|
Другие камбаловые |
4,2 |
2,0 |
2,0 |
0,8 |
1,1 |
0,8 |
1,2 |
0,5 |
|
Всего камбаловых |
211,7 |
100 |
208,5 |
100 |
147,9 |
100 |
208,0 |
100 |
Состояние запасов других видов палтусов (белокорого и черного) в северо-западной части Берингова моря в последние годы можно характеризовать как стабильное, причем, у обоих видов отмечен устойчивый рост их.
Наиболее резкое, почти трехкратное произошло снижение запасов рогатковых (табл. 7).
Таблица 7
Состав ( %) и биомасса (тыс.т) массовых видов рогатковых в Анадырском заливе в 2005-2012 гг.
|
Виды |
2005 |
2008 |
2010 |
2012 |
||||
|
тыс. т |
% |
тыс. т |
% |
тыс. т |
% |
тыс. т |
% |
|
|
Gymnacanthus detrisus |
1,0 |
1,1 |
0,0 |
0,0 |
0,1 |
0,7 |
0,3 |
0,9 |
|
Gymnacanthus galeatus |
0,1 |
0,1 |
0,1 |
0,2 |
0,1 |
0,7 |
0,3 |
0,9 |
|
Melletes papillio |
24,2 |
25,5 |
1,0 |
1,7 |
0,1 |
0,7 |
1,7 |
5,1 |
|
Myoxocephalus polyacanthocephalus |
26,7 |
28,2 |
50,3 |
83,0 |
12,5 |
82,2 |
24,2 |
72,2 |
|
Myoxocephalus verrucosus |
39,2 |
41,4 |
5,9 |
9,8 |
0,7 |
4,6 |
3,7 |
11,0 |
|
Icelus spiniger |
1,5 |
1,6 |
1,5 |
2,5 |
0,7 |
4,6 |
0,8 |
2,4 |
|
Triglops pingeli |
0,5 |
0,5 |
0,5 |
0,8 |
0,1 |
0,7 |
1,0 |
3,0 |
|
Другие рогатковые |
1,6 |
1,6 |
1,2 |
2,0 |
0,9 |
5,8 |
1,5 |
4,5 |
|
Всего рогатковых |
94,8 |
100 |
60,5 |
100 |
15,2 |
100 |
33,5 |
100 |
Только у многоиглого керчака, формирующего основу биомассы семейства (72,2-81,6 %), биомасса сохранилась на уровне 2005 г., а у остальных массовых видов семейства произошло снижение ее. Подобные изменения отмечены и для бельдюговых, у которых выделялись коротконогий Lycodes brevipes и гребенчатый Lycodes palearis ликоды. У скатов, биомасса которых после двукратного снижения в 2010 г. (21,4 тыс. т), снова резко возросла в 2012 г. (55,9 тыс. т), из которых наиболее многочисленным является щитоносный скат Bathyraja parmifera (табл. 8).
Таблица 8
Состав (%) и биомасса (тыс. т) массовых видов скатов и бельдюговых в Анадырском заливе в 2005-2012 гг.
|
Виды |
2005 |
2008 |
2010 |
2012 |
||||
|
тыс. т |
% |
тыс. т |
% |
тыс. т |
% |
тыс. т |
% |
|
|
Bathyraja parmifera |
48,3 |
97,4 |
35,3 |
97,3 |
13,0 |
60,7 |
54,3 |
97,1 |
|
Bathyraja violacea |
1,3 |
2,6 |
1,0 |
2,7 |
1,8 |
8,4 |
0,9 |
1,6 |
|
Другие скатовые |
0,0 |
0,0 |
0,0 |
0,0 |
6,6 |
30,9 |
0,7 |
1,3 |
|
Всего скатовых |
49,6 |
100 |
36,3 |
100 |
21,4 |
100 |
55,9 |
100 |
|
Lycodes brevipes |
21,4 |
46,6 |
13,6 |
41,1 |
5,0 |
43,5 |
8,7 |
36,3 |
|
Lycodes palearis |
11,7 |
25,5 |
13,7 |
41,4 |
2,6 |
23,5 |
10,2 |
42,5 |
|
Lycodes raridens |
12,4 |
27,0 |
5,7 |
17,2 |
0,4 |
4,3 |
5,1 |
21,3 |
|
Lycodes polaris |
0.0 |
0,0 |
0,05 |
0,2 |
3,4 |
29,6 |
0,01 |
+ |
|
Другие бельдюговые |
0,4 |
0,9 |
0,05 |
0,1 |
0,0 |
0,0 |
0,0 |
0,0 |
|
Все бельдюговые |
45,9 |
100 |
33,1 |
100 |
11,5 |
100 |
24,0 |
100 |
Заключение
По результатам анализа состояния донного ихтиоцена в экономической зоне России Берингова моря можно отметить, что, несмотря на стабильное состояние запасов донных рыб, структура его постоянно изменяется в результате колебаний численности отдельных массовых видов. Особенно четко эти изменения выражены в разных районах и биотопах. В пределах шельфа в летний период в последние годы постоянно доминирует треска, а на материковом склоне малоглазый макрурус. У ряда массовых видов семейств рогатковых, бельдюговых и камбаловых, в течение рассматриваемых лет проявлялись устойчивые тренды разной направленности. Причиной их являлись, как естественные многолетние колебания численности, так и изменения в сроках и в площадях районов исследований, охваченных съемками. Имело место и перераспределение массовых видов донных рыб в пределах шельфа и материкового склона, а также в интенсивности их внутрисезонных миграций .
Биомасса донных и придонных рыб в Олюторско-Наваринском районе и Анадырском заливе достаточно высокая и в 2005-2012 гг. изменялась от 1.01 до 1.14 млн т. Основу донного ихтиоцена в пределах шельфа составляют два семейства – тресковые и камбаловые, в некоторые годы, кроме того, и рогатковые, а на материковом склоне – макрурусовые. Треска, даже в условиях снижения численности, остается доминирующим видом на шельфе, что особенно выражено в Олюторско-Наваринском районе. В условиях холодного 2012 г., интенсивность ее миграций в Анадырский залив снизилась и сократилась также численность особей младших возрастных групп по всему району исследований. После урожайного поколения 2003 г. рождения остальные генерации трески являются не столь многочисленными. В середине 20-х гг. текущего столетия в северо-западной части Берингова моря следует ожидать снижение биомассы трески в летний период. Но, даже в условиях очередного похолодания уровень ее запасов в течение двух-трех ближайших лет будет сохраняться на достаточно высоком уровне.
Высокими остаются запасы ценных промысловых видов семейства камбаловых, постоянно обитающих в западном секторе Берингова моря – двухлинейная и желтобрюхая камбалы, а также заходящие сюда для нагула в летний период черный и белокорый палтусы. На материковом склоне в зоне России Берингова моря на глубинах более 500м основу биомассы рыб составляет малоглазоый макрурус.
Библиографическая ссылка
Гаврилов Г.М., Глебов И.И. СОСТАВ И СТРУКТУРА СООБЩЕСТВА ДОННЫХ РЫБ В ЭКОНОМИЧЕСКОЙ ЗОНЕ РОССИИ БЕРИНГОВА МОРЯ ПО РЕЗУЛЬТАТАМ ИССЛЕДОВАНИЙ ФГУП «ТИНРО-ЦЕНТР» В 2005-2012 ГГ. // Успехи современного естествознания. 2013. № 11. С. 37-49;URL: https://natural-sciences.ru/ru/article/view?id=33118 (дата обращения: 06.12.2025).



