Несмотря на введение в микробиологическую практику новых усовершенствованных методов исследования, до сих пор четкой границы между микробиоценозом кишечного биотопа здоровых и больных лиц так и не выявлено. Каловый микробиоценоз является сложным и динамичным [2], состав его индивидуален для каждого человека, что важно учитывать не только в диагностике дисбиоза, но и в выборе препаратов и способов его профилактики и коррекции.
Внедрение в микробиом кишечника пробиотических микроорганизмов и применение пребиотиков с целью коррекции дисбиозов часто имеет хороший результат [3]. Однако случаи отсутствия положительных эффектов данных способов коррекции наталкивают на мысль об отторжении внесённых эндогенных микроорганизмов-пробиотиков интестинальной иммунной системой, что может усугубить микроэкологический дисбаланс и вызвать усиление аллергизации организма [7].
Цель данного исследования – показать целесообразность комплексного изучения кишечной микробиоты, заключающегося в сочетании микробиологического исследования с оценкой уровня иммунореактивности организма к индигенной микрофлоре (бифидобактериям) по наличию антител против бифидобактерий, выявляемых в копрофильтратах человека с помощью эритроцитарных диагностикумов методом РНГА.
Материалы
и методы исследования
Объекты исследования. Были обследованы дети от 1 года до 14 лет, проживающие в городе Иркутске. При выполнении работы все исследования проводились с соблюдением принципов добровольности и конфиденциальности в соответствии с «Основами законодательства РФ об охране здоровья граждан» (Указ Президента РФ от 24.12.1993 №2288).
Микробиологические методы. Бактериологический анализ копрологического материала на дисбиоз и определение степени дисбиоза по результатам анализа проводились в соответствии с Отраслевым стандартом 91500.11.0004 – 2003 и методическими рекомендациями МЗ СССР №10-11/4-М. от 1991[6]. Исследовано 314 копрологических образцов.
Серологические методы. На наличие антител к бифидобактериям проанализировано 314 образцов копрофильтратов, приготовленных из копрологического материала детей с клиническими проявлениями кишечного дисбиоза, проходивших обследование в Центре диагностики и профилактики дисбактериозов ФГБУ «НЦ ПЗСРЧ» СО РАМН.
Копрофильтрат анализировали в реакции непрямой гемагглютинации (РНГА) с использованием оригинального эритроцитарного иммунодиагностикума на основе антигенов клеточных стенок Bifidum bifidum (коммерческий штамм Bifidum bifidum №1, «Ланафарм», г. Москва) [4; 5; 8].
Получение антигена. В процессе приготовления иммунодиагностикума использовали фракцию клеточных стенок (ФКС) бифидобактерий, получаемую путём дезинтеграции микробных клеток на ультразвуковом дезинтеграторе (SONOPULS HD 2200, Германия). Для дезинтеграции готовили взвеси микробных клеток, выращенных на тиогликолевой среде, по стандарту мутности в концентрации не менее 10 млрд. клеток в 1 мл. Схема дезинтеграции состояла из 3-х идентичных этапов – по 4 мин с максимальной амплитудой ультразвука 100 %. После 3 этапа контрольный мазок показал стопроцентное разрушение клеток. Дезинтегрированную микробную массу суспендировали в 10мл фосфатного буфера (рН 7,2) и центрифугировали в течение 10 мин при
2 000 об/мин (центрифуга К 70D, ГДР) для осаждения возможных не разрушенных микробных клеток. Супернатант повторно центрифугировали в течение 10 мин при 8000 об/мин на лабораторной медицинской центрифуге ОПн-8(Россия). Полученный осадок представлял собой фракцию клеточных стенок (ФКС), используемую для иммунизации животных и при изготовлении тест-системы.
Иммунизация животных. Для контроля иммунодиагностикума использовали сыворотки, полученные от иммунизированных фракцией клеточных стенок бифидобактерий беспородных лабораторных мышей (30 штук, массой около 25 г.). Эксперименты с мышами проводили на базе вивария НИИ Биофизики (ГОУ ВПО Ангарская государственная техническая академия, ветеринарное удостоверение 238 № 0018304 от 07.09.2009). Эксперименты на животных проводились в соответствии с правилами, принятыми Европейской конвенцией по защите позвоночных животных, используемых для экспериментальных и иных научных целей (Правила проведения работ c использованием лабораторных животных, Cтpасбypг, 1986). Для иммунизации из ФКС готовили взвесь клеточных стенок бифидобактерий, соответствующую концентрации 10 млрд. клеток в мл. Взвесь вводили по 0,5 мл внутрибрюшинно один раз в неделю в течение 3-х недель. Забор крови производили из сердца через неделю после последней иммунизации, предварительно усыпив животных эфиром.
Результаты исследования
и их обсуждение
Ценность количественного бактериологического анализа фекалий повышается, если он в зависимости от показаний дополняется определением других параметров [1]. В нашем случае – это выявление антител к индигенной микрофлоре (бифидобактериям), в норме колонизирующих кишечник. Эволюционно закрепленное динамическое состояние иммунологической толерантности к антигенам симбионтной микробиоты играет одну из ключевых ролей в нормальном функционировании макроорганизма. Утрата иммунологической толерантности к комменсалам нормальной микрофлоры под воздействием эндогенных и экзогенных факторов, приводит к выработке специфических антител, поступающих не только в кровь, но и в просвет толстой кишки [10]. Наличие в крови высоких титров антител против бифидобактерий может привести к длительной дестабилизации саморегулирующейся кишечной экосистемы, что свидетельствует о срыве иммунологической толерантности к симбионтной микрофлоре [7]. Поэтому коррекция дисбиотических нарушений у детей должна проводиться не только на основании результатов бактериологического обследования, дающего информацию о количественном и качественном изменении в составе микробиоты, но и с учётом иммунной реакции организма на эти изменения.
Проведенные исследования показали, что практически у всех обследованных детей выявлялись отклонения в составе микроорганизмов кишечной микробиоты относительно общефизиологических нормативов [6]. Частота встречаемости дисбиотических нарушений составила 84,3 %. При этом у всех детей, независимо от возраста, в 59,03 % преобладал дисбактериоз I степени, практически у каждого четвертого ребенка (24,0 %) был зарегистрирован дисбактериоз II степени. Дисбактериоз III степени отмечался в младшей возрастной группе у 1,2 % детей, т.е. наиболее значимые изменения в составе нормальной микрофлоры кишечника наблюдались у детей от 1 года до 2-х лет.
Во всех возрастных группах наблюдалось угнетение индигенной флоры (бифидобактерии, лактобациллы, кишечная палочка с нормальной ферментативной активностью) на 1-2 порядка от физиологической нормы. У детей первых двух лет жизни с высокой частотой обнаруживались потенциально патогенные микроорганизмы семейства Enterobacteriaceae (Klebsiella spp., Enterobacter spp.и др.) [9].
Иммунологические исследования копрофильтратов выявили антитела к B.bifidum у 73,7 % лиц в титрах от 1:4 до 1:256. При этом степень дисбактериоза не имела прямой зависимости от величины титров антител, что свидетельствует об индивидуальной реакции организма на изменения в составе микрофлоры и, таким образом, обосновывает необходимость индивидуального подхода к коррекции с учётом особенностей иммунореактивности макроорганизма. На основании полученных результатов нами предлагается методологическая концепция объективной оценки микроэкологического статуса кишечного биотопа, опирающаяся на количественную оценку доминанты кишечного биотопа – бифидобактерий и степени иммунореактивности организма по отношению к ним. Согласно концепции возможны разные варианты коррекции дисбиоза, обусловленного дефицитом бифидобактерий. Данные исследования помогут подобрать более адекватную пробиотическую терапию. В зависимости от результата обследования показана соответствующая тактика коррекции дисбиоза (рисунок).
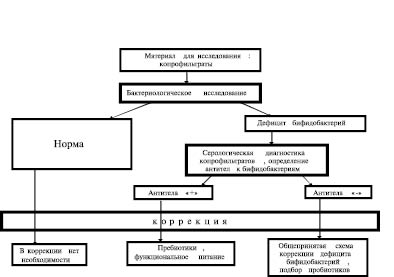
Алгоритм проведения комплексного иммуно-микробиологического обследования пациента и возможных путей коррекции дисбиоза
При отсутствии антител к бифидобактериям в копрофильтратах и наличии дисбиоза коррекция микроэкологических нарушений осуществляется традиционными методами: элиминация патогенов и условных патогенов, введение пробиотических и пребиотических препаратов, диетотерапия, функциональное питание.
При выявлении высокого уровня антител к бифидобактериям, свидетельствующем о «срыве» иммунологической толерантности, прогноз восстановления микробиоценоза менее благоприятен и требует специального подхода. При дисбиозах на фоне иммунореактивности к бифидофлоре показаны препараты–пребиотики, которые не вызывают усиления иммунореактивности, но способствуют росту индигенной микрофлоры пациента. При определении видового состава собственной бифидофлоры пациента молекулярно-генетическим методом (ПЦР) возможно применение пробиотиков с соответствующими организму видами.
Таким образом, выявление антител к бифидобактериям, в комплексе с бактериологическим и молекулярно-генетическим исследованиями копрологического материала позволит дать более полную оценку микробиоценоза пациентов и, следовательно, выбрать наиболее адекватные способы восстановления нормальной микрофлоры кишечника. При этом, несмотря на унифицированность данного алгоритма, подход к каждому проявлению дисбиоза индивидуален.
Библиографическая ссылка
Сердюк Л.В., Попкова С.М., Ракова Е.Б., Немченко У.М., Савелькаева М.В., Лещук С.И., Кичигина Е.Л., Юринова Г.В. АЛГОРИТМ ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКИ И КОРРЕКЦИИ КИШЕЧНЫХ ДИСБИОЗОВ // Успехи современного естествознания. 2014. № 5-2. С. 58-61;URL: https://natural-sciences.ru/ru/article/view?id=33922 (дата обращения: 05.03.2026).



