Республика Казахстан относится к одной из важнейших золотоносных провинций центрально-азиатского региона. По уровню запасов, их качеству основные золоторудные месторождения Казахстана сопоставимы с месторождениями зарубежных стран и в принципе могли бы обеспечить более высокий уровень производства золота в стране. Вместе с тем, при неблагоприятной мировой конъюнктуре золота, неизбежным становится предъявление более жестких требований к качественным и количественным параметрам отдельных месторождений и к минерально-сырьевой базе в целом.
Материалы и методы исследования
Изучение количественного и качественного состава микрофлоры месторождения Бакырчик проводили по общепринятым методикам. Пробы рудных вод при обследованиях отбирались стерильно, в соответствии с имеющимися руководствами. Подсчет количества микроорганизмов проводили методом предельных разведений испытуемых вод или болтушек на элективных средах в двух – трехкратных повторностях.
Получение накопительной культуры для выделения культуры в колбы Эрленмейра на 100мл вносили 30мл стерильной среды Сильвермана и Лундгрена 9К и пробы рудничной воды или руды из месторождений сульфидных руд, затем инкубируют при 30ºС до появления роста. О развитии бактерии судили по появлению бурой окраски среды, вызванной образованием соединении трехвалентного железа.
Для выделения культуру A.ferrooxidans в колбу Эрленмейера емкостью 250 мл вносили среду Сильвермана и Лундгрена 9К в объеме 150 мл. Затем добавляли пробы руды из месторождений сульфидных руд, инкубировали при 30ºС до появления роста. Для выделения штаммов бактерии, активных в окислении сульфидных минералов и устойчивых к ионам тяжелых металлов, использовали также сульфидные минералы.
Для количественного учета A. ferrooxidans, содержащихся в 1 г использовали метод кратных разведений. При исследовании рудного субстрата навеску измельчали в гомогенизаторе и растирали в ступке и готовили исходную взвесь в разведении 1:10. Из полченной взвеси или исходного жидкого материала готовили ряд последующих разведений с таким расчетом чтобы при посеве двух последних разведений на чашке Петри агаре выросло от 50 до 300 колоний.
Определение Fe+2 и Fe+3 проводилось объемным трилонометрическим методом в пробах, основанным на образовании комплекса трехвалентного железа с сульфосалициловой кислотой, который окрашивается в малиновый цвет. Содержание железа в растворах варьировало в диапазоне 0,1-10 г/дм3 [3].
Учет Th.thiooxidans вели по появлению неисчезающей мути и оседанию серы, по образованию пленки серы, подкислению среды и другим специфическим признакам на среде Ваксамана (г/л): (NH4)2SO4–3,0; КН2РО4–3,0; MgSO4·7H2O–0,5; CaCl2·6H2O – 0,25; Fe2SO4·7H2O–3,0; серный цвет (Sº) – 10; H2O–1,0 л, рН 4,0 [1].
Для количественного учета аммонификаторов использовали пептонную воду (г/дм3 водопроводной воды): пептон – 10; NaCl – 0,5.
Для подсчета азотфиксирующих бактерий производили высев 0,25 г пробу руды на среду Эшби. О наличии азотобактерий в исследуемом материале судили по образованию характерных колоний вокруг песчинок. Производили подсчет количества колоний на чашке в пересчете на 1 г руды. Сапрофитные бактерии учитывали на мясопептонном агаре.
Результаты исследования
и их обсуждение
Известно, что некоторые виды сапрофитных бактерий, обитающих на месторождении, обладают способностью к автотрофному росту в связи с чем также относятся к хемолитотрофам.
Численность сапрофитной микрофлоры варьировала в пределах 102 - 107 кл./мл шахтной воды. В пробах руды и шахтных вод, где реакция среды колебалась в пределах от рН 5,0 до 5,5; численность сапрофитных бактерий не превышала 102 кл./мл воды.
Отмеченная закономерность позволяет предположить, что сапрофитные микроорганизмы, обнаруженные на месторождении, являются представителями обычной сапрофитной микрофлоры, оптимумом для развития которой является нейтральная и слабокислая реакция среды (рис. 1).

Рис. 1. Численность сапрофитных микроорганизмов в шахтных водах
Наблюдающаяся дифференциация распространения сапрофитов в зависимости от рН вод, по-видимому, отражает уменьшение общего их числа в зоне гипергенеза на месторождении. Непосредственно после вскрытия рудного тела, шахтные воды имеют преимущественно нейтральную реакцию, что благоприятствует развитию сапрофитных микроорганизмов, кислые рудничные воды в этот период встречаются лишь микрозонально и возможна широкая миграция в них различных микроорганизмов. Затем, по мере развития окислительных процессов на месторождении, воды приобретают кислую реакцию, что приводит к сокращению численности сапрофитов, предпочитающих нейтральную среду.
Распределение сапрофитных бактерий в карьерном рудном теле представлено на рис. 2. Сапрофитные микроорганизмы встречались во всех породах рудного тела. Наибольшая численность микроорганизмов отмечена в кызыловской зоне смятия с песчано-сланцевыми отложениями бакырчикской свиты и в углисто-глинистом аргиллите и алевролите – 107 кл./г, наименьшая – в терригенно-осадочной породе каменноугольной системы и в линзовидном маломощном известняке и андезитовых порфиритах – 103 кл/г. В остальных породах их количество варьировало в пределах 105-106 кл./г. Следует отметить, что распределение сапрофитных микроорганизмов в шахтных водах и рудном теле несколько отличаются. Сланцевые и углистые породы руды в большей степени адсорбируют микроорганизмы, чем осадочные породы. Вероятно, в данном случае углеродсодержащие породы используются микроорганизмами как источник углерода. Возможно также присутствие питательных веществ из остатков растительности, накопившихся в углях и сланцах.
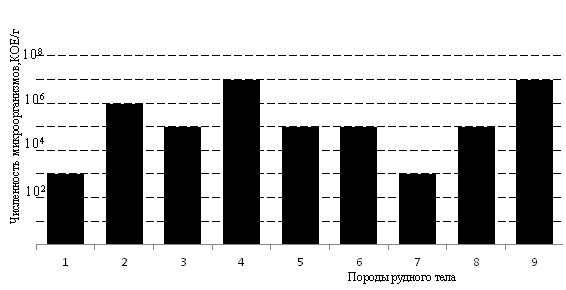
Рис. 2. Численность сапрофитных микроорганизмов в рудном теле
Таким образом, в распределении сапрофитов в руде более значительную роль играет наличие дополнительного источника питания, тогда как в шахтных водах – кислотность среды.
Выделение аборигенных штаммов хемолитотрофных бактерий
Среди автотрофных тионовых бактерий ведущая роль в окислении сульфидных руд принадлежит A.ferrooxidans. Эти микроорганизмы обладают способностью в кислых условиях окислять закисное железо в окисное, а также сульфиды в сульфаты и таким образом интенсифицировать скорость выщелачивания металлов из руд [4]. В благоприятных условиях скорость бактериального окисления железа в 200-500 тысяч раз выше, чем под действием кислот [9]. При окислении 1-атома двухвалентного железа прирост сухой биомассы клеток достигает 0,35 г [10].
Выделение новых микроорганизмов из рудничных месторождений и знание их физиологии позволит расширить применение микробиологических методов, выщелачивания и обогащения руд, которые приобретают все большее значение в связи с истощением запасов богатых руд [2, 5, 6, 7, 8].
С целью получения накопительных культур A. ferrooxidans использовали образцы руды и шахтной воды, в которых в результате микробиологического обследования была отмечена повышенная численность тионовых бактерий – это образцы воды из горизонтов 10 и 330, а также рудный материал из карьера - кызыловская зона смятия с песчано-сланцевыми отложениями бакырчикской свиты и углисто-глинистый аргиллит и алевролит.
Для получения накопительной культуры A.ferrooxidans использовали элективную среду Сильвермана и Лундгрена 9К. Считается, что повыщенная кислотность этой среды препятствует развитию обычной сапрофитной микрофлоры и создает условия для преимущественного развития автотрофных тионовых бактерий. В колбы Эрленмейера емкостью 250 мл со средой Сильвермана и Лундгрена 9К в объеме 150 мл добавляли пробы шахтной воды или руды. Для микробиологического обследования рудного тела в соответствии с данными по распределению руды и золота были отобраны пробы руды с различных горизонтов с разнообразным геолого-минералогическим составом. Колбы инкубировали в течение 7-10 суток при оптимальной температуре (28 - 30ºС). О развитии бактерий A.ferrooxidans судили по появлению бурой окраски среды, вызванной образованием соединений трехвалентного железа в растворе. Результаты этих экспериментов представлены в таблице 1. Как видно из результатов таблицы активность ацидофильных бактерий в накопительных культурах варьировала в пределах 1-5 баллов, зависела в основном от длительности наблюдения.
По интенсивности окрашивания среды и количеству ионов Fe3+ в среде отбирали наиболее активные штаммы, готовили ряд последующих разведений для определения титра культуры и дальнейшего изучения свойств культуры. На рисунке 3 показана чистая стерильная среда Сильвермана и Лундгрена 9К, подготовленная для определения титра бактерий в исследуемых пробах, а также в накопительных и чистых культурах. После нескольких пересевов из накопительных культур A. ferrooxidans в стерильную среду Сильвермана и Лундгрена 9К культуры были очищены и проверены на активность. Наиболее активно развивались культуры, выделенные из проб руды. Всего на идентификацию было отобрано 6 штаммов ацидофильных бактерий. За 10 суток культивирования их титр возрастал до 107 кл./мл.
Таблица 1
Активность накопительных культур ацидофильных бактерий
|
№ |
№ Пробы отбора |
Активность окисления FeSO4 (баллы) за период наблюдения (сутки) |
|||||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
||
|
1 |
1 |
- |
- |
- |
- |
- |
+5 |
+5 |
+5 |
+5 |
+5 |
|
2 |
1 |
- |
- |
- |
- |
- |
- |
+1 |
+1 |
+1 |
|
|
3 |
1 |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
4 |
2 |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
5 |
2 |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
6 |
2 |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
7 |
3 |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
8 |
3 |
- |
- |
- |
- |
- |
- |
- |
+5 |
+5 |
+5 |
|
9 |
3 |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
10 |
4 |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
11 |
4 |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
12 |
4 |
- |
- |
+5 |
+5 |
+5 |
+5 |
+5 |
+5 |
+5 |
+5 |
|
13 |
5 |
- |
- |
- |
- |
- |
+5 |
+5 |
+5 |
+5 |
+5 |
|
14 |
5 |
- |
- |
- |
- |
- |
+4 |
+4 |
+4 |
+5 |
+5 |
|
15 |
5 |
- |
- |
- |
- |
- |
|||||
|
16 |
6 |
- |
- |
+4 |
+5 |
+5 |
+5 |
+5 |
+5 |
+5 |
+5 |
|
17 |
6 |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
18 |
6 |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
19 |
7 |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
20 |
7 |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
21 |
7 |
- |
- |
- |
- |
+1 |
+1 |
+1 |
+1 |
+1 |
+1 |
|
22 |
8 |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
23 |
8 |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
24 |
9 |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
25 |
9 |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
Было отмечено, что в процессе пересевов активность окисления Fe2+ возрастает, так как происходит адаптация бактерий к искусственным средам.

Рис. 3. Среда Сильвермана и Лундгрена 9К (исходная)
На рис. 4 отмечено изменение цвета среды – появление бурого окрашивания, которое свидетельствует о росте A.ferrooxidans. По последней пробирке, в которой произошло изменение цвета среды, определяется титр культуры.
Были предприняты попытки культивировать A. ferrooxidans на твердых средах. В первом посеве удалось получить мелкие коричневатые колонии, однако в последующих пересевах рост культуры отсутствовал. В связи с этим накопительные и чистые культуры A. ferrooxidans поддерживали на жидкой среде Сильвермана и Лундгрена 9К.

Рис. 4. A.ferrooxidans в среде Сильвермана и Лундгрена 9К после 10 суток культивирования
Заключение
В результате выполненной работы были сделаны следующие выводы:
– Распределение сапрофитных микроорганизмов в шахтных водах и рудном теле несколько отличаются. Сланцевые и углистые породы руды в большей степени адсорбируют микроорганизмы, чем осадочные породы. Тионовые бактерии были распространены в слабокислой воде (рН= 5,0), сапрофитные – в нейтральной и слабощелочной воде.
– Из образцов шахтных вод и пород рудного тела с повышенным количеством тионовых бактерий были получены накопительные культуры, из которых выделено 6 чистых культур тионовых бактерий.
Библиографическая ссылка
Канаев А.Т.1, Канаева З.К.2, Семенченко Г.В.3, Мураталиева А.А.3 РАСПРЕДЕЛЕНИЕ САПРОФИТНЫХ МИКРООРГАНИЗМОВ В ШАХТНЫХ ВОДАХ И РУДНОМ ТЕЛЕ ЗОЛОТО-МЫШЬЯКОВИСТОГО МЕСТОРОЖДЕНИЯ БАКЫРЧИК // Успехи современного естествознания. 2014. № 12-3. С. 216-221;URL: https://natural-sciences.ru/ru/article/view?id=34572 (дата обращения: 14.02.2026).



