Одними из наиболее распространенных патогенных грибов для человека являются различные виды Candida [1]. C. albicans – диморфный комменсал, который относится к условно патогенной микрофлоре [2]. Висцеральный кандидоз относится к числу оппортунистических микозов и развивается, в основном, у больных в отделениях интенсивной терапии – больных с полиэтиологичными иммунодефицитными состояниями, особенно у детей и лиц пожилого возраста. Проблема усложняется высокой адаптационной способностью этих грибов, их способностью к внутриклеточному паразитированию, отсутствием эффективных средств лечения в связи с плохой изученностью патогенеза. Актуальность проблемы обусловлена непрерывным ростом частоты этих осложнений и сохраняющейся высокой летальностью [3].
Основой патогенеза микотического воспаления является внутриклеточное персистирование микромицетов в клетках системы мононуклеарных фагоцитов [4]. Внутриклеточное паразитирование C. albicans возможно при неэффективности макрофагальных кислород-зависимых и кислород-независимых систем вакуолярного аппарата.
Поскольку антимикотическая терапия у большинства больных, страдающих висцеральными микозами, зачастую не приносит успеха и сопряжена с рисками развития осложнения – представляется полезным исследование состояния естественных механизмов антимикотической защиты реализуемых макрофагами.
Цель исследования – изучить изменения кислород-зависимых и кислород-независимых факторов защиты в легких мышей при генерализованном висцеральном кандидозе.
Материалы и методы исследования
Работа выполнена на 70 мышах-самцах линии СBA двухмесячного возраста с массой тела 20-25 г, полученных из питомника Научно-исследовательского института клинической иммунологии СО РАМН, Новосибирск.
Животных содержали в стандартных условиях со свободным доступом к воде и пище. Перед проведением эксперимента их адаптировали к условиям содержания в течение 2х недель. Исследование было проведено в соответствии с Хельсинской декларацией (1964) и его протоколы были утверждены соответствующими комитетами по этике ФГБУ НЦКЭМ СО РАМН.
В качестве инфекционного агента был выбран высокопатогенный штамм Candida albicans РКПГУ-1129/13 (НИИ эпидемиологии и микробиологии имени Пастера, Санкт-Петербург). Для достижения системного поражения инфицирование мышей проводили внутривенно (в хвостовую вену) в дозе 12,5⋅106 микробных тел в 0,5 мл 0,05 % водного раствора хлористого натрия (NaCl). Контролем служили двухмесячные интактные мыши-самцы линии СВА.
Объектом исследования были легкие экспериментальных животных. Образцы легких забирали через 1, 3, 7 и 10 сутки после инфицирования. Животных выводили из эксперимента путем дислокации позвонков в шейном отделе.
Образцы органов фиксировали в 10 % водном нейтральном растворе формалина, обезвоживали в серии спиртов возрастающей концентрации и ксилолах при помощи аппарата для автоматической проводки STP-120 («Microm», Германия), затем помещали в синтетическую парафиновую среду («НISTOMIX», Россия).
Для светооптического исследования срезы толщиной 3,5 мкм готовили на ротационном микротоме («Microm», Германия), окрашивали по стандартной методике гематоксилином и эозином, пикрофуксином по ван Гизон (для выявления волокон соединительной ткани).
Методом иммуногистохимии (ИГХ) с использованием непрямого стрептавидин-пероксидазного комплекса с помощью специфических первичных антител к маркерам: индуцибельной NO–синтазы (iNOS) («Novocastra»), эндотелиальной NO-синтазы (eNOS) («Abcam»), Cathepsin D («DBS»), Myeloperoxidase («DBS»), Lysozyme («DBS»), TNF-α («SpringBioScience») исследовали концентрацию легочных макрофагов, экспрессирующих комплексы (антиген-антитело). Для проведения ИГХ-исследования срезы легких подвергали депарафинизации, регидратации, демаскировке антигенов в микроволновой печи мощностью 700W. Время экспозиции с первичными антителами составляло 30 мин при температуре 37°С. Затем срезы инкубировали со стрептавидин–пероксидазным комплексом, DAB–субстратом и дополнительно докрашивали гематоксилином Майера.
Срезы образцов органов изучали на микроскопе – AxioImager A1 с фотокамерой AxioCam MRc5 (Carl Zeiss, Германия). Морфометрию структурных элементов легкого осуществляли с помощью окулярной сетки на 100 точек площадью 3,52х104 мкм2 [5] и инструментов программы AxioVision (rel. 4.12). Учитывали численную плотность (Nаi) и клеточный состав гранулем и их размеры, объемную плотность (Vv) локусов с патологическими изменениями (кровоизлияния, инфильтраты и разрастание соединительной ткани), а также количество клеток, экспрессирующих исследуемые маркеры. Средние величины исследованных параметров вычисляли с использованием стандартного пакета программ «Statistica» вероятность достоверности различия сравниваемых средних величин определяли по t-критерию Стьюдента и при условии нормального распределения величин исследуемых параметров, кроме того проводили корреляционный анализ по Пирсу. Достоверными считали различия при р<0,05.
Результаты исследования и их обсуждение
Генерализованный характер микотического воспаления был подтвержден наличием гранулем во внутренних органах, в частности печени, почках и легких, где наблюдали различные формы грибов.
Численная плотность гранулем в легких инфицированных животных увеличивалась с 1 по 10 сутки эксперимента в 7,8 раза, увеличивался их диаметр, по величине которого судили о размерах гранулем, к 10 суткам инфекционного процесса на 30 % (табл. 1). Эти данные позволяют сделать предположение о том, что в крови вплоть до 10 суток циркулировали бактериальные тела, поскольку с 7 по 10 сутки количество гранулем увеличилось на 72 %, а формирование гранулем происходило достаточно быстро, поскольку их размер за этот же период увеличился только на 6 %.
Таблица 1
Результаты исследования численных плотностей и диаметров гранулем в легких мышей-самцов линии СВА, инфицированных высокопатогенным штаммом C. albicans РКПГУ-1129/13 (M±m)
|
Орган |
Сроки исследования (сутки после инфицирования) |
Численная плотность гранулем, (Nai) |
Диаметр гранулем |
|
Легкие |
1 |
0,4 ± 0,1 |
15,25 ± 0,7 |
|
3 |
1,5 ± 0,1a |
16,86 ± 0,4a |
|
|
7 |
1,8 ± 0,2a |
18,76 ± 0,4a |
|
|
10 |
3,1 ± 0,2a |
19,73 ± 0,3a |
Примечание. «а» – достоверные различия величин исследованных параметров по срокам эксперимента, при р<0,05.
На протяжении всего эксперимента среди клеток гранулемы в легких мышей, инфицированных C. albicans, преобладали макрофаги, количество которых к 10 суткам увеличивалось на 50 % (табл. 2). В то время как количество лимфоцитов и нейтрофилов уменьшалось в 1,4 и 3 раза соотвественно (табл. 2). Возможно, уменьшение количества лимфоцитов связано с недостаточностью иммунного ответа и иммуносупрессорным воздействием грибов C. albicans, выделяемых ими токсинов и повышающейся цитотоксичностью [6]. Увеличивалось и количество эпителиоидных клеток в гранулемах к 10 суткам заболевания в 10,3 раза. Единичные фибробласты наблюдали в ранние периоды исследования, а к 10 суткам эксперимента их количество увеличивалось в 3,3 раза (табл. 2).
Таблица 2
Клеточный состав гранулем в легких мышей линии СВА, инфицированных высокопатогенным штаммом C. albicans РКПГУ-1129/13 (M±m)
|
Клеточный состав гранулем ( %) |
Сроки исследования (сутки после инфицирования мышей) |
|||
|
1 |
3 |
7 |
10 |
|
|
Эпителиоидные клетки |
0,4±0,3 |
0,9 ± 0,5 |
5,3 ± 1,1 a |
7,5 ± 0,9 a |
|
Макрофаги |
55,3 ± 1,1 |
60,1 ± 1,3 a |
64,5 ± 1,7 a |
68,7 ± 1,1 a |
|
Лимфоциты |
19 ± 0,9 |
17,3 ± 1,2 |
14,2 ± 1,5 a |
10,1 ± 1,1 a |
|
Нейтрофилы |
25,7 ± 1,3 |
20,8 ± 1,2 a |
13,9 ± 1,2 a |
10,3 ± 1,1 a |
|
Фибробласты |
0,7 ± 0,6 |
1,1 ± 0,4 |
2,1 ± 1,4 |
3,3 ± 1,1 |
Примечание. «а» – достоверность различий параметров по срокам, при р<0,05.
Через сутки после инфицирования мышей линии СBA в интерстиции легких регистрировали инфильтраты, преимущественно нейтрофильно-макрофагального характера, масштабы которых были неизменными с 1 по 10 сутки. Также наблюдали наличие кровоизлияний, максимальный масштаб которых был на 7 сутки исследования (в 2 раза), с дальнейшим незначительным уменьшением к 10 суткам эксперимента (рис. 1). В совокупности это свидетельствует об остром характере воспаления и является морфологическим свидетельством состояния острой дыхательной недостаточности.
Наряду с этим увеличивалась содержание волокнистой соединительной ткани в интерстиция легких с 1 по 10 сутки эксперимента в 3,5 раза (рис. 1).
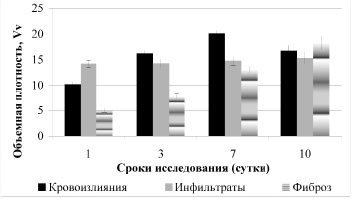
Рис. 1. Объемная плотность локусов кровоизлияний, клеточных инфильтратов и фиброза в легких мышей линии СВА, инфицированных C. аlbicans
Клетки системы мононуклеарных фагоцитов – одна из первых линий противогрибковой защиты. В легких они представлены макрофагами, которые проявляют свои фунгицидные свойства за счет окислительных (NO-синтазы) и неокислительных (лизосомальные ферменты) механизмов. Раньше в противогрибковую защиту вступают лизосомальные ферменты: количество клеток, экспрессирующих cathepsin D и myeloperoxidase было максимальным в 1 сутки эксперимента. Количество макрофагов, экспрессирующих cathepsin D к 10 суткам эксперимента уменьшалось в 2,7 раза.
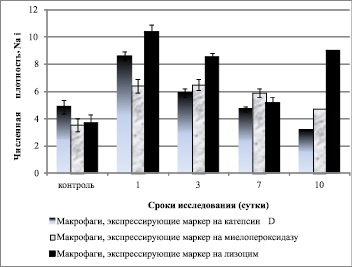
Рис. 2. Численная плотность легочных макрофагов, экспрессирующих маркеры лизосомальных ферментов (гидролаз) у мышей линии СВА, инфицированных C. Albicans
Количество макрофагов, экспрессирующих lysozyme уменьшалось к 7 суткам эксперимента и увеличивалось к 10 суткам (рис. 2). Однако экспрессия лизосомальных ферментов являлась недостаточной для сдерживания развития инфекции.
С 1 суток эксперимента, в клетках интерстиция и гранулем легких отмечали положительную реакцию с антителами к эндотелиальной и индуцибельной изоформам NO-синтаз (eNOS и iNOS). Количество макрофагов, экспрессирующих eNOS увеличивалось к 10 суткам эксперимента в 1,6 раза. Однако к 10 суткам эксперимента, по мере созревания гранулем в эпителиоидно-макрофагальные, наблюдали снижение активности iNOS на 30 % (рис. 3).
Фактически экспрессия индуцибельной изоформы вышла на плато и можно предположить, что эффекты NO носят пролонгированный характер и экспрессия обеих NO-синтаз на более поздние сутки исследования будут увеличиваться. С другой стороны, исследования последних лет показывают, что повышенная экспрессия TNF-α блокирует ген, отвечающий за экспрессию индуцибельной изоформы NO-синтазы [7].
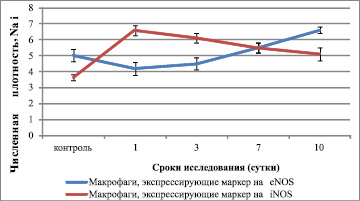
Рис. 3. Численная плотность легочных макрофагов с экспрессией маркеров на NO-синтазы у мышей линии СВА, инфицированных Candida Albicans
Следует отметить, что эпителиоидные клетки показали крайне слабую реакцию на NO-синтазы, что может быть связано со способностью C. аlbicans блокировать фунгицидные системы макрофагов и в дальнейшем приводить к незавершенности фагоцитоза и внутриклеточной персистенции гриба в фагоцитах, способствуя диссеминации возбудителя.
Заключение
Таким образом, при инвазивных микозах на ранних стадиях инфекционного процесса происходит активация лизосомальных ферментов и системы оксида азота преимущественно в макрофагах, а их секреция на ранних этапах исследования носит защитный характер, оказывая фунгицидный эффект на C. Albicans.
По мере развития заболевания, связанного с незавершенностью фагоцитоза из-за чрезмерной секреции NO и недостаточности лизосомальных ферментов, а также диссеминации возбудителя, происходит увеличение количества гранулем, что приводит к легочной недостаточности, в связи с развитием легочного фиброза и прогрессирующих патоморфологических изменений.
Библиографическая ссылка
Ковнер А.В., Потапова О.В., Шкурупий В.А. ПАТОМОРФОЛОГИЧЕСКИЕ ИЗМЕНЕНИЯ ЛЕГКИХ И ФУНКЦИОНАЛЬНЫЙ СТАТУС ЛЕГОЧНЫХ МАКРОФАГОВ ПРИ ГЕНЕРАЛИЗОВАННОЙ ФОРМЕ КАНДИДОЗА, ВЫЗВАННОГО CANDIDA ALBICANS // Успехи современного естествознания. 2014. № 12-4. С. 335-339;URL: https://natural-sciences.ru/ru/article/view?id=34607 (дата обращения: 06.02.2026).



