Борьба с инфекционными заболеваниями, возбуждаемымие грамположительными и грамотрицательными микроорганизмами была и остается одной из самых острых медицинских и социальных проблем. Надо отметиь, что в современной химиотерапии инфекционных заболеваний важную роль играют азотсодержащие соединения, особенно производные четырехзамещенного аммония [1, 2].
Учитывая тот факт, что ненасыщенные четвертичные аммониевые соли, в частности их галогенсодержащие аналоги с гидрофобными фрагментами в молекуле, обладают выраженной антимикробной активностью [3, 4, 6] мы сочли целесообразным продолжить изыскания новых соединений в ряду ненасыщенных ЧАС, обладающих бактерицидным действием.
В настоящей работе приведены данные синтеза и антибактериальной активности 1,4-аминоаммониевых солей (I- IX), содержащих наряду с гетероциклической аммониевой группой общую 2,3-дибром-2-бутениленовую группу.
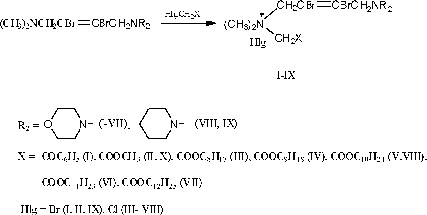
Аммониевые соли (I-VIII) были синтезированы исходя из соответствующих несимметричных диаминов, получены согласно [8]
Экспериментальная химическая часть
Спектры ЯМР 1Н получены на спектрометре Varian Mercury–300 с рабочей частотой 300.077 в (CD3)2SO. Химические сдвиги приведены относительно внутреннего стандарта–ТМС. Анализ методом ТСХ осуществляли на пластинках Silufol UV-254 в системе н-бутанол-этанол-вода-уксусная кислота (10 : 7 : 6 : 4) по объему. Проявитель – пары йода. Температуры плавления определяли на микронагревательном столике Boetius с наблюдательным устройством РНМК-0.5.
Синтез солей I-IX. Соли I-IX получены взаимодействием 1,4-гетероциклических диаминов, содержащих 2,3-дибром-2-бутениленовую общую группу [8] с эквимольным количеством бромацетофенона, метилового эфира бромуксусной кислоты или соответствующего алкилового эфира хлоруксусной кислоты в абсолютном эфире при комнатной температуре (амин и галогенид брали в мольном соотношении 1:3). После недельного стояния соли фильтровали, несколько раз промывали абс. эфиром и сушили в эксикаторе над хлоридом кальция.
Строение синтезированных солей подтверждено данными ЯМР 1Н спектроскопии и элементного анализа. Чистота проверена ТСХ.
Физико-химические характеристики солей I- IX приведены в табл. 1, а данные ЯМР 1Н спектров – в табл. 2.
Таблица 1
Физико-химические характеристики солей I-IX
|
№ соли |
Выход, % |
Т.пл., ОС |
Rf |
Найд., % |
Брутто формула |
Выч., % |
М* |
|
|
Найд. |
Выч. |
|||||||
|
CI – (Br -) |
CI – (Br -) |
|||||||
|
I |
74 |
108-110 |
0.53 |
14.83 |
C18H25 Br3 N2О2 |
14.79 |
539.5 |
541.16 |
|
II |
98 |
135-136 |
0.51 |
16.26 |
C13H23 Br3 N2О3 |
16.16 |
492.0 |
495.07 |
|
III |
67 |
Гигр. |
0.50 |
6.44 |
C20H37N2О3 Br2CI |
6.47 |
551.2 |
548.80 |
|
IV |
68 |
Гигр. |
0.60 |
6.34 |
C21H39N2О3 Br2CI |
6.31 |
560.3 |
562.82 |
|
V |
60 |
108-110 |
0.56 |
6.12 |
C22H41N2О3 Br2CI |
6.15 |
580.2 |
576.86 |
|
VI |
68 |
Гигр. |
0.65 |
5.99 |
C23H43N2О3 Br2CI |
6.00 |
593.1 |
590.87 |
|
VII |
60 |
97-99 |
0.45 |
5.84 |
C24H45N2О3 Br2CI |
5.87 |
608.3 |
604.89 |
|
VIII |
82 |
Гигр. |
0.54 |
6.64 |
C23H43N2О2 Br2CI |
6.68 |
535.0 |
531.53 |
|
IX |
60 |
150-151 |
0.67 |
16.73 |
C13H25 Br3 N2О2 |
16.63 |
478.4 |
481.09 |
|
*) Определено титрометрически. |
||||||||
Таблица 2
ЯМР 1Н спектры солей I-XI
|
№ соли |
Спектры ЯМР 1Н, d, м.д., J Гц |
|
I |
2.57-2.75 м (4Н, NСН2 морфолина), 3.64 с (NСН3), 3.63-3.79 м (6Н, NСН2 у кольца и ОСН2 морфолина), 5.10 с и 5.88 с (4Н, N+СН2), 7.55-7.61 м (2Н, мета СН бензольного кольца), 7.67-7.79 м (1Н, пара СН бензольного кольца), 8.07-8.11 м (2Н, орто СН бензольного кольца). |
|
II |
2.53-2.61 м (4Н, NСН2 морфолина), 3.57 с (NСН3), 3.60-3.67 м (6Н, NСН2 у кольца и ОСН2 морфолина), 3.86 с (3Н, ОСН3), 5.00 с и 5.02 с (4Н, N+СН2). |
|
III |
0.91 т (3Н, СН2СН3, J =6.7 ), 1,22-1,45 м [10Н, (СН2)5СН3], 1.64-1.74 м (2Н,ОСН2СН2 цепи), 2,50 -2.54 м (4Н, NСН2 кольца), 3.58 с (NСН3), 3.59-3.67 м (6Н, NСН2 у кольца и ОСН2 морфолина), 4.27 т (2Н, ОСН2 СН2, J=6,8), 5.07 с и 5.14 с (4Н, N+СН2). |
|
IV |
0.90 т (3Н, СН2СН3, J =6.7 ), 1,23-1,41 м [12Н, (СН2)6СН3], 1.64-1.74 м (2Н,ОСН2СН2 цепи), 2,50 -2.64 м (4Н, NСН2 кольца), 3.59 с (NСН3), 3.59-3.68 м (6Н, NСН2 у кольца и ОСН2 морфолина), 4.77 т (2Н, ОСН2 СН2, J=6,8), 5.09 с и 5.15 с (4Н, N+СН2). |
|
V |
0.90 т (3Н, СН2СН3, J =6.7 ), 1,25-1,40 м [14Н, (СН2)7СН3], 1.65-1.75 м (2Н,ОСН2СН2 цепи), 2,54 -2.64 м (4Н, NСН2 кольца), 3.58 с (NСН3), 3.61-3.70 м (6Н, NСН2 у кольца и ОСН2 морфолина), 4.73 т (2Н, ОСН2 СН2, J=6,8), 5.05 с и 5.09 с (4Н, N+СН2). |
|
VI |
0.89 т (3Н, СН2СН3, J =6.7 ), 1,22-1,40 м [16Н, (СН2)8СН3], 1.64-1.74 м (2Н,ОСН2СН2 цепи), 2,50 -2.62 м (4Н, NСН2 кольца), 3.59 с (NСН3), 3.59-3.67 м (6Н, NСН2 у кольца и ОСН2 морфолина), 4.22 т (2Н, ОСН2 СН2, J=6,8), 5.06 с и 5.12 с (4Н, N+СН2). |
|
VII |
0.91 т (3Н, СН2СН3, J =6.7 ), 1,24-1,42 м [18Н, (СН2)9СН3], 1.66-1.70 м (2Н,ОСН2СН2 цепи), 2,52 -2.64 м (4Н, NСН2 кольца), 3.60 с (NСН3), 3.60-3.67 м (6Н, NСН2 у кольца и ОСН2 морфолина), 4.24 т (2Н, ОСН2 СН2, J=6,8), 5.09 с и 5.14 с (4Н, N+СН2). |
|
VIII |
0.90 т (3Н, СН2СН3, J =6.7 ), 1,20-1,41 м [14Н, (СН2)7СН3], 1.65-1.75 м (2Н,ОСН2СН2 цепи), 2,54 -2.64 м (4Н, NСН2 кольца), 3.58 с (NСН3), 3.61-3.70 м (8Н, NСН2 у кольца и СН2 пиперидина), 4.73 т (2Н, ОСН2 СН2, J=6,8), 5.05 с и 5.09 с (4Н, N+СН2). |
|
IX |
2.55-2.65 м (6Н, NСН2 пиперидина), 3.61 с (NСН3), 3.65-3.71 м (6Н, NСН2 у кольца и СН2 пиперидина), 3.90 с (3Н, ОСН3), 5.07 с и 5.09 с (4Н, N+СН2). |
Экспериментальная биологическая часть
Антибактериальную активность соединений I-IX изучали по методике [7], при бактериальной нагрузке 20 мм микробных тел на 1 мл среды. В опытах использовали грамположительные стафилококки (Staphylococcus aureus 209p, 1) и грамотрицательные палочки (Sh. Flexneri 6858, E. Coli 0-55). Соединения испытывали в концентрации 1:20, приготовленной 0.9 % раствором хлорида натрия. Контрольный препарат использовали при соответствующей концентрации в ДМСО.
В чашках Петри с посевами вышеуказанных штаммов микроорганизмов наносили испытуемые вещества по 0.1 мл. Учет результатов проводили по диаметру (d, мм) зоны отсутствия роста микробов на месте нанесения соединений после суточного выращивания тест-культур в термостате при 37 ОС. В качестве положительного контроля в аналогичных условиях использовали лекарственный препарат фуразолидон [5] (производство ОАО «Борисовский завод медицинских препаратов», Республика Беларусь, г. Борисово).
Исследования показали, что испытуемые соединения, кроме (II), обладают антибактериальной активностью. При этом степень проявления активности полностью зависит от характера радикалов у аммонийного азота. Так, соедиение (II), содержащее метоксикарбонилметильную группу, как это было уже отмечено, лишено антибактериальной активности, а соедиение (IX) с той же группой проявляет слабую активность , подавляя рост микробов в зоне диаметром 10-13 мм (табл 1). Выраженную активность проявляет вещество с фенацильную группой (I) (d=21-23 мм), а соединения, содержащие в метоксикарбонилметильном фрагменте группы от С8 до С12 (III-VIII) обладают высокой активностью в отношении грамположительных микроорганизмов (d=24-34 мм), а среди них наиболее активным является вещество (V) (d=24-34мм) с децилоксикарбонильной группой у аммонийного азота. Данное соединение по активности к стафилококкам значительно превосходит контрольный препарат фуразолидон. В отношении грамотрицательных микроорганизмов активность исследуемых соединений несколько ниже (d=17-22 мм). Следует отметить, что соединения (III-VIII) по активности не уступают контрольному препарату фуразолидону (d=24-25мм). Данные антибактериальной активности синтезированных соедиений I-IX приведены в табл. 3.
Таким образом, на основании полученных результатов и выявления связи между структурой и антибактериальной активностью исследуемых соединений, обосновывается целесообразность поиска новых, более эффективных соединений в ряду аминоаммониевых солей, содержащих 2,3-дибром-2-бутениленовую общую группу.
Таблица 3
Антибактериальная активность аммониевых солей I- IX
|
№ Соединения |
Диаметр зоны угнетения роста микробов (мм) |
|||
|
Staphylococcous aureus |
Sh. Flexneri 6858 |
E.Coli. 0-55 |
||
|
209 |
1 |
|||
|
I |
21 |
23 |
12 |
10 |
|
II |
0 |
0 |
0 |
0 |
|
III |
25 |
24 |
18 |
17 |
|
IV |
29 |
28 |
22 |
22 |
|
V |
34 |
33 |
24 |
26 |
|
VI |
27 |
26 |
20 |
18 |
|
VII |
22 |
25 |
15 |
15 |
|
VIII |
26 |
24 |
22 |
20 |
|
IX |
13 |
12 |
12 |
10 |
|
Фуразолидон |
25 |
24 |
24 |
23 |
Библиографическая ссылка
Манукян М.О., Петросян А.М., Барсегян К.С., Гюльназарян А.Х., Бабаханян А.В., Степанян Г.М., Пароникян Р.В. СИНТЕЗ И АНТИБАКТЕРИАЛЬНАЯ АКТИВНОСТЬ 1,4-АМИНОАММОНИЕВЫХ СОЛЕЙ С ОБЩЕЙ 2,3-ДИБРОМ-2-БУТЕНИЛЕНОВОЙ ОБЩЕЙ ГРУППОЙ // Успехи современного естествознания. 2014. № 12-4. С. 389-392;URL: https://natural-sciences.ru/ru/article/view?id=34617 (дата обращения: 06.02.2026).



