Накопленные и постоянно образующиеся на территории ГОКов техногенные водоемы по объемам и концентрациям тяжелых и цветных металлов можно классифицировать как техногенное гидроминеральное сырье, переработка которого позволит более полно использовать природные минеральные ресурсы и повысить рентабельность горнопромышленных производств [2].
Проведенные аналитические исследования кислых рудничных вод горнопромышленного комплекса Южного Урала показали, что наряду с высоким содержанием таких металлов как медь, цинк и железо, данные воды характеризуются так же и высоким содержанием ионов марганца (до 250 мг/дм3), что позволяет считать данные воды техногенными источниками соединений марганца. Целесообразность селективной переработки техногенных марганецсодержащих гидроресурсов ГОКов обусловлена тем, что после распада СССР основные месторождения многих видов минерального сырья, в частности богатые месторождения марганца, остались за пределами России (Украина, Грузия и др.). В связи с этим на сегодняшний день в России остро стоит вопрос об изыскании дополнительных источников получения различных соединений марганца, широко используемых в металлургической и других областях промышленности.
Наиболее перспективным направлением в технологии водоочистки являются электрохимические методы. Данные методы позволяют максимально концентрировать и извлекать ценные компоненты из технических растворов. При этом, они являются экологически чистыми, исключающими «вторичное» загрязнение воды анионными и катионными остатками, характерными для реагентных методов [1, 5].
Авторами данной работы для извлечения Mn (II) из кислых рудничных вод, исходя из количественного Cl– анионного состава рудничных вод (СCl- до 690 мг/дм3), предлагается сочетание двух электрохимических методов – электрокоагуляции и электрофлотации.
Сущность предлагаемого метода заключается в следующем: при электрообработке хлоридсодержащих растворов, образуется молекулярный хлор, который взаимодействуя с водой, образует активные формы хлорсодержащих окислителей, так называемый «активный хлор» [3]. Далее, при контакте «активного хлора» с Mn (II) протекает окислительно-восстановительный процесс в ходе, которого ионы Mn2+ окисляются до нерастворимых форм Mn3+ и Mn4+:
2Cl- – 2e → Cl2,
Cl2 + H2O → H+ + Cl- + HClO,
Мn2+ + НСlО + Н+ → Сl− + Мn3+ + Н2О.
Анализ опыта использования «активного хлора» в качестве окислителя при окислении переходных металлов показал, что процесс окисления протекает под действием атомарного кислорода, образующегося при восстановлении «активного хлора» ионами Mn2+ [6, 7, 8]:
Mn2+
НСlО → НСl + О•
Выбор электрофлотационного метода для извлечения образующегося марганец-содержащего осадка обусловлен отличительными особенностями извлекаемых катионов марганца, а именно: хрупкостью коллоидных хлопьев марганца, способностью к передиспергированию при интенсивном перемешивании суспензии, необходимостью проведения флотации при низкой скорости газового потока [2, 4]. С этой точки зрения электрофлотационный процесс, отличающийся высокой степенью дисперсности выделяющихся пузырьков, отсутствием в аппаратах движущихся частей, а так же возможностью плавного регулирования скорости изменения степени насыщения пульпы газовыми пузырьками, имеет явные преимущества по сравнению с другими флотационными методами извлечения металлсодержащих осадков. Кроме того, сочетания процессов осаждение – флотация позволяет достигать высоких показателей извлечения марганца из растворов в виде кондиционного сырья [1, 2].
Экспериментальные исследования по извлечению марганца из растворов в двухкамерном бездиафрагменном электролизере (рис. 1) на модельных растворах Mn (II) с исходным содержанием хлорид-ионов 600 мг/дм3.
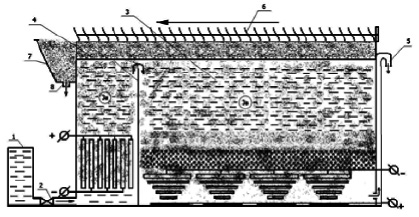
Рис. 1. Конструкция электрофлотатора: 1 – емкость для перерабатываемых растворов; 2 – насос; 3 – электрофлотатор; 3а, 3в – первая и вторая камеры аппарата; 4 – перегородка, разделяющая первую и вторую камеры; 5 – патрубок для стока отработанного раствора; 6 – скребок транспортер; 7 – пеносборник; 8 – патрубок для удаления флотошлама
В первой камере аппарата протекает процесс окисления Mn2+ в Mn3+ и Mn4+ и последующего электрокоагуляционного осаждения соединений марганца. Во второй камере аппарата осуществляли процесс электрофлотационного извлечения дисперсной фазы марганца из водных растворов.
При проведении исследований было установлено, что в первой камере аппарата полное извлечение ионов Mn2+ из раствора в процессе окислительного осаждения наблюдается в интервале рН системы от 4,5 до 10,5. Однако следует учесть, что при электролизе хлоридсодержащих растворов на аноде возможно образование несколько активных формы хлорсодержащих окислителей: Сl2, НСlО, СlО–, окислительная активность которых будет зависеть от рН растворов. Максимальная окислительная активность характерна для хлорноватистой кислоты (НСlО), накопление которой наблюдается в диапазоне рН 3,5 – 7,5, т.е. в слабокислой и нейтральной областях. Следовательно, исходя из интервала рН, при котором возможно образование дисперсной фазы Mn, а так же учитывая окислительную активность, образующихся хлорсодержащих соединений процесс окислительного осаждения Mn (II) рекомендуется осуществлять в диапазоне рН от 4,5 до 7,5.
Экспериментальные исследования оптимальных параметров работы электролизера при электрокоагуляционном извлечении Mn (II) позволили установить, что процесс электрокоагуляции в диапазоне рН 4,5 – 7,5 при электрообработке в течении 1 минуты более рационально проводить при концентрации ионов Cl− в растворе не менее 600 мг/дм3 и плотности тока на анодах 300 А/м2 .
Экспериментальные исследования процесса электрофлотационного извлечения дисперсной фазы Mn (III,IV), протекающего во второй камере аппарата, показали что, максимальное извлечение осадка из растворов (до 98,9 %) наблюдаются в интервале рН 4,5 − 8,0. Оценка влияния на процесс флотации токовой нагрузки подаваемой на электроды, показала, что в диапазоне плотностей тока на катодах (Isк) 80 − 100 А/м2 после десяти минут проведения процесса электрофлотации наблюдается максимальное извлечение дисперсной фазы марганца – 98,9 % [2, 4] .
Результаты исследования процесса электрокоагуляционного извлечения Mn (II) из многокомпонентных водных систем, содержащих ионы: Мn2+, Fе2+, Fе3+ и Cu2+ показали, что процесс не является селективным по отношению к катионам железа и меди. Поэтому, при разработке технологии селективного извлечения ионов Mn2+ из кислых рудничных вод ГОК медноколчеданных месторождений необходимо предусмотреть комплекс последовательно выполняемых операций, включающий процессы предварительного стадиального извлечения ионов меди и железа [4].
Для извлечения ионов меди целесообразно использовать гальванические процессы, которые в виду существенной разницы в значениях стандартных электродных потенциалов данных металлов (φ0Мn = −1,18В, φ0Сu = + 0,34В) позволят селективно извлечь медь из кислых подотвальных вод ГОКов не изменяя при этом концентрацию ионов Mn2+ в водных системах. Для извлечения железа эффективно применение метода кислотно-основного осаждения, т.к. при рН = 4,0 железо практически полностью осаждается в виде гидроксида.
Анализ данных полученных в результате применения комбинированной технологии на реальных кислых подотвальных водах ГОКа Южного Урала позволил сделать следующие выводы: предлагаемая комплексная технология достаточно проста, эффективна, не требует сложного аппаратурного оформления; может использоваться как самостоятельно, так и в системе существующих очистных сооружений. Предлагаемая технология может быть использована для организации замкнутого цикла водоснабжения на ГОКах медно-колчеданного комплекса.
Библиографическая ссылка
Мишурина О.А. ХИМИЧЕСКИЕ ЗАКОНОМЕРНОСТИ ПЕРЕРАБОТКИ ТЕХНОГЕННЫХ ВОД С ЦЕЛЬЮ ИЗВЛЕЧЕНИЯ МЕДИ, МАРГАНЦА И ЖЕЛЕЗА // Успехи современного естествознания. 2014. № 12-4. С. 393-395;URL: https://natural-sciences.ru/ru/article/view?id=34618 (дата обращения: 06.02.2026).



