Отличительной особенностью инфекционной урогенитальной патологии в настоящее время является возрастающая роль условно-патогенных микроорганизмов. Отсутствие специфической картины воспаления, во многих случаях бессимптомное течение осложняют диагностику этих заболеваний, что приводит к хронизации процесса, неблагоприятно влияет на репродуктивную функцию, снижает качество жизни. Число оппортунистических инфекций генитального тракта у женщин репродуктивного возраста неуклонно увеличивается, динамично меняется их этиологическая структура и чувствительность к антибиотикам [1, 2, 7, 8]. Особенностью микробиологической диагностики в настоящее время является необходимость четкой довидовой идентификации микроорганизмов. Например, показано, что разные виды лактобактерий имеют неодинаковое значение в патологическом процессе во влагалище: одни виды способствуют поддержанию здоровой среды, другие запускают процесс бактериального вагиноза (Lactobacillus iners) [3, 6, 9]. Поэтому внедрение метода MALDI-TOF (время-пролетной мaсс-спектрометрии) рибосомальных белковых фракций в практическую работу бактериологических лабораторий является крайне перспективным и открывает новые возможности диагностики микробиоты (гемофилы, нейссерии, культивируемые лактобактерии, коринебактерии). Данная методика почти не требует затрат на реактивы и расходные материалы. Сроки идентификации сокращаются при этом на 24–72 часа [3].
Выделение условно-патогенной микрофлоры из патологического материала еще не является доказательством их этиологической роли, так как те же самые микроорганизмы колонизируют влагалище в норме (табл. 1).
Таблица 1
Нормальная микробиота влагалища женщин репродуктивного возраста [составлено по 1, 2]
|
Встречаются более чем у 50 % женщин |
Встречаемость у 10-50 % женщин |
||
|
Микроорганизмы |
Титр, КОЕ/мл |
Микроорганизмы |
Титр, КОЕ/мл |
|
Lactobacillus spp. в титре |
106-109 |
Esсherichia coli |
102-103 |
|
Peptostreptococcus spp. |
103-104 |
Gardnerella vaginalis |
102-103 |
|
Сorynebacterium spp. |
103-104 |
Candida albicans |
102-103 |
|
Стрептококки группы viridans |
103-104 |
Mycoplasma hominis |
102-103 |
|
Коагулазонегативные стафилококки |
104-105 |
Ureaplasma urealyticum |
102-103 |
|
Micrococcus spp. |
103-104 |
Neisseria spp. |
103-104 |
|
Propionibacterium spp. |
103-104 |
Bifidobacterium spp. |
105-106 |
|
Porphyromonas spp. |
102-103 |
Actinomyces spp. |
102-103 |
|
Bacteroides spp. |
102-103 |
Fusobacterium spp. |
102-103 |
|
Prevotella spp. |
102-103 |
Clostridium spp. |
103-104 |
При исследовании отделяемого влагалища, в норме имеющего разнообразную микробиоту, большое значение придается оценке видового состава, количественной оценке роста различных видов, выросших при первичном посеве, однотипности результатов при повторных исследованиях, а также клиническим данным. Только учет количественных соотношений отдельных видов микроорганизмов в составе микробиоты может характеризовать состояние вагинального микроценоза и степень его нарушения [1, 2, ].
У женщин бактериологическое исследование на факультативно-анаэробную группу и микроаэрофилы отделяемого влагалища позволяет выявить следующие нарушения в микробиоценозе влагалища: неспецифический (аэробный) вагинит, бактериальный вагиноз (G. vaginalis), вульвовагинальный кандидоз, вагиниты, ассоциированные с уреаплазмами и микоплазмами (табл. 2).
Таблица 2
Нарушения в составе микробиоты влагалища у женщин [составлено по 7, 8]
|
Заболевание |
Возбудители |
Титр, КОЕ/мл |
|
Аэробный вагинит (АВ) |
Энтеробактерии: E. coli, Klebsiella spp., Proteus spp. НФБ: P.aeruginosa Стафилококки: S.aureus Стрептококки: S.agalactiae Энтерококки: E.faecalis |
> 104
≥ 102 ≥ 102 ≥ 102 ≥ 104 |
|
Бактериальный вагиноз (БВ) |
Полимикробный синдром: G. vaginalis Анаэробы: Bacteroides spp.Prevotella spp. Peptostreptococcus spp. Mobiluncus spp. Atopobium vaginae
Микоплазмы: M. hominis Лактобактерии со сниженными протективными свойствами (L. iners) Бактериальные биопленки |
≥ 104 ≥ 106 ≥ 106 ≥ 106 ≥ 106 наличие в любом титре ≥ 104 |
|
Вульвовагинальный кандидоз |
Грибы: C.albicans
Candida non-albicans |
≥ 104 ≥ 104 КОЕ/мл |
|
Вагиниты, ассоциированные с микоплазмами |
Ureaplasma urealyticum Ureaplasma parvum M. hominis |
≥ 104 ≥ 104 ≥ 104 |
Цель исследования. Изучить качественный и количественный состав факультативно-анаэробной и микроаэрофильной микробиоты влагалища женщин репродуктивного возраста с жалобами разного характера, включая воспалительную реакцию во влагалище, при комплексном микробиологическом исследовании с идентификацией микроорганизмов методом время-пролетной масс-спектрометрии.
Материалы и методы исследования
Проведено комплексное клинико-лабораторное обследование 373 пациенток в возрасте от 18 до 45 лет (средний возраст 31,4 ± 0,5 года), обратившихся на консультативный прием с жалобами на гнойные или слизистые выделения, дискомфорт, зуд наружных половых органов, диспареунию. Все пациентки перед исследованием подписывали информированное согласие. Комплексное микробиологическое исследование влагалищного отделяемого включало: микроскопию мазков (окрашенных по Граму) и культуральное исследование отделяемого влагалища. При оценке мазков учитывали количественное и качественное состояние вагинального эпителия, лейкоцитарную реакцию, разнообразие морфотипов бактерий, наличие дрожжеподобных клеток и псевдомицелия, «ключевых» клеток. Для культурального исследования взятие отделяемого влагалища проводили стерильным вискозным тампоном в пробирку с твердой транспортной средой Amies (Италия) с углем. Первичный посев с полуколичественной оценкой роста микроорганизмов проводили на селективные и дифференциально-диагностические питательные среды: 5 % кровяной агар, агар MRS для лактобактерий и агар Сабуро для грибов. Степень микробной обсемененности определяли в пересчете на тампон – КОЕ/т [4]. Все посевы культивировали по стандартной методике при температуре 36 °С в течение 24–48 часов. Культивирование микроаэрофилов осуществляли в СО2 инкубаторе при 5 % концентрации углекислого газа.
Для исследования на облигатные патогены использовали наборы реагентов с гибридизационно-флуоресцентной детекцией в режиме «реального времени» «АмплиСенс N. gonorrhoeae, C. trachomatis, M. genitalium, T. vaginalis Мультипрайм-FL» (ФБУН «ЦНИИ Эпидемиологии» Роспотребнадзора, Москва) в соответствии с инструкцией производителя. Из исследования были исключены 7 женщин с инфекциями, передающимися половым путем (ИППП), вызванными C. trachomatis, T. vaginalis, M. genitalium.
Идентификация выделенных культур микроорганизмов проводилась на анализаторе VITEK MS (BioMerieux, Франция) методом MALDI – TOF (матричная лазерная время-пролетная масс-спектрометрия) с последующим анализом спектра с помощью базы данных VITEK MS.
Для выявления микоплазм и уреаплазм использовались коммерческие наборы для полуколичественной оценки Mycoplasma IST 2 с определением чувствительности к антибиотикам (BioMerieux, Франция).
Результаты исследования и их обсуждение
При бактериологическом исследовании микробиоты влагалища у пациенток с жалобами разного характера наиболее часто выделялись: лактобактерии (69,9 %), дрожжеподобные грибы рода Candida (19,1 %), грамотрицательные палочки семейства Enterobacteriaceae (18,8 %), грамположительные, факультативно-анаэробные кокки рода Staphylococcus (19,1 %), Streptococcus (13,1 %), Enterococcus (10,4 %), микро-аэрофильные коккобациллы G.vaginalis (13,7 %), грамположительные палочки рода Corynebacterium (3,6 %), грамотрицательные палочки рода Haemophilus (0,5 %). Ureaplasma spp. были обнаружены у 9,3 % пациенток, M. hominis – 3,6 %, ассоциации Ureaplasma spp. и M. hominis – 3,8 %. Среди отдифференцированных видов лактобактерий в микробиоте пациенток (n = 366) доминировали L.crispatus (9 %), L. jensenii (8,2 %), L.gasseri (5,5 %). В меньшей степени встречались L. acidophillus, L. delbrueckii, L. fermentum, L. salivarius, L. rhamnosus. У 52,9 % пациенток лактобактерии выделялись в высоких титрах (107 КОЕ/т), у 16,7 % в низких титрах (105 КОЕ/т), у трети пациенток (30,4 %) рост культивируемых лактобактерий отсутствовал. Доля пациенток, у которых выделялась только нормобиота, составила 41,5 %.
Полная информация о микробиоте влагалища пациенток, идентифицированной методом масс-спектрометрии, представлена в табл. 3.
У 72,7 % из 366 пациенток при микроскопии нативных мазков обнаружена лейкоцитарная реакция (более 10 лейкоцитов в поле зрения). Умеренное количество лейкоцитов в мазках (10–20 в поле зрения) наблюдалось у 19,9 %, большое количество (20–80 в поле зрения) у 41 % и резко выраженная лейкоцитарная реакция более 80 лейкоцитов в поле зрения) – у 11,7 %. Количество лейкоцитов в мазках в пределах нормы (до 10 в поле зрения) отмечено у 27,3 % пациенток.
Анализ результатов показал, что у пациенток с лейкоцитарной реакцией в микробиоте влагалища достоверно чаще выявлялся S. aureus (3,8 %), инфицирование факультативно-анаэробными бактериями (энтеробактерии, St. agalactiae, E. faecalis) с инфекционным индексом 2 (3,8 %), а также L. gasseri (6,8 %), p ≤ 0,05. У 13,5 % пациенток с лейкоцитарной реакцией выделялись, помимо нормальной микробиоты, только дрожжеподобные грибы рода Candida, преимущественно C. albicans. В 3,8 % грибы рода Candida сочетались с другими УПМ в диагностически значимых титрах (E. coli, Kl. pneumoniae, St. agalactiae, St. aureus, E. faecalis, Citrobacter koseri).
Таблица 3
Факультативно-анаэробная и микроаэрофильная микробиота влагалища у женщин репродуктивного возраста с воспалительной реакцией и без нее (n = 366)*
|
Семейство/род |
Микроорганизмы |
С лейкоцитарной реакцией (n = 266) |
Без лейкоцитарной реакции (n = 100) |
Всего культур (n = 366) |
|||
|
абс. |
% |
абс. |
% |
абс. |
% |
||
|
Streptococcaceae р. Streptococcus |
Streptococcus agalactiae |
20 |
7,5 |
7 |
7,0 |
27 |
7,4 |
|
Str. anginosus |
12 |
4,5 |
3 |
3,0 |
15 |
4,1 |
|
|
Str. mitis |
1 |
0,4 |
1 |
1,0 |
2 |
0,5 |
|
|
Str. salivarius |
1 |
0,4 |
0 |
0 |
1 |
0,3 |
|
|
Str. vestibuliaris |
1 |
0,4 |
0 |
0 |
1 |
0,3 |
|
|
Str. infantarius |
1 |
0,4 |
0 |
0 |
1 |
0,3 |
|
|
Str. galloticus |
0 |
0,0 |
1 |
1,0 |
1 |
0,3 |
|
|
Всего |
36 |
14,4 |
12 |
12,0 |
48 |
13,1 |
|
|
р. Enterococcus |
Enterococcus faecalis |
28 |
10,5 |
10 |
10,0 |
38 |
10,4 |
|
Micrococcaceae р. Staphylococcus |
St. aureus |
10 |
3,8** |
1 |
1,0 |
11 |
3,0 |
|
St. hominis |
2 |
0,8 |
0 |
0 |
2 |
0,5 |
|
|
St. epidermidis |
30 |
11,3 |
16 |
16,0 |
46 |
12,6 |
|
|
St.lugdunensis |
4 |
1,5 |
0 |
0 |
4 |
1,1 |
|
|
St. haemolyticus |
4 |
1,5 |
3 |
3,0 |
7 |
1,9 |
|
|
Всего |
50 |
20 |
20 |
20,0 |
70 |
19,1 |
|
|
Enterobacteriaceae |
Escherichia coli |
37 |
13,9 |
16 |
16,0 |
53 |
14,5 |
|
Enterobacter aerogenes |
4 |
1,5 |
2 |
2,0 |
6 |
1,6 |
|
|
Enterobacter.cloacаe |
0 |
0,0 |
1 |
1,0 |
1 |
0,3 |
|
|
Klebsiella pneumoniae |
8 |
3,0 |
0 |
0 |
8 |
2,2 |
|
|
Citrobacter koseri |
1 |
0,4 |
0 |
0 |
1 |
0,3 |
|
|
Всего |
50 |
20 |
19 |
19,0 |
69 |
18,8 |
|
|
Дрожжеподобные грибы |
C. albicans |
48 |
18,0 |
14 |
14,0 |
62 |
16,9 |
|
C. tropicalis |
0 |
0,0 |
1 |
1,0 |
1 |
0,3 |
|
|
С. parapsilosis |
0 |
0,0 |
1 |
1,0 |
1 |
0,3 |
|
|
C. krusei |
1 |
0,4 |
0 |
0 |
1 |
0,3 |
|
|
C. dublinensis |
2 |
0,8 |
0 |
0 |
2 |
0,5 |
|
|
C. glabrata |
3 |
1,1 |
0 |
0 |
3 |
0,8 |
|
|
Всего |
54 |
21,6 |
16 |
16,0 |
70 |
19,1 |
|
|
р. Corynebacterium |
C. spp. |
5 |
1,9 |
3 |
3,0 |
8 |
2,2 |
|
C. gluconorolyticum |
1 |
0,4 |
0 |
0 |
1 |
0,3 |
|
|
C. amycolatum |
0 |
0,0 |
2 |
2,0 |
2 |
0,5 |
|
|
C. aurimucorum |
1 |
0,4 |
0 |
0 |
1 |
0,3 |
|
|
C. coyleae |
1 |
0,4 |
0 |
0 |
1 |
0,3 |
|
|
Всего |
8 |
3,2 |
5 |
2 |
13 |
3,6 |
|
|
р. Haemophilus |
H. influenzae |
1 |
0,4 |
0 |
0 |
1 |
0,3 |
|
H. haemolyticus |
1 |
0,4 |
0 |
0 |
1 |
0,3 |
|
|
Всего |
2 |
0,8 |
0 |
0 |
2 |
0,5 |
|
|
Gardnrella |
G. vaginalis |
38 |
14,3 |
12 |
12,0 |
50 |
13,7 |
|
Lactobacillus |
Lactobacillus spp. |
104 |
39,1 |
46 |
46,0 |
150 |
41,0 |
|
L. acidophillus |
8 |
3,0 |
3 |
3,0 |
11 |
3,0 |
|
|
L. crispatus |
26 |
9,8 |
7 |
7,0 |
33 |
9,0 |
|
|
L. delbrueckii |
4 |
1,5 |
1 |
1,0 |
5 |
1,4 |
|
|
L. fermentum |
2 |
0,8 |
0 |
0 |
2 |
0,5 |
|
|
L. gasseri |
18 |
6,8** |
2 |
2,0 |
20 |
5,5 |
|
|
L. jensenii |
21 |
7,9 |
9 |
9,0 |
30 |
8,2 |
|
|
L. salivarius |
4 |
1,5 |
0 |
0 |
4 |
1,1 |
|
|
L. rhamnosus |
0 |
0,0 |
1 |
1,0 |
1 |
0,3 |
|
|
Всего |
187 |
74,8 |
69 |
69,0 |
256 |
69,9 |
|
|
Микст-инфицирование |
Факультативно-анаэробные микроорганизмы (х2) |
10 |
3,8** |
1 |
1,0 |
11 |
3,0 |
|
Факультативно-анаэробные/Грибы |
10 |
3,8 |
12 |
12,0 |
22 |
6,0 |
|
|
Факультативно-анаэробные/Микроаэрофилы |
3 |
1,1 |
4 |
4,0 |
7 |
1,9 |
|
|
Микроаэрофилы/ Грибы |
8 |
3,0 |
1 |
1,0 |
9 |
2,4 |
|
|
Ассоциации с Ureaplasma spp. |
22 |
8,3 |
5 |
5,0 |
27 |
7,4 |
|
|
Ассоциации с Ureaplasma spp./ Mycoplasma hominis |
8 |
3,0 |
4 |
4,0 |
12 |
3,3 |
|
|
Всего |
61 |
22,9 |
27 |
27,0 |
88 |
24,0 |
|
Примечание. * – поливариантный признак; ** – различия между группами пациенток с лейкоцитарной реакцией и без нее, p ≤ 0,05.
В 3,0 % случаев имело место микст-инфицирование влагалища грибами рода Candida и G. vaginalis. У 9,0 % женщин выделялась G. vaginalis в высоких титрах, причем в двух случаях обнаруживались также Corynebacterium aurimucorum и Corynebacterium simylans в высоких титрах, в трех случаях – St. anginosus. В трех случаях (1,1 %) наблюдалось микст-инфицирование влагалища G.vaginalis и E. coli. У 11,3 % пациенток в ассоциациях с факультативно-анаэробными микроорганизмами участвовали Ureaplasma spp. и M. hominis. Наиболее часто (31,6 %) у пациенток с лейкоцитарной реакцией в диагностически значимых титрах (более 104 КОЕ/т) в монокультуре выделялись микроорганизмы семейства Enterobacteriaceae: E. coli (у 9,4 %), Kl. pneumoniae (1,5 %), реже Enterobacter aerogenes (0,4 %), а также представители семейства Streptococcaceae: St. agalactiae (5,3 %) и E. faecalis (7,9 %). У 52,5 % пациенток с выраженной лейкоцитарной реакцией условно-патогенные микроорганизмы выделялись в титрах 104–107 КОЕ/т, у 41,5 % пациенток – в высоких титрах 108–109 КОЕ/т. Дрожжеподобные грибы рода Candida в 1,4 раза чаще встречались в группе пациенток с лейкоцитарной реакцией (21,6 %). C. krusei, C. dublinensis, C. glabrata выделялись только в этой группе.
Среди пациенток без лейкоцитарной реакции доля женщин с нормобиотой составила 51,0 % (достоверно выше, чем в группе с лейкоцитарной реакцией, p ≤ 0,05). У пациенток без лейкоцитарной реакции (менее 10 лейкоцитов в поле зрения) в половых путях часто выделялись в титре более 104 КОЕ/т дрожжеподобные грибы рода Candida (16 %), при этом обычно в ассоциациях с другими условно-патогенными возбудителями (в 13 %): E. coli, St. agalactiae, E. faecalis, G. vaginalis, S. aureus.
У 30,4 % пациенток, у которых отсутствовал рост лактобактерий, нормобиота замещалась в 10,9 % G. vaginalis, в 7,7 % – энтеробактериями, в 4,9 % – дрожжеподобными грибами рода Candida, реже S. agalactiae (2,5 %), E. faecalis (3,0 %) и S. aureus (1,4 %).
Заключение
Задачей культурального исследования является не только идентификация микроорганизмов, обнаруженных в клиническом материале, но и обоснование их этиологической роли в воспалительном процессе у данного больного. При этом важна объективная и комплексная оценка микроскопии клинического материала, результатов прямого посева на плотные питательные среды, клинико-анамнестических данных (рисунок).
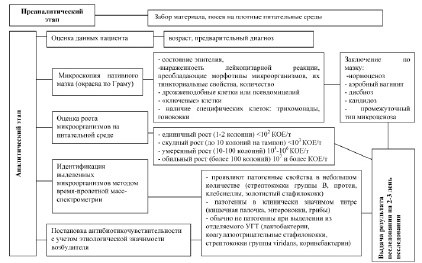
Алгоритм микробиологического исследования отделяемого влагалища у женщин
Метод, основанный на масс-спектрометрическом профилировании рибосомальных белков микроорганизмов, позволил провести довидовую идентификацию культивируемых лактобактерий, коринебактерий, стрептококков группы viridans (всего 108 культур), которые обычно в рутинной практике лабораторий идентифицируются только до рода. Встречаемость микробных ассоциаций из 2 условно-патогенных агентов, идентифицированных до вида, наблюдалась почти у каждой четвертой пациентки с воспалительным процессом урогенитального тракта. Это, в свою очередь, необходимо для накопления знаний и лучшего понимания роли условно-патогенных микроорганизмов в патологии урогенитального тракта.
Видовая идентификация культивируемых лактобактерий методом масс-спектрометрии позволила установить, что наиболее часто в составе микробиоты влагалища встречаются L. crispatus, L. jensenii и L. gasseri. Наши данные и другие проведенные исследования опровергают ранее существовавшее мнение о доминирующем положении L.acidophilus в видовом составе влагалищных лактобактерий [3, 5, 6, 9]. Это связано с тем, что фенотипические характеристики L. acidophilus и тесно связанных с ними 6 видов лактобактерий оказались весьма ненадежными [5]. Следует отметить, что у 30,4 % женщин отсутствовали культивируемые на MRS агаре лактобактерии, которые обеспечивают колонизационную резистентность влагалища и препятствуют чрезмерному размножению и транслокации условно-патогенных микроорганизмов. В то же время у 62,0 % пациенток (n = 366) с сохранной нормобиотой наблюдалась воспалительная реакция в половых путях и повышенные титры УПМ, что говорит о значительной роли местной иммунологической резистентности.
Библиографическая ссылка
Евстигнеева Н.П., Аминева П.Г., Герасимова Н.А., Зильберберг Н.В., Кунгуров Н.В. МИКРОБИОТА УРОГЕНИТАЛЬНОГО ТРАКТА ПАЦИЕНТОК РЕПРОДУКТИВНОГО ВОЗРАСТА, ИДЕНТИФИЦИРОВАННАЯ НА ОСНОВЕ МАСС-СПЕКТРОВ РИБОСОМАЛЬНЫХ БЕЛКОВ // Успехи современного естествознания. 2015. № 2. С. 34-39;URL: https://natural-sciences.ru/ru/article/view?id=34696 (дата обращения: 10.02.2026).



