Актуальность. В настоящее время ежегодно диагноз рака в мире ставится миллионам людей, при этом патогенетически обоснованное лечение отсутствует из-за полностью противоречивых данных по этиологии и механизмам малигнизации [12, 16, 17]. На современном этапе не решён вопрос происхождения бесконтрольно и нерегулируемо размножающихся клеток в составе опухолей [3]. Молекулярно-генетические исследования направлены на поиск путей трансформации генома и превращения нормальных клеток в раковые под воздействием различных факторов [2]. Также выдвинута концепция существования раковых клеток в организме человека [19]. Попытки провести фенотипирование клеток различных опухолей являются единичными. По поводу основных заболеваний, являющихся показаниями для резекции желудка (РЖ), например опухолевых поражений желудка, а также язвенной болезни желудка и 12-перстной кишки, – только в нашей стране ежегодно производится более 120000 операций. Частота язвенных процессов и опухолей желудка в большинстве стран мира неуклонно увеличивается [1, 15]. Несмотря на высокую эффективность эрадикационной терапии, позволяющей в некоторых европейских странах оперировать лишь 0,02 % от числа таких больных в год, общей подобной тенденции пока не намечается. Все эти данные ставят в авангард по актуальности исследования, направленные на выявление факторов индукции апоптоза опухолевых клеток, так как именно нарушение апоптоза, по современным данным, лежит в основе патогенеза рака.
Цель. Повышение качества и эффективности лечения больных с ЖКТ-патологией групп риска с предполагаемой малигнизацией в плане оптимизации диагностического ресурса, врачебной тактики, профилактики онкогенеза.
Материалы и методы исследования
В работе использован 71 биоптат из различных отделов ЖКТ человека, в области границы здоровой ткани и формирования полипов, а также на фоне аденокарцином, язвы, рубцов, гастритов. Исследование было проведено в соответствии с положениями Хельсинкской декларации (2000) и с разрешением этического комитета ФГАОУ ВПО «Дальневосточный федеральный университет». Забор биоптатов слизистой оболочки различных отделов ЖКТ произведён по клиническим показаниям с письменного информированного согласия пациентов. Материал распределили по полу и возрастным группам (таблица, рис. 1), а также по наличию патологии (рис. 2).
Распределение клинического материала по возрастным группам и патологии ЖКТ
|
Пол/ количество |
Возраст |
Диагноз |
|||||||||
|
полипы |
язва |
гастрит |
метаплазия |
колит |
Болезнь крона, пищевод Баррета |
||||||
|
Возраст |
31–40 |
41–50 |
51–65 |
66–70 |
72–74 |
||||||
|
М/53 |
7 |
15 |
15 |
9 |
7 |
26 |
8 |
8 |
7 |
2 |
1/1 |
|
Ж/18 |
2 |
7 |
5 |
4 |
– |
9 |
4 |
1 |
4 |
– |
– |
|
Итого: 71 |
9 |
22 |
20 |
13 |
7 |
35 |
12 |
9 |
11 |
2 |
2 |
|
71 |
71 |
||||||||||
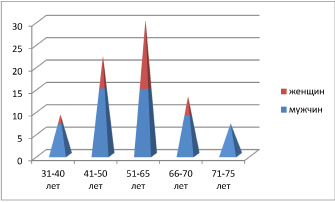
Рис. 1. Распределение клинического материала по возрасту и полу
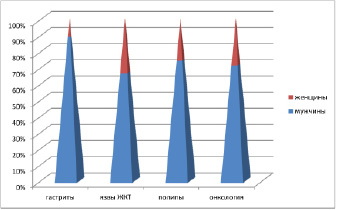
Рис. 2. Соотношение патологии по данным клинического материала у мужчин и женщин
Результаты исследования и их обсуждение
Анализ клинического материала показал, что во всех возрастных группах заболеваемость у мужчин выше, чем у женщин. При этом отмечено, что в возрастных группах до 50 лет выше показатели заболеваемости гастритами и язвами, после 50 лет преобладают полипы и новообразования (рис. 3, 4).
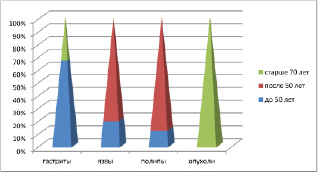
Рис. 3. Распределение клинического материала у женщин
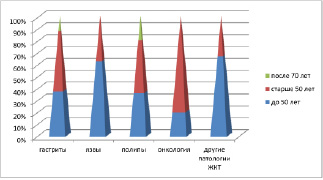
Рис. 4. Распределение клинического материала у мужчин
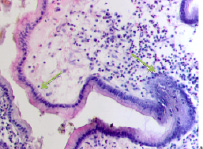
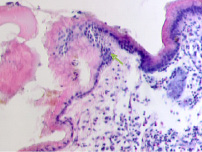
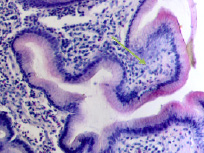
У женщин частота патологии ЖКТ, связанная с полипами, достигает 50 % в возрасте старше 50 лет, у мужчин она встречается в возрасте как до 50, так и в старших возрастных группах, соответствует 55 % среди всей патологии ЖКТ у мужчин (рис. 5, а, б, в, г). При этом морфологическая картина полипа характеризуется разрастаниями эпителия с подлежащей соединительной тканью, участками разрушения базальной мембраны в эпителиальной пластинке, инфильтрацией лейкоцитами и локальной повышенной пролиферацией эпителия, метаплазией, что диктует стратегию тотального удаления полипов.
а
б
в
г
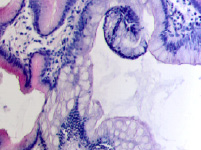
Рис. 5. а, б, в, г – полип желудка по малой кривизне у человека 64 лет. Окр. г/э. Микрофото. Ув. х200
Нами установлено, что язвенный процесс и формирование полипов связаны, прежде всего, с нарушением процесса реституции эпителиоцитов, повышенной пролиферативной активностью, сопровождающейся истощением камбиальных стволовых элементов покровного эпителия.
Нами отмечено, что при образовании полипа на поверхности слизистой оболочки морфологическая картина изменённой ткани характеризуется исчезновением базальной мембраны, апоптозом эпителиоцитов и миграцией в зону изменённой ткани клеток-мигрантов из крови (рис. 6, а–е).
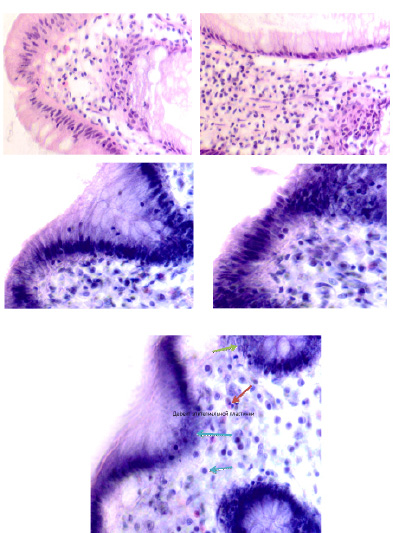
Рис. 6. (начало). Слизистая оболочка толстой кишки человека 55 лет на границе полипа и нормальной слизистой оболочки: а, б – базальная мембрана и эпителий идентифицируются. Инфильтрация соединительнотканной пластинки; в, г – базальная мембрана не идентифицируется, в эпителиальной пластинке высокая пролиферативная активность, инфильтрация прилежащей собственной пластинки слизистой оболочки, выход лейкоцитов на поверхность слизистой оболочки; д – отсутствует базальная мембрана, эпителиальная пластинка частично разрушена, сохранившийся эпителий с морфологическими признаками апоптоза (указано зелёной стрелкой). Клетки инфильтрата пролиферируют амитозом (д) (указано красными стрелками). Клетки мигранты идентифицируются как вблизи эпителиальной пластинки, так и на месте разрушенных эпителиоцитов, и за пределами эпителия на поверхности (указаны голубыми стрелками. Под звёздочкой отмечены апоптозирующие эпителиоциты. Микрофото. Ув. а, б х200; в, г х400; д, е х800
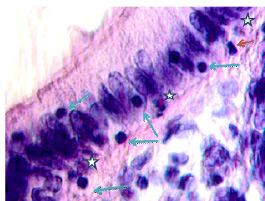
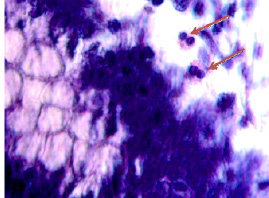
Рис. 6. (окончание). Слизистая оболочка толстой кишки человека 55 лет на границе полипа и нормальной слизистой оболочки: е – отсутствует базальная мембрана, эпителиальная пластинка частично разрушена, сохранившийся эпителий с морфологическими признаками апоптоза (указано зелёной стрелкой). Клетки инфильтрата пролиферируют амитозом (ж) (указано красными стрелками). Клетки-мигранты идентифицируются как вблизи эпителиальной пластинки, так и на месте разрушенных эпителиоцитов, и за пределами эпителия на поверхности (указаны голубыми стрелками. Под звёздочкой отмечены апоптозирующие эпителиоциты. Микрофото. Ув. а, б х200; в, г х400; д, е х800
Идентифицирующиеся клетки инфильтрата пролиферируют амитозом, могут идентифицироваться как вблизи эпителиальной пластинки, так и на месте разрушенных эпителиоцитов, а также за пределами эпителия на поверхности. Структура собственной пластинки слизистой оболочки не идентифицируется, что может быть связано как с гибелью клеток соединительной ткани, ответственных за выработку межклеточного вещества, так и вуалированием их элементами инфильтрата крови, состоящего из жидкой среды, содержащей мигранты.
При язвенном процессе, несмотря на нарушение реституции, возможно рубцевание за счёт структурных элементов подлежащей соединительной ткани, с закрытием дефекта и частичным выполнением барьерной функции со снижением или отсутствием пищеварительной. При формировании полипов процесс на фоне многолетнего развития заканчивается тотальным апоптозом, разрушением базальной мембраны, полным нарушением реституции. Это свидетельствует о различных репаративных свойствах покровного эпителия. В отсутствие камбия и молодых клеток эпителиального дифферона, сохраняющиеся некоторое время специализированные клетки, замещаются молодыми активно пролиферирующими стволовыми клетками не способными к дифференцировке на фоне отсутствия эпителиоцитов, выделяющих факторы созревания для клеток лимфоцитарного пула. От стволовых клеток крови элементы формирующейся опухоли отличаются в зависимости от полученной информации положения, химического и биофизического воздействия окружающей их изменённой среды. Поэтому геном и рецепторные белки цитомембраны клеток опуходи обладают уникальностью и отличаются от таковых на поверхности клеток-родоначальниц, при этом не изменяются физиологические свойства их как стволовых клеток.
На фоне тотального апоптоза камбиальных клеток покровных эпителиев стволовые клетки формирующейся опухоли не имеют программы клеточной гибели, более того, они устойчивы к воздействию химиопрепаратов и лучевой терапии, что убедительно доказано на примере стволовых клеточных культур.
Поэтому следует различать апоптоз камбия ткани, в результате возникающего дефекта которой формируется опухоль, состоящая из клеток, не способных апоптозировать. По нашему мнению, применение химиопрепаратов и лучевой терапии, способных вызывать гибель собственного камбия ткани, является патогенетически необоснованным в условиях формирования опухоли из клеток, не способных апоптозировать, и является усугубляющим канцерогенез воздействием, так как дополнительно усугубляет явления истощения камбия исходной ткани. Именно на поиск индукторов местного апоптоза необходимо направить совместные усилия морфологов, гистологов, иммунологов, биохимиков и биофизиков.
Заключение
Существующие предположения о том, что именно отсутствие апоптоза неполноценных мутировавших клеток даёт опухолевый рост, не получили подтверждения. Многочисленные исследования были направлены на поиск пусковых факторов канцерогенных мутаций и способов индукции апоптоза для предотвращения развития рака [6, 8, 10, 13]. Но выявленные факты о том, что собственный камбий и клетки, вступившие в дифференцировку, подвергаются тотальному апоптозу, показали, что, как и при лейкозе, наблюдающийся лейкемический провал – отсутствие промежуточных дифференцировочных звеньев в диффероне стволовых клеток [9], так и в любой другой ткани в условиях канцерогенеза существует клеточный провал определённых уровней дифференцировки клеток. На современном этапе принято считать, что белок р53 активируется при повреждениях генетического аппарата, а также при стимулах, которые могут привести к подобным повреждениям, или являются сигналом о неблагоприятном состоянии клетки (стрессовом состоянии) [4, 7, 11]. Белку р53 приписывается функция, состоящая в удалении из пула пролиферирующих клеток тех из них, которые являются потенциально онкогенными (отсюда образное название белка р53 –guardian of the genome – хранитель генома [5, 14, 18]. Но никто не показал убедительных доказательств именно канцерогенных изменений генома апоптозирующих клеток. Наличие отличающихся рецепторных белков могут являться отражением особой репрессии генов малигнизирующихся клеток. С учётом отсутствия реституции эпителиоцитов в период до наступления явных морфологических признаков неопластических процессов, трансформация в клетках связана, скорее всего, с нарушением регуляции синтеза сигнальных межклеточных мессенджеров. Об этом свидетельствует и миграция дендритных антигенпредставляющих клеток из эпителиальных пластинок в подлежащую соединительную ткань. И мы считаем, что данное утверждение как раз в связи с фактом потери функции белка р53, которая установлена в, примерно 50 % случаев злокачественных опухолей человека, неверно, так как участие в формировании опухоли стволовых клеток как раз и предполагает отсутствие в них белка р53. Поскольку установлено, что опухоль растёт не за счёт стволовых клеток самой ткани, а за счёт клеток-мигрантов из кровяного русла, то в канцерогенезе можно выделить два вида апоптоза: 1. Апоптоз камбия ткани. Он характеризуется тотальностью. 2. Отсутствующий или ингибированный апоптоз клеток-мигрантов, формирующих опухоль.
В регуляции активности белка р53 ведущая роль принадлежит посттрансляционным модификациям белка и его взаимодействиям с другими белками. Уменьшение концентрации свободных рибонуклеотидов, по нашему мнению, происходит потому, что создаются условия для гибели собственного камбия, который погибает под действием повреждающих факторов. Поэтому эти данные мы считаем ещё одним косвенным свидетельством уменьшения количества собственных стволовых клеток ткани и отсутствие их пролиферации при малигнизации.
Работа выполнена при поддержке научного фонда ДВФУ, в рамках государственного задания 2014/36 от 03.02.2014 г. и Международного гранта ДВФУ (соглашение № 13-09-0602-м от 6 ноября 2013 г.).
Библиографическая ссылка
Рева И.В., Рева И.В., Рева И.В., Рева Г.В., Рева Г.В., Ямамото Т., Толмачёв В.Е., Толмачёв В.Е., Ким А.Р., Ким А.Р., Калинин О.Б., Калинин О.Б., Калинин И.О., Калинин И.О., Фисенко А.Ю., Фисенко А.Ю., Грахова Н.В., Грахова Н.В., Грахова Н.В. АПОПТОЗ В КАНЦЕРОГЕНЕЗЕ // Успехи современного естествознания. 2015. № 2. С. 103-110;URL: https://natural-sciences.ru/ru/article/view?id=34710 (дата обращения: 06.03.2026).



