Хирургический метод лечения является основным методом лечения рака желудка (РЖ). Однако радикальность большинства стандартных операций носит условный характер в силу первичной распространенности процесса, в среднем у 75 % больных. Отдаленная выживаемость при только хирургическом методе лечения составляет около 20–30 % [1].
Дополнительное использование различных вариантов полихимиотерапии, при выраженной токсичности, улучшает результаты лечения только на 10 % [4, 10]. Внутрибрюшинное введение химиопрепаратов (ВБХ) после условно радикальной операции позволяет увеличить 3-летнюю выживаемость до 36 % [8].
Проведение дистанционной гамматерапии (ДГТ) способствует улучшению 3х-летних результатов лечения РЖ в среднем до 50 %. Однако авторы отмечают значительный процент лучевых реакций и осложнений, с сохранением частоты и характера генерализации процесса.
Поэтому целесообразна разработка менее токсичных и более эффективных режимов облучения с применением модификаторов, усиливающих повреждающее действие лучевого воздействия на опухоль [2, 5].
Одним из перспективных и широко внедряемых в практическое здравоохранение методов является озонотерапия, обладающая радиомодифицирующим воздействием, а в высоких концентрациях при парентеральном введении и противоопухолевым эффектом [6,7].
Цель исследования
Улучшить результаты лечения больных раком желудка за счет проведения разработанного адъювантного варианта химиолучевого лечения с использованием радиомодификаторов (препараты платины, озонотерапия).
Материалы и методы исследования
Под наблюдением находились 60 больных местно-распространенным РЖ T3-4N1-2M0 стадий после выполнения радикальных вмешательств. Основным объемом операции было выполнение гастрэктомии с расширенной лимфодиссекцией D2 – по 53,3 % в каждой группе. В остальных случаях были выполнены комбинированные операции различного объема.
По способу адъювантной терапии больные распределены на 2 сопоставимые по основным клиническим параметрам группы: 30 пациентов в основной и 30 в контрольной. Средний возраст составил 64,2 ± 5,5 лет. В основной группе соотношение мужчин и женщин составило 1,1:1, а в контрольной 2:1, что соответствует данным литературы [1; 5]. Наибольшее количество больных было с IIIA-B (T2-4N1-2M0) стадией процесса – в основной группе 20 из 30 (66,9 %) больных, в контрольной – 22 из 30 (73,3 %). IV (T4N1-2M0) стадия выявлена соответственно – у 7 из 30 (23,3 %) и 5 из 30 (16,7 %). С II стадией в каждой группе находилось по 3 из 30 (10 %) пациентов, которым в связи с неблагоприятными гистологическими формами была выполнена гастрэктомия с лимфодиссекцией D2.
В результате патоморфологического исследования после операции аденокарцинома различной степени дифференцировки установлена у 22 из 30 (73,3 %) больных в основной группе и у 20 из 30 (66,7 %) больных в контрольной. Из них низко- и недифференцированная аденокарцинома встречалась у 12 из 30 (40 %) и у 6 из 30 (20 %) больных в основной и контрольной группах соответственно. Перстневидноклеточный рак установлен у 8 из 30 (26,7 %) и у 10 из 19 (33,3 %) больных соответственно по группам.
В основной группе I этап адъювантного химиолучевого лечения (АХЛЛ) начинался через 2–3 недели после операции. В I день в лимфатические сосуды нижних конечностей по стандартной методике вводилось 5 мг метотрексата. С 4-го дня после топометрической подготовки (система «NUCLETRON») проводилась ДГТ на ложе удаленного желудка и пути регионарного метастазирования. Использовались трехпольное статическое облучение с тангенциальных прямоугольных полей и режим ускоренного фракционирования разовой очаговой дозой (РОД) по 1,2 Гр, подводимой дважды в день с интервалом между сеансами 5 часов. В 4, 8 и 12-й дни I этапа ДГТ через интраоперационно установленные микроирригаторы выполнялось внутрибрюшинное введение 50 мг/м2 оксалиплатина, разведенного на 250,0 мл 5 % раствора глюкозы «ex temporae», озонированной в течение 20 минут на аппарате УФООК «Надежда-О» по стандартной методике. После достижения суммарной очаговой дозы (СОД) 22 изоГр проводился запланированный 2-недельный перерыв в лечении.
II этап лечения также начинался с эндолимфатического введения 5 мг метотрексата, а ДГТ проводилась РОД по 1 Гр дважды в день с интервалом между сеансами 5 часов. На фоне облучения 1 раз в 4 дня через микроирригаторы выполнялось внутрибрюшинное введение 50 мг/м2 оксалиплатина на 250,0 мл – 5 % раствора озонированной глюкозы. Итого за полный курс лечения в основной группе СОД составила 40 изоГр, эндолимфатически введено 10 мг метотрексата и внутрибрюшинно введено 300 мг/м2 оксалиплатина.
В контроле больные через 3 недели после оперативного вмешательства получали от 4 до 6 курсов системной химиотерапии по схеме FOLFOX: оксалиплатин 85 мг/м2 2-часовая в/в инфузия в 1 день, 5 – фторурацил 400 мг/м2 в/в струйно, затем 600 мг/м2 в/в 22-часовая инфузия в 1, 2 дни, лейковорин 200 мг/м2 2-часовая в/в инфузия в 1, 2 дни, с интервалом между курсами 2 недели. В последующем все больные основной группы так же получили 4–6 курсов химиотерапии по аналогичной схеме.
Результаты исследования и их обсуждение
При расчетах продолжительности жизни больных и показателей выживаемости за точку отсчета принимали дату операции. Все больные были на диспансерном наблюдении и осматривались через каждые 3 месяца в течение первого года, затем каждые 6 месяцев. При анализе результатов лечения учитывались окончательные исходы – жив, умер, жив с рецидивами и/или метастазами. Больных, умерших от неуточненных причин, по правилам онкологической статистики считали умершими от рака, исключая пациентов, умерших в результате несчастного случая или других причин в лечебном учреждении.
Ближайшие результаты в основной и в контрольной группах прослежены до 2 лет. Однолетняя общая выживаемость в основной группе составила 96,4 %, что на 30 % выше, чем результаты в контрольной группе – 65 % (рис. 1). Данный факт отмечен и при анализе 2-летней выживаемости. Таким образом, в основной группе общая выживаемость была на уровне 60,0 %, а в контрольной группе 45,3 % (p = 0,013). Медиана общей выживаемости в основной группе не достигнута. Медиана выживаемости в контрольной группе составила 18 мес.
Снижение общего числа прогрессирования опухолевого процесса и количества летальных исходов у больных основной группы нашли свое отражение в улучшении показателей бессобытийной выживаемости – на 13,8 %, по сравнению с ситуацией в контрольной группе (рис. 2). Таким образом, 2-х летняя бессобытийная выживаемость была на уровне 52,1 % в основной и 38,3 % в контрольной группах соответственно (p < 0,05). Медиана бессобытийного периода в основной группе не достигнута. Медиана бессобытийного периода в контрольной группе составила 15 месяцев (p = 0,0238).
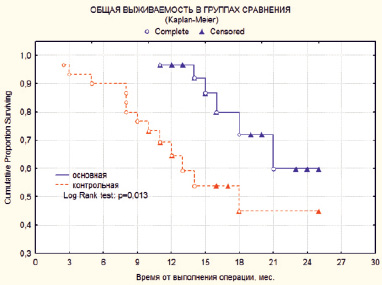
Рис. 1. Показатели общей выживаемости больных двух сравниваемых групп: основной (n = 30) и контрольной (n = 30)
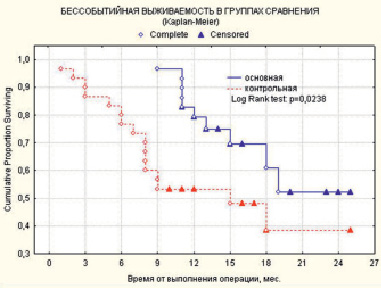
Рис. 2. Показатели бессобытийной выживаемости больных двух сравниваемых групп: основной (n = 30) и контрольной (n = 30)
Проанализирован характер и частота прогрессирования опухолевого процесса у исследуемых пациентов (табл. 1).
Таблица 1
Частота возникновения рецидивов и метастазов рака желудка, абс.ч. ( %)
|
Метод лечения |
Локо-регионарные рецидивы |
Отдаленные метастазы |
Локо-регионарные рецидивы + отдаленные метастазы |
Всего (рецидивов и метастазов) |
|
Основная группа |
1 (3,3 %) |
6 (20 %) |
2 (6,7 %) |
9 (30 %)* |
|
Контрольная группа |
2(6,7 %) |
10 (33,3 %) |
4 (13,3 %) |
16 (53,3 %)* |
Примечание. * – достоверно при р < 0,05 между данными сравниваемых групп.
Таблица 2
Сроки появления локо-регионарных рецидивов и метастазов в сравниваемых группах
|
Метод лечения |
Всего больных |
Сроки выявления (мес.) |
|||||||
|
рецидивов |
метастазов |
||||||||
|
0–6 |
7–12 |
13–18 |
19–24 |
0–6 |
7–12 |
13–18 |
19–24 |
||
|
Основная группа |
9 |
– |
1 |
2* |
– |
– |
2 |
3 (2*) |
1 |
|
Контрольная группа |
16 |
1(1*) |
3(2*) |
2(1*) |
– |
2(1*) |
4(2*) |
3(1*) |
1 |
Примечание. * – Сочетание у одного больного метастазов и локо-регионарного рецидива.
Выявлено, что отдаленное метастазирование в сочетании с локо-регионарным рецидивом в основной группе наблюдалось в 1,8 раза реже, чем в контрольной (30 % и 53,3 % соответственно). Причем в контрольной группе в 2 раза чаще наблюдались локо-регионарные рецидивы и в 1,7 раз отдаленные метастазы. Отмечено, что отдаленное метастазирование у больных контрольной группы характеризовалось мультифокальностью поражения (печень, легкие, отдаленные л/узлы, канцероматоз).
Можно предположить, что статистически значимое различие в группах по поражению печени связано с проведением внутрибрюшинной химиотерапии в основной группе. Так как при интраперитонеальной химиотерапии диффузия цитостатика происходит через брюшину, при этом 80 % препарата поступает через систему воротной вены, создавая высокую концентрацию химиопрепарата в печени (9).
Нами проанализированы сроки выявления прогрессирования процесса в исследуемых группах (табл. 2). Основная часть рецидивов и метастазов в обеих группах зарегистрирована в течение от 1 года до 1,5 лет после операции. В контрольной группе появление отдаленных метастазов начиналось в интервале от 6–7 месяцев. При применении адъювантной химиолучевой терапии на озонированных средах у больных раком желудка имел место сдвиг сроков появления метастазов к 12–15 месяцам.
Появление рецидивов у больных контрольной группы имело аналогичную тенденцию.
Заключение
Таким образом, применение адъювантной химиолучевой терапии на озонированных средах улучшает отдаленные результаты лечения больных раком желудка – увеличивает продолжительность жизни, длительность безрецидивного периода и сроки появления отдаленных метастазов.
Библиографическая ссылка
Гусарева М.А., Геворкян Ю.А., Малейко М.Л., Жужеленко И.А., Ильченко С.А. ОТДАЛЕННЫЕ РЕЗУЛЬТАТЫ И ХАРАКТЕР ПРОГРЕССИРОВАНИЯ ОПУХОЛЕВОГО ПРОЦЕССА ПОСЛЕ АДЪЮВАНТНОЙ ХИМИОЛУЧЕВОЙ ТЕРАПИИ РАКА ЖЕЛУДКА // Успехи современного естествознания. 2015. № 3. С. 35-39;URL: https://natural-sciences.ru/ru/article/view?id=34732 (дата обращения: 14.02.2026).



