Уменьшение овариального запаса может быть важным фактором, когда никакое другое очевидное объяснение происхождения бесплодия не найдено [9]. Установлено, что высокой точностью определения овариального резерва обладают методы, основанные на определении уровня различных пептидов, вырабатываемых в яичнике (ингибин-А и ингибин-В, активин-А, антимюллеровый гормон). Прикладные методы оценки овариального резерва, применяемые для установления риска развития бесплодия, не имеют до настоящего времени объяснения причин этого явления и роли в его патогенезе ингибинов, в частности, ингибина-А. .В настоящее время ряд исследователей [8.] пришли к выводу, что даже наличие достаточных уровней ингибина-А в крови не всегда гарант успеха при лечении бесплодия. Вероятно, это связано с наличием у пациентов биохимических факторов воспаления (цитокинов, острофазовых белков), вызывающих снижение биологической активности ингибина-А.
Известно [8], что ингибин-А и активин способны образовывать стабильные комплексы с некоторыми растворимыми белками, и эти комплексы снижают способность ингибина-А взаимодействовать с рецепторным аппаратом. Среди маркеров воспаления один из наиболее распространенных – лактоферрин [7], который обладает, многократно доказанной способностью к интерполимерным взаимодействиям [3, 10].
Целью нашей работы стало выявление возможности образования комплексов Ингибина-А с одним из острофазовых белков – лактоферрином.
Материалы и методы исследования
В работе использовали препарат ЛФ, полученный в нашей лаборатории и полученный нами по описанному ранее способу ингибин-А[1 ]. Для выяснения возможности образования межмолекулярных комплексов ингибина-А и ЛФ использованы применявшиеся для изучения межмолекулярных взаимодействий, методы электрофореза, гель-фильтрации [4], иммуноэлектрофореза и иммунодиффузионного анализа в агаре (ИДА) [2].
Были приготовлены маточные растворы ЛФ и ингибина-А на 0,85 % растворе хлорида натрия с концентрацией 1,0 мг/мл.
Далее было приготовлено два ряда смесей, как указано в табл. 1.
таблица 1
Разведения ингибина-А и ЛФ
|
№ |
Тип смеси и концентрации в мкг/мл |
|||
|
ЛФ |
ингибин-А |
ингибин-А |
ЛФ |
|
|
1-1 |
500 |
250 |
||
|
2-1 |
500 |
250 |
||
|
1-2 |
500 |
125 |
||
|
2-2 |
500 |
125 |
||
|
1-3 |
500 |
62,5 |
||
|
2-3 |
500 |
62,5 |
||
|
1-4 |
500 |
31,25 |
||
|
2-4 |
500 |
31,25 |
||
|
1-5 |
500 |
15,6 |
||
|
2-5 |
500 |
15,6 |
||
Результаты исследования и их обсуждение
Все образцы были подвергнуты электрофорезу в полиакриламидном геле и, как видно на рис. 1, отмечено изменение электрофоретической подвижности ЛФ и ингибина-А по сравнению с чистыми препаратами этих белков, а также появление дополнительных фракций. Разведения ЛФ на ингибине-А и разведения ингибина-А на ЛФ охватывают молярное соотношение ингибина-А к ЛФ от 1:6 до 65:1. При малых концентрациях ингибина-А относительно ЛФ (№ 1-5, 1-4, 1-3) характерная полоса ингибина-А, имеющего высокую катодную подвижность, вообще не наблюдается, а отмечается мощная фракция ЛФ, электрофоретическая подвижность которой практически не отличается от электрофоретической подвижности контрольного препарата ЛФ. при низких концентрациях ЛФ (№ 2-5; 2-4), отмечается наличие фракций ЛФ и ингибина-А, практически идентичных по электрофоретической подвижности контрольным препаратам. Более наглядные результаты наблюдаются (рис 1.) при электрофорезе разведений № 2-3 и № 2-2.
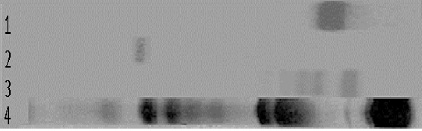
Рис. 1. Электрофорез в полиакриламидном геле: 1 – препарат ЛФ; 2 – препарат ингибина-А; 3 – смесь ингибина-А и ЛФ № 2-3; 4 – сыворотка крови человека. Окраска Coomasi blue
При выбранном в этих разведениях молярном соотношении ингибин-А – ЛФ (14/1 и 7/1 соответственно), визуально наиболее ярко проявляется изменение электрофоретической подвижности ЛФ и появление гетерогенности в области зоны его миграции от 2 до 4 фракций. На следующем этапе мы исследовали возможность образования комплекса ингибин-А – ЛФ методом иммуноэлектрофореза.
Этот метод оказался более информативным и менее трудоемким в оценке возможности образования межмолекулярных комплексов т.к. позволяет не только оценить сам факт образования комплекса в результате изменения электрофоретической подвижности, но и предоставляет значительно больше возможностей в количественной оценке данного феномена. На рис. 2. хорошо видно изменение электрофоретической подвижности как ингибина-А, так и ЛФ, находящихся в смеси друг с другом, в данном случае, в молярном соотношении ЛФ/ингибин-А примерно 1/14.

Рис. 2. Иммуноэлектрофорез препаратов ЛФ и ингибина-А: 1 – препарат ЛФ; 2 – препарат ингибина-А; 3 – смесь ингибина-А и ЛФ № 2-3; А – антисыворотка к белкам сыворотки крови человека; Б – антисыворотка к ЛФ; В – антисыворотка к ингибину-А
Количественная оценка результатов иммуноэлектрофореза смесей ЛФ – ингибин-А подтвердила вероятность образования межмолекулярных комплексов этих белков.
Как показано в табл. 2, электрофоретическая подвижность препарата ингибина-А относительно альбумина человека составляет 1,08±0,004; электрофоретическая подвижность препарата ЛФ относительно альбумина человека составляет 0,48±0,006. В смеси ингибина-А и ЛФ № 2-3, относительная электрофоретическая подвижность фракции выявляемой антисывороткой к ингибину-А составляет 0,6±0,005, а относительная электрофоретическая подвижность фракции, выявляемой антисывороткой к ЛФ, составляет 0,58±0,004. Эти различия электрофоретической подвижности чистых препаратов ЛФ и ингибина-А и их смеси статистически достоверны (Р<0,001)..
в смеси ингибина-А и ЛФ № 2-2, относительная электрофоретическая подвижность фракции, выявляемой антисывороткой к ингибину-А, составляет 0,61±0,005, а относительная электрофоретическая подвижность фракции, выявляемой антисывороткой к ЛФ, составляет 0,57±0,007, и выявленные различия также достоверны (Р<0,001).
Эти данные подтверждают и полученные с помощью электрофореза в полиакриламидном геле результаты о гетерогенности образующихся комплексов ингибин-А – ЛФ. Как видно из табл. 2, в смеси ЛФ и ингибина-А как в № 2-3 так и в № 2-2, антисыворотки к этим белкам выявляют различные фракции комплексов ингибин-А – ЛФ, обладающие различной электрофоретической подвижностью.
В табл. 2. литерой Р1 обозначены достоверности различий относительной электрофоретической подвижности фракций, выявляемых антисыворотками к ингибину-А и лактоферрину, находящихся в межмолекулярных комплексах.
Таблица 2
Относительная электрофоретическая подвижность(ОЭП) ингибина-А и ЛФ в чистых препаратах и их смесях (объяснения в тексте)
|
№ опыта |
ОЭП Препарат ингибина-А |
ОЭП Препарат ЛФ |
Смесь ингибина-А и ЛФ № 2-3 |
Смесь ингибина-А и ЛФ № 2-2 |
||
|
ЛФ |
Ингибин-А |
ЛФ |
Ингибин-А |
|||
|
1 |
1,09 |
0,48 |
0,57 |
0,59 |
0,55 |
0,61 |
|
2 |
1,08 |
0,47 |
0,59 |
0,61 |
0,59 |
0,61 |
|
3 |
1,07 |
0,49 |
0,57 |
0,6 |
0,57 |
0,59 |
|
4 |
1,06 |
0,47 |
0,58 |
0,6 |
0,58 |
0,6 |
|
5 |
1,08 |
0,46 |
0,6 |
0,62 |
0,59 |
0,62 |
|
6 |
1,10 |
0,51 |
0,57 |
0,58 |
0,54 |
0,59 |
|
7 |
1,08 |
0,49 |
0,58 |
0,6 |
0,56 |
0,6 |
|
8 |
1,08 |
0,48 |
0,57 |
0,59 |
0,56 |
0,63 |
|
М±m |
1,08± 0,004 |
0,48± 0,006 |
0,58± 0,004 |
0,60± 0,005 |
0,57± 0,007 |
0,61± 0,005 |
|
Р |
Р<0,001 |
Р<0,001 |
Р<0,001 |
Р<0,001 |
||
|
Р1 |
Р1<0,02 |
Р1<0,005 |
||||
Статистический анализ показал, что эти различия значимы, и для смеси № 2-3 составляют Р1<0,02, а для смеси № 2-2 составляют Р1<0,005. можно предположить, что фракции с большей электрофоретической подвижностью содержат преимущественно молекулы ингибина-А (имеющего больший отрицательный заряд), а в более медленной фракции преобладает положительный заряд ЛФ. Выявление различных фракций комплекса ингибин-А – ЛФ с помощью различных антисывороток, позволяет предположить, что образование этих комплексов происходит, как минимум, двумя путями. Во-первых, в исследованных смесях наблюдается более чем 10-кратное преобладание ингибина-А над ЛФ в молярном соотношении, и наиболее вероятный механизм образования комплекса – это электростатическое взаимодействие нескольких молекул ингибина-А, несущих достаточно высокий отрицательный заряд, с поликатионом ЛФ. При этом взаимодействии, тем или иным образом, экранируются антигенные детерминанты ЛФ, и быстрая фракция комплекса не выявляется антисывороткой к ЛФ. Во-вторых, возможен механизм преимущественно гидрофобного взаимодействия молекул ЛФ и ингибина-А. При этом более крупная молекула ЛФ сохраняет доступными свои антигенные детерминанты, а молекулы ингибина-А «укрываются» гидрофобными участками ЛФ и теряют возможность взаимодействовать с антителами.
Способность ЛФ к перекрестной реакции с полимерными соединениями (ДНК, РНК, белками, полисахаридами, различными полианионами), в совокупности с конформационной активностью белка создает дополнительные возможности изменения его биологических свойств и свойств взаимодействующих с ним молекул. Особого внимания заслуживает тот факт, что в присутствии АТФ происходит полная диссоциация мажорной тетрамерной формы ЛФ [5]. При этом происходит разнонаправленное изменение эффективности взаимодействия белка с нуклеиновыми кислотами, полисахаридами и белками. Так, мономерная форма ЛФ проявляет меньшее сродство к полисахаридам и казеину, а эффективность взаимодействия с гепарином изменяется слабо. В то же время АТФ ускоряет ЛФ-зависимый гидролиз ДНК. Есть данные [6] о регуляторной роли изменения олигомерного состояния ЛФ под действием биомолекул, как одного из путей увеличения их функциональных состояний и числа биологических функций. Изменение биологических функций молекул вступающих с ЛФ в интерполимерное взаимодействие, как, в частности, ингибин-А, в высшей степени вероятно, т.к. при интерполимерном взаимодействии обе молекулы подвергаются конформационной модификации.
Таким образом, следует полагать, что в регуляции свойств ингибина человека может участвовать несколько совершенно различных механизмов, которые включают изменение олигомерного состояния белка под действием различных индукторов [8], аллостерическое изменение конформации белка под действием нормальных и патологических метаболитов, например, высоких концентраций эстрогенов, конкурентные концентрации андрогенов и эстрогенов [10], а также образование олигомерных комплексов с ЛФ и , возможно, другими медиаторами и маркерами воспалительной реакции, может быть одой из причин изменения его функционального состояния и снижения биологической активности. Полученные данные являются примером регуляции биологической активности посредством межмолекулярных взаимодействий.
Библиографическая ссылка
Николаев А.А. КОМПЛЕКСООБРАЗОВАНИЕ ИНГИБИНА-А С ЛАКТОФЕРРИНОМ ЧЕЛОВЕКА // Успехи современного естествознания. 2015. № 1-3. С. 401-405;URL: https://natural-sciences.ru/ru/article/view?id=34901 (дата обращения: 23.02.2026).



