Более ста лет назад в медицинскую практику был введен метод лечения сверхмалыми дозами, названный гомеопатией. В задачи данной публикации не входит обсуждение эффективности данного метода. Однако однозначная эффективность данного метода привлекла внимание исследователей разных стран. В течение двадцати лет стали изучаться эффекты сверхмалых доз (СМД) [12] разных классов лекарственных препаратов, биологически активных веществ и токсинов. Была доказана их эффективность в пределах 10-6–10-16 М и ниже. Однако механизм действия до сих пор не был доказан для всех случаев применения ксенобиотиков в СМД. Известны лишь некоторые постулаты действия СМД [13, 2, 10]:
1. У лекарственных препаратов, а также биологически активные веществ отсутствует побочный эффект [8].
2. Кривая эффективности СМД является бимодальной – в эффективности препаратов в СМД два пика активности: первый – в известных среднетерапевтических дозах (10-3–10-5 М), а второй пик активности находился в СМД, равном 10-12–10-15 М. При этом второй пик часто более высокий, чем первый [1, 2].
3. В коридоре концентраций 10-8–10-12 М активность любого ксенобиотика отсутствует. Данную зону называют «мертвая зона» или «молчащая зона».
4. При использовании биологически – активного вещества (как и другого лекарственного препарата) в среднетерапевтической концентрации и СМД наблюдается потенцирующий эффект СМД [8, 11].
В данное время предложено более 13 гипотез механизма действия ксенобиотиков в сверхмалых концентрациях [3, 5, 8]. Но, к сожалению, ни одна из предлагаемых моделей не объясняет всех эффектов СМД. Однако обсуждать данный вопрос, не имея точного обозначения феномена под названием «сверхмалые дозы (концентрации)» весьма затруднительно. Возникает главный вопрос: данный феномен является уникальным природным явлением или это частный случай биохимии, фармакологии и молекулярной биологии и иммунологии?» Если это частный случай, то все механизмы могут описываться уже известными и апробированными механизмами действия фармакологических препаратов или токсических агентов.
Механизм влияния ксенобиотиков в СМД обеспечивает эффективность их действия на организмы животных и человека. Лекарственные препараты в СМД эффективнее таковых в среднетерапевтических дозах, как показано многими исследованиями [2–6, 9, 10], однако имеющиеся гипотезы механизмов действия не объясняют все эффекты СМД.
Предлагаемая гипотеза заключается в следующем: ксенобиотики в СМД поступают в межклеточное вещество (МКВ) тканей организма и меняют его физико-химические свойства. В результате этого происходит изменение биофизических свойств мембранных белков и рецепторов. Вследствие этого меняются свойства клеток и, значит, тканей организма. Предметом отдельных исследований должно быть изучение изменений природы физико-химических свойств тканей организма под действием ксенобиотиков в СМД. Возможно, действие СМД обеспечивается влиянием их на энтальпию межклеточного вещества. Интересны также и взаимодействия ксенобиотиков в СМД с веществами МКВ тканей.
Целью работы была проверка жизнеспособности парарецепторной гипотезы действия препаратов в сверхмалых дозах и воздействия различных физико-химических факторов на эффективность препаратов в сверхмалых дозах (СМД).
Материалы и методы исследования
Объектом исследования были эритроциты крови человека и стволовые клетки костного мозга крыс.
Эритроциты дважды промывали физиологическим раствором. Далее их разводили 1 мл физиологического раствора. К взвеси эритроцитов прибавляли сапонин (Saponin weiß rein, Merck, Германия) в соответствующей концентрации. После введения сапонина во взвесь эритроцитов проводилась их инкубация при 37 °С в течение 24 часов. Далее супернатант отделялся от осадка, и проводилась спектрофотометрия при λ = 540 нм.
Принцип метода – сапонин, в среднетерапевтической (среднетоксической) дозе, вызывает тотальный гемолиз эритроцитов. Отсутствие гемолиза не меняло оптической плотности надосадочной жидкости в пределах величин контрольной жидкости (физиологический раствор). Наличие гемолиза меняет величину оптической плотности раствора пропорционально интенсивности гемолиза.
Как известно, для клеток крови межклеточным веществом является плазма крови. Поэтому мы имитировали действие межклеточного вещества на клетки крови добавлением к эритроцитам плазмы крови. Плазма крови соответствовала эритроцитам данного донора. Для исключения влияния низкомолекулярных веществ плазмы на опыт (например, лекарства, биологические добавки и т.д.) мы проводили проточный диализ плазмы крови.
Для проверки данной гипотезы мы воспользовались другим типом клеток и другим эффектором. Для этого были взяты гемопоэтические стволовые клетки (ГСК) из спинного мозга крыс (получены в лаборатории молекулярной иммунологии и иммунобиотехнологии Института молекулярной биологии им. М.А. Айтхожина, зав. – профессор Беляев Н.Н.). В качестве эффектора мы использовали интерлейкины-2,3 (IL-2,3), а также INFγ и G-CSF, известные активаторы пролиферации ГСК. Для большей уверенности мы изучили активность рецепторов ГСК – CX-CR-4 рецепторы. Исследование уровня интерлейкинов проводилось с помощью иммуноферментативного анализа. Гемопоэтические стволовые клетки выделялись из костного мозга крыс в концентрации 100*103. Исследование экспрессии рецепторов определялось с помощью определения активности антител к данным рецепторам (фирма «R&D-System», Англия). Стимулятор пролиферации ГСК – интерлейкин – 2 (фирма Sigma) в концентрации 5*10-11 М. Активность пролиферации рассчитывалась с помощью МТТ – теста.
Статистическая обработка проводилась с помощью программы «STATISTICA 6.0»
Результаты исследования и их обсуждение
Для подтверждения справедливости данной гипотезы следует ответить на следующие вопросы:
1. Действует ли препарат в СМД без межклеточного вещества?
Для подтверждения данного тезиса были взяты отмытые эритроциты человека как субъект исследования. Как фактор воздействия был взят сапонин (Saponin weiß rein, Merck, Германия) в различной концентрации. Как со – фактор воздействия была взята плазма крови человека. Для исключения возможного воздействия внешних факторов (например, лекарств, избытка электролитов и др.) плазма подвергалась диализу против физиологического раствора. Известно, что сапонины вызывают гемолиз эритроцитов. Спектрофотометрически определяем уровень экстинкции.
Как показано в табл. 1, добавление плазмы крови изменяло активность гемолиза, причем, дозозависимо: среднетерапевтические дозы (10-3–10-5 М) его снижали, пограничная «мертвой зоны» (10-8 М) доза (10-6 М) повышала данный процесс. В «мертвой зоне» гемолиз не зависел от наличия плазмы и был ниже такового в СТД (рисунок).
При воздействии сапонина на взвесь эритроцитов в стандартной дозе происходит гемолиз эритроцитов. Мы предположили, что если введение сапонина в СМД во взвесь эритроцитов в физиологическом растворе вызовет гемолиз, то это покажет, что парарецепторная гипотеза не подтвердится.
Если при воздействии сапонина в СМД при одновременном введении плазмы крови (которая является межклеточным веществом), гемолиз будет, то можно сказать, что данная гипотеза подтверждена.
При проверке гипотезы мы изучили влияние разных сверхмалых концентраций сапонина. Мы взяли концентрацию сапонина в малой дозе (6*10-6 М), но перед «мертвой зоной», далее, в концентрации самой мертвой зоны (6*10-8 М). Кроме того, изучались верхняя пограничная, «мертвая зона», доза и высокая доза сапонина 6*10-13–6*10-15 М. Результаты представлены в табл. 1.
Таблица 1
Результаты действия сапонина в разных СМД
|
№ п/п |
Группа исследования (п = 5) |
Концентрация ксенобиотика |
Результат |
|
1 |
Среднетерапевтическая доза сапонина |
6*10-3 М |
0,25 ± 0,02 |
|
2 |
Среднетерапевтическая доза + плазма крови |
6*10-3 М |
0,14 ± 0,02 |
|
3 |
Сапонин, СМД, нижняя пограничная доза |
6*10-6 М |
0,12 ± 0,02* |
|
4 |
Сапонин, СМД, нижняя пограничная доза + плазма крови |
6*10-6 М |
0,11 ± 0,01** |
|
5 |
Сапонин, СМД, верхняя пограничная доза |
6*10-15 М |
0,13 ± 0,02 |
|
6 |
Сапонин, СМД, верхняя пограничная доза + плазма крови |
6*10-15 М |
0,34 ±0,04*** |
|
7 |
Сапонин, СМД, стандартная доза |
6*10-13 М |
0,07 ± 0,01 |
|
8 |
Сапонин, СМД, стандартная доза + плазма |
6*10-13 М |
0,12 ± 0,01**** |
|
9 |
СМД, мертвая зона |
6*10-8 М |
0,09 ± 0.009 |
|
10 |
СМД, мертвая зона + плазма крови |
6*10-8 М |
0,09 ± 0,008 |
Примечания. * – разница между группой 1 и 3; р ≤ 0,005, ** – разница между группой 2 и 4; р ≤ 0,005, *** – разница между группой 5 и 6; р ≤ 0,005, **** – разница между группой 7 и 8; р ≤ 0,005.
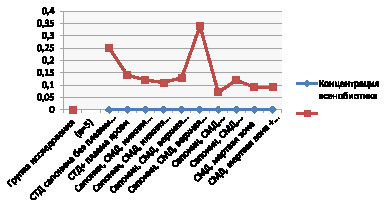
Результаты действия сапонина в разных СМД
Таблица 2
Взаимосвязь влияния сапонина в СМД и разведение плазмы крови
|
Разведение |
1:1 |
1:10 |
1:100 |
1:1000 |
1:10000 |
|
2,3*10-3 М |
0,51 ± 0,06 |
0,18 ± 0,01 |
0,29 ± 0,03 |
0,46 ± 0,05 |
0,26 ± 0,03 |
|
2,3*10-6 М |
0,24 ± 0,03 |
0,3 ± 0,03 |
0,26 ± 0,04 |
0,32 ± 0,04 |
0,4 ± 0,05 |
|
2,3*10-8 М |
0,26 ± 0,04 |
0,31 ± 0,03 |
0,28 ± 0,04 |
0,39 ± 0,04 |
0,31 ± 0,03 |
|
2,3*10-12 М |
0,3 ± 0,04 |
0,27 ± 0,03 |
0,26 ± 0,03 |
0,41 ± 0,04 |
0,3 ± 0,03 |
|
2,3*10-15 М |
0,19 ± 0,01 |
0,17 ± 0,02 |
0,22 ± 0,05 |
0,31 ± 0,03 |
0,26 ± 0,03 |
При сравнении влияния сапонина в среднетерапевтической дозе как в присутствии плазмы крови, так и без нее, была выявлена высокая активность гемолиза, но присутствие плазмы снижает ее на 9 %, что подтверждает факт, что в СТД закономерности сверхмалой концентрации не действуют.
При сравнении активности гемолиза нижней пограничной концентрации (6*10-6 М) и «мертвой зоны» (6*10-8 М) наблюдается достоверное различие: в «мертвой зоне», даже в присутствии межклеточного вещества, активность гемолиза под действием сапонина минимальна. Очень показательна активность процесса в СМД, равной 6*10-13 М. Без присутствия плазмы гемолиз значительно снижен, но при добавлении межклеточного вещества его активность возрастает на 55 %. Такая же картина наблюдается при воздействии сапонина в высокой дозе разведения – 6*10-15 М. При этом в присутствии плазмы активность гемолиза достоверно выше таковой в СТД. В присутствии плазмы крови процесс увеличивается на 142,9 %, а без нее – на 36 % (рисунок).
Таким образом, полученные данные говорят о существовании парарецепторного механизма действия сапонина.
Следующим вопросом, изученным нами, был вопрос о влиянии концентрации межклеточного вещества на активность сапонина в СМД (табл. 2).
При анализе полученных результатов по разведению плазмы обращает на себя внимание то, что наибольшая суммарная активность сапонина была при разведении 1:1000, а наименьшая – в разведении 1:1 и 1:10. При этом наблюдалась малая выраженность «мертвой зоны» (2,3*10-8 М).
Есть еще одно интересное наблюдение. Если рассматривать активность сапонина в СМД и сравнивать с разведением плазмы. Получается, что при концентрации СМД от 2,3*10-6 до 2,3*10-12 М и при от разведении от 1:1 до 1:100 активность сапонина приблизительно одинакова. А СМД сапонина 2,3*10-15 М лишь в разведении 1:100 приближается к показателям других концентраций. Однако при разведении от 1:1000 до 1:10000 активность сапонина в вышеперечисленных СМД статистически достоверно повышается. Следовательно, лишь при сильном разведении межклеточного вещества активность ксенобиотиков в СМД повышается.
Как известно, 2,3*10-3 М – среднетерапевтическая концентрация препаратов. Поэтому можно было бы предполагать, что снижение концентрации межклеточного вещества приводит к снижению активности препарата. В нашем случае происходит небольшое снижение активности при разведении 1:1 и 1:10, потом активность возрастает до концентрации 1:1000, а потом снижается, не доходя до начальных величин. Но на главный вопрос о том, как влияет разведение на активность ксенобиотика в СМД, однозначного ответа нет. Если сравнивать активность сапонина в СТД и суммарную активность (как и единичную) по разведениям, то получается, что активность препарата только в разведении 1:10000 превышает таковую в среднетерапевтической концентрации (при аналогичном разведении).
Если проанализировать активность сапонина по концентрации ксенобиотика в СМД, то наибольшая активность будет при концентрации сапонина в 2,3*10-12 М (исключая СТД).
Отдельно стоит обсудить СМД сапонина 2,3*10-5 М. При разбавлении ниже 1:100 активность самая низкая в ряду СМД, при разведениях 1:1000 и 1:10000 активность сапонина повышается. В разведении 1:10000 она превышает даже активность сапонина в среднетерапевтической дозе.
Таким образом, исследование показало, что лишь сильное разведение плазмы статистически достоверно повышает активность сапонина в СМД.
Таблица 3
Взаимосвязь влияния сапонина в СМД и качества плазмы
|
Концентрация |
КОНТРОЛЬ |
Активность Сапонина в нативной плазме |
ПЛАЗМА |
||
|
Эритроциты + физиол. раствор |
Эритроциты + плазма |
Без БЕЛКА |
Без ГАГов |
||
|
2,3*10-3 М |
0,059 ± 0,006 |
0,044 ± 0,005 |
0,51 ± 0,06 |
0,052 ± 0,06 |
0,12 ± 0,01 |
|
2,3*10-6 М |
|
|
0,24 ± 0,03 |
0,091 ± 0,09 |
0,122 ± 0,02 |
|
2,3*10-8 М |
|
|
0,26 ± 0,04 |
0,106 ± 0,02* |
0,124 ± 0,01 |
|
2,3*10-12 М |
|
|
0,3 ± 0,04 |
0,047 ± 0,05* |
0,126 ± 0,01 |
|
2,3*10-15 М |
|
|
0,19 ± 0,01 |
0,035 ± ,005* |
0,113 ± 0,01 |
Причечание. *р ≤ 0,005.
Таблица 4
Активность сапонина в зависимости от СМД
|
СМД |
Активность сапонина нативная* |
Разность Белок – ГАГ** |
Сумма*** белок – ГАГ |
Разность Активность – сумма**** |
|
2,3*10-3 М |
0,51 ± 0,05 |
0,07 |
0,172 |
0,34 |
|
2,3*10-6 М |
0,24 ± 0,02 |
0,03 |
0,213 |
0,027 |
|
2,3*10-8 М |
0.26 ± 0,03 |
0,02 |
0,23 |
0,03 |
|
2,3*10-12М |
0,3 ± 0,032 |
0,08 |
0,173 |
0,127 |
|
2,3*10-15М |
0,19 ± 0,02 |
0,08 |
0,148 |
0,042 |
Примечания. * – определение активности сапонина в СМД без осажденных компонентов; ** – разность активности сапонина между осажденными белками и осажденными ГАГами; *** – сумма активности сапонина с осажденными белками и осажденными ГАГами; **** – разность между активностью неосажденных компонентов плазмы и суммы осажденных компонентов.
Однако, чтобы понять механизм действия ксенобиотиков, важно понять, какой из компонентов межклеточного вещества является тем звеном, которое может быть триггером запуска активности СМД или ингибирующим агентом в «мертвой зоне». Для выяснения данного вопроса мы в одной группе осаждали белки, а в другой – осаждали гликозаминогликаны (как представители липополисахаридов; ГАГ). Результаты представлены в табл. 3.
Как видно из табл. 3, активность сапонина при всех СМД выше при наличии белка, чем при его отсутствии.
Однако в концентрации 2,3*10-3 М и 2,3*10-6 М разность в активности лишь недостоверно различается (р > 0,01). В остальных случаях разность активности сапонина без белка ниже, чем без ГАГов (р ≤ 0,05). Следовательно, в межклеточном веществе молекулы белка играют более важную роль в эффектах ксенобиотиков в СМД, чем липополисахариды. При этом, чем ниже концентрация сапонина, тем выше цифры активности препарата.
И другая интересная деталь – чем ниже концентрация сапонина, тем достовернее различия в активности сапонина.
Таким образом, можно сделать вывод, что белковая составляющая межклеточного вещества крови играет важнейшую роль в эффектах СМД.
Однако встал вопрос о наличии неучтенных факторов, влияющих на эффективность СМД. Самым простым проверочным действием является следующее: нужно сложить активности сапонина при воздействии плазмы с осажденным белком и с осажденными ГАГами. Если нет другого фактора, сумма будет равна контрольной (т.е. без осаждения компонентов плазмы). В нашем случае это было не так (табл. 4).
При этом, чем больше разность активности сапонина в СМД с нативной плазмой и такового и суммы активности с осажденным белком и осажденными ГАГами, тем больше вероятность присутствия неизвестного фактора, активирующего эффекты СМД. Как видно из таблицы, наибольшие показатели в разности при СМД 2,3*10-3М и 2,3*10-12 М.
Другой интересный факт: минимальная разница при СМД 2,3*10-6 М и 2,3*10-8 М – т.е. перед «мертвой» зоной и в начале самой «мертвой» зоны. Следовательно, этот фактор может быть триггер-фактором. ингибирующим активность ксенобиотиков в СМД в «мертвой» зоне. Разность эффекта сапонина в нативной плазме и суммарной (осажденные белки + осажденные ГАГи) также значительно повышалась при СМД 2,3*10-12М. Это также говорит о дозозависимом проявлении неизвестного фактора. повышающего эффективность ксенобиотиков в СМД.
Таким образом, можно сделать предварительные выводы, что:
– лишь высокие разведения статистически достоверно повышают активность сапонина в СМД;
– белковая составляющая межклеточного вещества более активно влияет на эффективность влияния ксенобиотиков в СМД;
– существует некий неизвестный фактор, активирующий эффективность препаратов в СМД. Кроме того, данный фактор может быть и ингибирующим триггер-фактором «мертвой зоны».
Однако встает вопрос о тканезависимом эффекте парарецепторного механизма действия препаратов в СМД. Для проверки этого вопроса мы решили испытать действие препаратов в СМД на гемопоэтических стволовых клетках (ГСК) из спинного мозга крыс. Для решения поставленной задачи мы изучили возможность активации CX-CR-4 рецепторов интерлейкинами-2, -3 в сверхмалых дозах, а также возможность активации пролиферации INFγ и G-CSF, известными активаторами пролиферации ГСК, также в сверхмалых дозах.
Результаты исследования показали, что интерлейкин-2(IL-2) в концентрации 5*10-12 г/мл активировал рецепторы по отношению к концентрации 5*10-9 г/мл. В то же время, IL-3 наоборот, снижал активность рецептора. Та же тенденция просматривалась и при влиянии фактора некроза опухоли (INFγ). Влияние G-CSF было не столь однозначным. Влияние на рецепторы гемопоэтических стволовых клеток снижало их активность в пограничных СМД. А его влияние на прогениторные клетки в пограничных СМД статистически не отличалось от стандартной концентраци данного вещества, используемой в подобных исследованиях.
Таким образом, можно сделать вывод, что сверхмалая концентрация цитокинов является модулирующим фактором поверхностных рецепторов гемопоэтических стволовых клеток.
Завершающим этапом работы было доказательство влияния межклеточного вещества на эффекты СМД в процессах пролиферации гемопоэтических стволовых клеток. Для проверки данной гипотезы был использован интерлейкин-2 (фирма «Sigma») в концентрации 5*10-12 М, вводимом в культуру гемопоэтических стволовых клеток, выделенных из костного мозга крыс. Активность пролиферации рассчитывалась с помощью МТТ – теста. Результаты показали, что активация пролиферации гемопоэтических стволовых клеток практически не происходит. В концентрации интерлейкинов, используемых в культивировании стволовых клеток (2*10-9 М), пролиферация ГСК довольно высока. В СМД интерлейкинов, активация пролиферации неустойчива или недостаточно стабильна. При этом, если бы она просто отсутствовала, можно было бы сказать, что именно СМД препарата не влияют на активность пролиферации ГСК. А в нашем случае такого не происходило. Мы интерпретировали результаты как недостаток клеточных факторов, позволяющих (запрещающих) процесс пролиферации стволовых клеток. По нашему мнению, это происходит из-за отсутствия межклеточного ретикулума, что подтверждает гипотезу о влиянии препаратов в СМД через межклеточное вещество.
Выводы
Результаты исследований привели нас к следующим выводам:
1. Полученные данные говорят о подтверждении гипотезы парарецепторного механизма действия.
2. Наличие межклеточного вещества является главным фактором в эффекте ксенобиотиков в сверхмалых дозах.
3. В «мертвой зоне» активность сапонина была статистически недостоверной.
4. Лишь сильное разведение плазмы крови статистически достоверно повышает активность ксенобиотиков в СМД.
5. Белковая составляющая межклеточного вещества крови играет важнейшую роль в эффектах СМД.
6. Существует некий неизвестный фактор, активирующий эффективность препаратов в СМД. Кроме того, данный фактор может быть и ингибирующим триггер-фактором «мертвой зоны».
7. Сверхмалые концентрации цитокинов являются модулирующим фактором поверхностных рецепторов гемопоэтических стволовых клеток.
Библиографическая ссылка
Денисов Ю.Д. МЕЖКЛЕТОЧНОЕ ВЕЩЕСТВО – КАМПАРТМЕНТ РЕАЛИЗАЦИИ МЕХАНИЗМА ДЕЙСТВИЯ СВЕРХМАЛЫХ ДОЗ КСЕНОБИОТИКОВ // Успехи современного естествознания. 2015. № 5. С. 114-120;URL: https://natural-sciences.ru/ru/article/view?id=35111 (дата обращения: 03.03.2026).



