Как показано в работах [1–4], для водных растворов белков и аминокислот линейного строения характерны линейные зависимости коллигативных свойств, а именно с ростом концентрации линейно снижается температура замерзания растворов и линейно возрастает осмотическое давление. Знание законов изменения коллигативных свойств позволяет прогнозировать поведение смесей белков и аминокислот в инфузионных лекарственных формах, что является крайне актуальным, поскольку растворы для инфузий по своей осмолярности должны соответствовать осмолярности крови или плазмы крови. Поскольку медицина и фармация используют инфузионные растворы, содержащие широкий перечень веществ кислотного характера – аминокислоты (одно- и двухосновные, линейного и циклического строения), витамины (аскорбиновая кислота, никотиновая кислота), – целесообразно провести сравнение коллигативных свойств водных растворов указанных веществ с целью выявления общих тенденций и значимых отличий.
Материалы и методы исследования
В качестве объекта исследования использовали водные растворы ε-аминокапроновой кислоты, глутаминовой кислоты, аскорбиновой кислоты (витамина С), никотиновой кислоты (витамина РР). Определение температуры замерзания проводили на автоматическом криоскопическом осмометре ОМТ–5–02. Предварительно прибор калибровали с помощью серии растворов рабочих стандартных образцов натрия хлорида. Испытуемые растворы лецитина соевого различной концентрации помещали в кювету прибора, погружали в термостат с контролируемой температурой и замораживали. Осмолярность раствора автоматически определяется по фиксированной температуре замерзания.
Результаты исследования и их обсуждение
Коллигативные свойства выбранных объектов исследования изучались методом замораживания растворов. Выявлено, что для всех изучаемых веществ кислотного характера температура замерзания линейно снижается с увеличением концентрации компонента в растворе вплоть до достижения предела растворимости (рис. 1).
Уравнение линейной аппроксимации для ε-аминокапроновой кислоты имеет вид ∆tзам = (– 2,41 ± 0,01)∙САМИНОКАПР. Сопоставляя полученные данные с результатами для глицина и аланина [3] (∆tзам = (– 1,15 ± 0,02)∙САЛА; (∆tзам = (– 1,03 ± 0,01)∙СГЛИ), следует отметить, что константы диссоциации указанных аминокислот по типу кислоты или основания составляют величины порядка 10-10–10-11 независимо от расположения аминогруппы, поэтому увеличением числа частиц в растворе в результате диссоциации карбоксильных групп или протонирования аминогрупп можно пренебречь и предположить, что положение аминогруппы в углеводородной цепи также не влияет на коллигативные свойства растворов. Данное предположение подтверждается расчетами на основании данных по эффективной осмотической концентрации растворов. Для всех указанных аминокислот эффективная осмотическая концентрация частиц, выраженная в единицах молярности (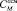 ), практически совпала с аналитической (рассчитанной) молярной концентрацией (САМИНОК-ТЫ). Расчеты с использованием критерия Фишера показывают, что гипотеза о том, что величины
), практически совпала с аналитической (рассчитанной) молярной концентрацией (САМИНОК-ТЫ). Расчеты с использованием критерия Фишера показывают, что гипотеза о том, что величины 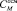 и САМИНОК-ТЫ значимо не отличаются друг от друга на всем изученном диапазоне концентраций аминокислот, может быть принята на уровне значимости 0,005 [6].
и САМИНОК-ТЫ значимо не отличаются друг от друга на всем изученном диапазоне концентраций аминокислот, может быть принята на уровне значимости 0,005 [6].
Указанные аминокислоты линейного строения отличаются длиной углеводородной цепи, поэтому можно предположить, что длина углеводородной цепи оказывает существенное влияние на коллигативные свойства растворов указанных веществ: чем длиннее углеводородная цепь, тем сильнее выражено влияние аминокислоты на коллигативные свойства. Так, 1 моль/л ε-аминокапроновой кислоты увеличивает осмотическое давление раствора примерно на 3200 Па; 1 моль/л β-аланина – на 3100 Па; для глицина этот показатель составляет величину порядка 2750 (рис. 2).
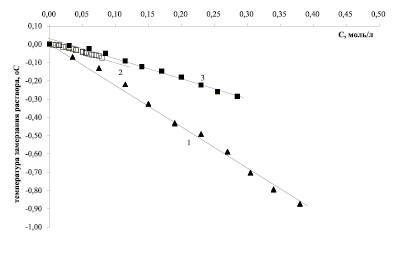
Рис. 1. Понижение температуры замерзания раствора с ростом концентрации ε-аминокапроновой кислоты (1), глутаминовой и никотиновой кислот (2), аскорбиновой кислоты (3)
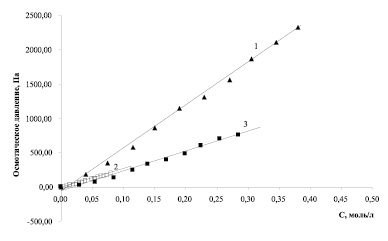
Рис. 2. Зависимость осмотического давления водных растворов от концентрации ε-аминокапроновой кислоты (1), глутаминовой и никотиновой кислот (2), аскорбиновой кислоты (3)
Анализируя коллигативные свойства глутаминовой кислоты, следует отметить, что указанное соединение является двухосновной аминокислотой линейного строения и характеризуется существенно меньшей растворимостью в воде, чем ранее рассмотренные аминокислоты, и существенно бóльшей константой диссоциации одной из карбоксильных групп (Ка1 = 3,09·10-5) [5]. Расчеты на основании данных по эффективной осмотической концентрации с использованием критерия Фишера показывают, что этот фактор не приводит к увеличению числа частиц в растворе, и для глутаминовой кислоты эффективная осмотическая концентрация и аналитическая концентрация значимо не отличаются друг от друга на всем изученном диапазоне концентраций на уровне значимости 0,005. Аналогично ведет себя в растворе никотиновая кислота – кислота, включающая пиридиновый цикл и характеризующаяся сопоставимой величиной константы диссоциации (Ка = 1,5·10-5). Более того, тангенсы углов наклона концентрационных зависимостей температуры замерзания и осмотического давления растворов глутаминовой и никотиновой кислот значимо не отличаются друг от друга и составляют величины порядка – 0,97 ± 0,01 град·л/моль и 2560 ± 50 Па·л/моль (рис. 1, 2).
Чтобы подтвердить или опровергнуть гипотезу о линейном изменении коллигативных свойств с ростом концентрации в водных растворах веществ кислотной природы, были проведены исследования растворов аскорбиновой кислоты (витамина С) на предмет изменения температуры замерзания и осмотического давления. Водные растворы аскорбиновой кислоты с концентрацией 5 % применяются в качестве инфузионных, поэтому выявление особенностей коллигативных свойств растворов, содержащих витамин С, является актуальным. Результаты проведенных исследований позволяют сделать вывод о том, что закономерности изменения коллигативных свойств растворов аскорбиновой кислоты аналогичны обнаруженным ранее (рис. 1, 2). Так, понижение температуры замерзания растворов аскорбиновой кислоты с ростом концентрации описывается уравнением ∆tзам = (– 1,13 ± 0,01)∙САСКОРБ, а 1 моль/л аскорбиновой кислоты увеличивает осмотическое давление раствора примерно на 1500 Па.
Для всех изученных веществ кислотного характера – аминокислот и витаминов – корреляционную связь между коллигативными свойствами и концентрацией можно оценить как сильную и достоверную, поскольку коэффициенты корреляции по модулю входят в интервал [0,7; 1].
Выводы
1. Коллигативные свойства характеризуют растворы веществ с точки зрения совместного присутствия и взаимного влияния компонентов, что крайне важно для многокомпонентных систем, применяемых для парентерального введения в медицине и фармации.
2. На примере ряда аминокислот и витаминов выявлена общая тенденция линейной корреляции коллигативных свойств растворов и концентрации веществ кислотной природы, аналогичная зависимости, обнаруженной для белков.
Библиографическая ссылка
Сафонов В.И., Миняева О.А., Горбунова А.П. О НЕКОТОРЫХ ОБЩИХ ЗАКОНОМЕРНОСТЯХ ИЗМЕНЕНИЯ КОЛЛИГАТИВНЫХ СВОЙСТВ ВОДНЫХ РАСТВОРОВ АМИНОКИСЛОТ И ВОДОРАСТВОРИМЫХ ВИТАМИНОВ // Успехи современного естествознания. 2015. № 9-1. С. 77-80;URL: https://natural-sciences.ru/ru/article/view?id=35530 (дата обращения: 03.02.2026).



