Развитие фармацевтического рынка доказывает, что интерес к лекарственным растениям, как к источнику сырья для производства эффективных и безопасных лекарственных средств, является стабильным, несмотря на различные периоды в развитии Российской фармации и изменения экономической ситуации в нашей стране. Так, растительные источники флавоноидов обладают широким спектром фармакологической активности и в настоящее время составляют одну из наиболее крупных групп лекарственного сырья, востребованного в медицине. Актуальной задачей является поиск перспективных лекарственных средств растительного происхождения, разработка современных методов и приёмов стандартизации, определяющих его качество [3, 6]. Перспективным для создания фитопрепаратов является лилия белая (Lilium candidum L.), семейства Liliaceae. Химический состав сырья лилии белой (Lilium candidum L.) изучен недостаточно, однако лечебное действие народная медицина знает хорошо. В настоящее время сырье Lilium candidum L. широко используется в парфюмерно-косметической промышленности, в гомеопатии.
Целью данной работы явилось изучение фенольных соединений лилии белой листьев.
Материалы и методы исследования
Объект нашего исследования – лилии белой листья, заготовленные с растений Lilium candidum L., семейства Liliaceae в Ботаническом саду Пятигорского медико-фармацевтического института [1].
Качественный состав и количественное определение фенольных соединений в исследуемых образцах воздушно-сухого сырья определяли, используя качественные реакции, метод высокоэффективной жидкостной хроматографии (ВЭЖХ) [2].
Определение флавоноидов проводили, применяя качественные реакции: цианидиновую пробу, с водным раствором хлорида железа (Ш), водным раствором натрия гидрооксида, раствором ацетата свинца; дубильных веществ: с раствором желатина, хинина сульфата, при добавлении 1 % раствора железоаммониевых квасцов, наблюдалось черно-синее окрашивание (гидролизуемые дубильные вещества) [4, 5]. Для более точного определения использовали метод высокоэффективной жидкостной хроматографии (ВЭЖХ). Для этого образцы исследуемого сырья – лилии листья – измельчали до размера частиц, проходящих сквозь сито с диаметром отверстий 2 мм (ГОСТ 214-83). Измельченное сырье в количестве 2,0 г помещали в колбу вместимостью 100 мл, прибавляли 20 мл спирта этилового 70 %. Колбу присоединяли к обратному холодильнику и нагревали на кипящей водяной бане в течение часа с момента закипания спиртоводной смеси. После охлаждения смесь фильтровали через бумажный фильтр в мерную колбу вместимостью 50 мл и доводили объем спиртом этиловым 70 % до метки. Параллельно готовили серию растворов стандартных образцов фенольных соединений 0,05 % в спирте этиловом 70 %: рутина, кверцетина, лютеолина, лютеолин-7-гликозида, галловой кислоты, кофейной кислоты, хлорогеновой кислоты, цикориевой кислоты, коричной кислоты, о-кумаровой, эпигалокатехингаллата, танина, гиперозида, геспередина, апигенина, феруловой кислоты, эпикатехина, эскулетина, кумарина, дигидрокверцетина, кемпферола, нарингенина. По 50 мкл исследуемых растворов и растворов сравнения вводили в хроматограф и хроматографировали. Для анализа фенольных соединений использовали высокоэффективный жидкостный хроматограф «GILSON-305» (Франция) с ручным инжектором RHEODYNE-7125 USA, результаты обрабатывали с помощью компьютерной программы «МультиХром» В качестве неподвижной фазы была использована металлическая колонка размером 4,6x250 мм Kromasil С 18, размер частиц 5 микрон. Подвижная фаза: метанол-вода-фосфорная кислота концентрированная, в соотношении 400:600:5. Анализ проводили при комнатной температуре. Скорость подачи элюента 0,8 мл/мин. Продолжительность анализа 60 мин. Детектирование проводилось с помощью УФ-детектора «GILSTON» UV/VIS модель 151, при длине волны 254 нм. Идентификацию разделенных веществ проводили путем сопоставления времен удерживания пиков, полученных на хроматограмме проб с временами удерживания стандартных растворов. Оценку количественного соотношения идентифицированных веществ в исследуемых образцах проводили по площади пиков, используя метод внутренней нормализации.
Идентификация фенольных соединений листьев Lilium candidum L. методом ВЭЖХ
|
№ п/п |
Время, мин |
Высота, mV |
Площадь, mV·сек |
ФО |
Содержание, % |
Название |
|
1 |
3,81 |
64,46 |
1030,10 |
1,000 |
8,57 |
галловая кислота |
|
2 |
4,074 |
96,01 |
2672,41 |
1,000 |
22,22 |
ЭГКГаллат |
|
3 |
4,621 |
53,70 |
3448,69 |
1,000 |
28,68 |
хлорогеновая кислота |
|
4 |
6,775 |
47,32 |
2236,07 |
1,000 |
18,60 |
цикориевая кислота |
|
5 |
8,758 |
23,28 |
1457,15 |
1,000 |
12,12 |
н |
|
6 |
10,66 |
8,42 |
516,57 |
1,000 |
4,30 |
феруловая кислота |
|
7 |
14,88 |
7,29 |
431,40 |
1,000 |
3,59 |
н |
|
8 |
22,85 |
3,39 |
232,46 |
1,000 |
1,93 |
н |
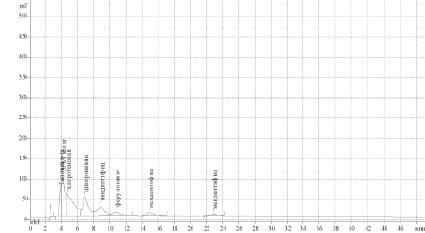
Хроматограмма водно-спиртового извлечения листьев Lilium candidum L
Результаты исследования и их обсуждение
Хроматографические характеристики соединений, обнаруженных методом ВЭЖХ в исследованном извлечении, приведены в таблице.
Методом ВЭЖХ в водно-спиртовом (70 %) извлечении лилии белой листьев обнаружено 8 соединений, из них идентифицировано 5 веществ фенольной природы: гидроксикоричные кислоты (цикориевая, хлорогеновая, феруловая, галловая), полифенольные соединения (эпигаллокатехингаллат). Содержание суммы идентифицированных фенольных соединений составило 82,37 % от всех обнаруженных данным методом соединений (таблица, рисунок).
Выводы
Таким образом, в листьях Lilium candidum L. методом ВЭЖХ было обнаружено 8 соединений, из них идентифицировано 5 веществ фенольной природы: галловая, цикориевая, хлорогеновая, ферулловая кислоты, эпигаллокатехингаллат.
Библиографическая ссылка
Вдовенко-Мартынова Н.Н., Кобыльченко Н.В., Блинова Т.И. ИССЛЕДОВАНИЕ ФЕНОЛЬНОГО КОМПЛЕКСА ЛИСТЬЕВ ЛИЛИИ БЕЛОЙ (LILIUM CANDIDUM (L.)) // Успехи современного естествознания. 2015. № 9-1. С. 100-102;URL: https://natural-sciences.ru/ru/article/view?id=35536 (дата обращения: 03.02.2026).



