Рекреационная аквакультура – направление рыбохозяйственной деятельности, связанное с использованием гидробионтов в культурно-просветительских, научно-исследовательских и природоохранных целях, в том числе посредством создания различного масштаба аквариальных комплексов: от публичных аквариумов и океанариумов до парков морских животных.
При формировании экспозиций большинства отечественных океанариумов обычно фауне бореальной и арктической зон, к которым относятся в основном прибрежные российские воды, уделяется недостаточно внимания. Более того, существует мнение, что бореально-арктическая ихтиофауна, как правило, представленная в экспозициях промысловыми видами, хорошо известными по непритязательного вида «тушкам» с магазинных прилавков, не отличается разнообразием окраски и интересной биологией. Представленные ниже материалы демонстрируют, что представители характерной для российских вод бореально-арктической ихтиофауны являются перспективными объектами экспозиций аквариумов и океанариумов. При этом, наделённые привлекающим внимание внешним видом, эти объекты характеризуются специфическими особенностями биологии, что позволяет расширить представления как специалистов, так и широкой публики об объектах ихтиофауны российских прибрежных вод.
Целью данной статьи является характеристика внешней привлекательности и биологии представителей характерной для российских вод бореально-арктической ихтиофауны как перспективных объектов для экспозиций аквариумов и океанариумов.
Материалы и методы исследований
Материалы собраны в ходе экспедиционных исследований в северо-западной части Тихого океана в 1992–2004 гг. и оз. Могильном (2011 г.), учебно-производственных студенческих практик на Балтийской биостанции Ростокского университета (2012 г.) и Беломорской биостанции МГУ (2015 г.), а также в процессе посещений различных океанариумов мира. Часть материалов получена из литературных источников и с использованием интернет-ресурсов (соответствующие ссылки на источник материалов приведены в тексте).
Результаты исследований и их обсуждение
Круглоперы (Cyclopteridae). Это – довольно специфическая группа морских рыб, отличающихся необычными чертами строения и биологии. Представители семейства круглоперых обитают амфибореально, населяя акватории северных частей Атлантического и Тихого океанов, а также некоторые арктические моря. Большинство представителей семейства отличается шаровидной формой тела, которое сильно раздуто спереди и сжато с боков в задней его части (рис. 1). Характерной чертой этой группы рыб является наличие присоски, формирующейся в раннем развитии за счет слияния брюшных плавников. Большинство круглоперов населяет прибрежные воды (глубины до 200–300 м) и ведет придонный образ жизни, нередко при близких к нулю или даже отрицательных температурах. Однако некоторые из них перешли к обитанию в толще воды, в связи с чем постоянно встречаются в открытом океане над большими глубинами [9].
Пинагор (Cyclopterus lumpus) (рис. 2) – распространен в морях северной Атлантики. Вид занимает уникальную экологическую нишу, являясь основным потребителем гребневиков. Пинагор образует скопления в периоды нагула и нереста. Для вида характерен половой диморфизм в размерах – самки значительнее крупнее самцов [3]. После нереста самцы охраняют кладки икры до выклева личинок.
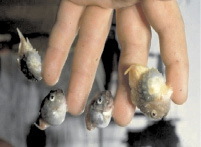

Рис. 1. Колючие пинагоры рода Eumicrotremus на человеческой руке (слева – источник http://www.zoopicture.ru/pinagor/, справа – фото А.М. Токранова)


Рис. 2. Пинагор Cyclopterus lumpus в естественной среде обитания и извлеченный из воды (слева – фото А.А. Новичковой, справа – фото А.Н. Строганова)
Голый круглопер, или рыба-лягушка (Aptocyclus ventricosus) – наиболее крупный представитель тихоокеанских круглоперов, длина до 40,5 см (рис. 3). Самки существенно крупнее самцов, особи разных полов отличаются окраской. В отличие от других представителей круглоперов кожа рыбы-лягушки лишена костных бугорков или шипиков. В связи с этим у рыбы есть народное название – мягонькая или мягкая рыба. Распространена эта рыба в Северной Пацифике от берегов Кореи и южной Японии до побережья канадской провинции Британская Колумбия, наибольшей численности достигает в центральной части Берингова моря, где ее уловы достигают 50 экземпляров за часовое траление, а биомасса только в западной части моря может превышать 70 тыс. т. Основную часть жизни проводит в открытых водах океана над большими глубинами, обитая преимущественно, в диапазоне 50–100 м, опускаясь в редких случаях до 1700 м. Нерестится рыба-лягушка в прибрежной зоне на глубинах до 10 м. Самки откладывают икру между прибрежными камнями с зарослями водорослей и после завершения нереста покидают нерестилища. Самцы охраняют кладку икры весь период развития [20]. Своей присоской они прикрепляются к камням рядом с кладкой икры и в течение нескольких недель отгоняют от нее других рыб. По наблюдениям заведующего Камчатской морской станции Государственного гидрологического института К.А. Виноградова [6], во время больших отливов кладки икры вместе с самцами могут обсыхать. Чтобы развивающиеся икринки не погибли, самцы периодически поливают их водой, которую запасают в себе. Время от времени вода выбрасывается изо рта в виде тонкой струйки, при этом издается довольно характерный звук, напоминающий резкий хлопок. Будучи потревоженными, самцы бьют хвостом, устрашающе раскрывают рот и вращают глазами [20].




Рис. 3. Рыба-лягушка на палубе судна (вверху – фото А.М. Токранова и Р.М. Сабирова) и в естественной среде обитания – источник: http://namako-sasakic.sakura.ne.jp/~namako/animals/VERTEBRATA/ACTINOPTERYGII/Scorpaeniformes/SCORPAENIFORMES5.html)
Морские лисички (Agonidae). Группа донных рыб, представленных в Северном Ледовитом океане, северной части Атлантического и Тихого океанов. По современным представлениям, центром возникновения морских лисичек является северная часть Тихого океана. В настоящее время здесь известно более 40 видов этих рыб, около двух десятков из которых встречаются в дальневосточных морях. Основная область обитания большинства морских лисичек – прибрежные воды от приливно-отливной зоны до границы шельфа, отдельные виды отмечаются на глубинах до 1500 м. Форма тела у различных представителей от веретенообразной до приплюснутой сверху вниз или сжатой с боков. Тело заключено в твердый панцирь, состоящий из крупных костных пластинок (рис. 4–5). Размеры большинства морских лисичек не превышают 20 см, а масса тела – 30–80 г, и лишь у нескольких видов эти показатели достигают 40–45 см и 200–500 г. Морские лисички ведут сравнительно малоподвижный образ жизни, питаются мелкими донными беспозвоночными (бокоплавами, креветками, червями) [18].
Липаровые или морские слизни (Liparidae). Представители семейства Liparidae отличаются исключительным разнообразием окраски (от практически бесцветной, полупрозрачной до ярко-розовой или черной) и внешнего строения (форма тела, величина плавников, присасывательного диска, наличие усиков и шипиков), а также специфическими чертами биологии (рис. 6–7).
Центром возникновения морских слизней считается северо-западная часть Тихого океана [23]. В настоящее время здесь известно более 100 видов этих рыб [4, 22, 27].
Для населяющих прибрежные воды слизней характерно расширенное спереди и несколько сплющенное сверху тело, крупная широкая голова и хорошо развитые грудные плавники (рис. 8). Брюшные плавники у них слились и образуют мощную присоску, диаметр которой у некоторых видов достигает трети или даже половины длины головы. С помощью этой присоски прибрежные морские слизни прикрепляются к подводным камням, водорослям и раковинам моллюсков, что позволяет им удерживаться на участках с сильными течениями или в прибойной зоне [16].


Рис. 4. Тонкорылая лисичка Sarritor leptorhynchus (источник: http://namako-sasakic.sakura.ne.jp/~namako/animals/VERTEBRATA/ACTINOPTERYGII/Scorpaeniformes/SCORPAENIFORMES4.html)


Рис. 5. Гипсагон Hypsagonus proboscidalis (источник: http://namako-sasakic.sakura.ne.jp/~namako/animals/VERTEBRATA/ACTINOPTERYGII/Scorpaeniformes/SCORPAENIFORMES4.html)

Рис. 6. Вильчатохвостый морской слизень Careproctus cypselurus в судовом аквариуме (фото И.А. Бирюкова)

Рис. 7. Щелеглазый морской слизень Crystallichthys mirabilis (фото А.М. Токранова)

Рис. 8. Липарис Танаки Liparis tanakae (источник: http://namako-sasakic.sakura.ne.jp/~namako/animals/VERTEBRATA/ACTINOPTERYGII/Scorpaeniformes/SCORPAENIFORMES5.html)

Рис. 9. Чернопалый карепрокт Careproctus zachirus (фото А.М. Орлова)
Морские слизни, обитающие в водах материкового склона на глубинах 200–1000 и более метров, выглядят немного иначе: их тело сжато с боков и вытянуто вверх, лучше развиты вертикальные и грудные плавники (рис. 9, 10). Размеры же брюшной присоски, наоборот, незначительны, и у некоторых видов (например, представителей родов Elassodiscus и Paraliparis) составляют всего 1–2 мм. Более всего отличаются от прибрежных те морские слизни, которые живут в толще воды на больших глубинах – батипелагические виды родов Acantholiparis, Nectoliparis, Rhinoliparis). Тело их вытянуто в длину, сжато с боков и постепенно утончается к хвостовому плавнику, превращаясь чуть ли не в нить, все плавники относительно небольших размеров, а брюшная присоска отсутствует.
Плодовитость всех изученных видов морских слизней невысока. Довольно крупные икринки большинство из них откладывает на покрывающие дно гидроиды, губки или непосредственно между камней. У некоторых же видов слизней, обитающих на одной глубине с крабами (камчатским, синим, равношипым и др.), есть замечательное приспособление, позволяющее рыбам прятать икру в более надежное место. Впервые это наблюдал известный российский ученый Т.С. Расс [12] в сентябре 1949 г. у западного побережья Камчатки. Ко времени нереста у самок этих морских слизней вырастает похожий на кожистую трубку яйцеклад длиной до 8–10 см, с помощью которого они откладывают зрелые икринки размером 5–6 мм в околожаберную полость крупных крабов. Отложенные икринки, с одной стороны, надежно защищены крабовым панцирем, с другой – непрерывно омываются током воды, проходящим через жабры краба.

Рис. 10. Шершавый карепрокт Careproctus rastrinus (источник: http://www.knock.ne.jp/cgi-bin/fishdetail.cgi?code=04347)
Бычки или рогатковые (Cottidae). Одни из самых типичных представителей ихтиофауны арктических вод, северной части Атлантического и Тихого океанов, которых в Мировом океане и пресных водоемах насчитывается около 300 видов. По образу жизни рогатковые – типично донные, относительно малоподвижные рыбы, голое или частично покрытое шипами и костяными пластинками тело которых расширено на переднем конце и имеет короткий хвостовой отдел; голова обычно приплюснута, а рот большой (рис. 11). У рогатковых сильно развиты грудные плавники, что связано с превращением их в основной орган движения. На предкрышечных костях этих рыб расположены два мощных, похожих на «рога» шипа, играющие защитную роль (откуда, видимо, и происходит название «бычки») (рис. 12). Размеры рогатковых также очень сильно варьируют. Среди них есть «гиганты» и «карлики». Например, длина отдельных особей многоиглого керчака достигает более 90 см, а масса тела – свыше 10 кг, тогда как размеры таких видов, как ицел Перминова, колючий и черноносый ицелы, жесткочешуйный бычок, тирискус и черноперый крючкорог, не превышают 15–20 см и 50–100 г [17].


Рис. 11. Myoxocephalus scorpius в естественной среде (слева – источник: http://www.seawater.no/fauna/chordata/images/vanligulke3.jpg) и на палубе судна (справа – фото А.Н. Строганова)
Аноплопомовые (Anoplopomatidae). Угольная рыба (Anoplopoma fimbria) – эндемик северной части Тихого океана, распространена вдоль азиатского и американского побережий. Взрослые особи ведут нектобентический образ жизни в водах материкового склона. Максимальные размеры 120 см и 25,4 кг, причем самцы значительно меньше самок и достигают длины 80 см и до 6 кг веса. По разным источникам продолжительность жизни угольной рыбы достигает 20, 70 и даже 94-х лет. В отличие от многих представителей глубоководных рыб достигает половозрелости угольная рыба довольно рано: у Алеутских островов и в Беринговом море созревает в 3–4 года при длине 46–55 см. Нерест начинается в конце декабря и заканчивается в апреле-мае. Икра и личинки пелагические. Молодь и неполовозрелые особи (рис. 13) держатся преимущественно в шельфовой зоне на глубинах 100–220 м, взрослые особи распределяются в верхней батиали на глубинах более 300 м [19].
Морской монах, или эрилепис Erilepis zonifer (Lockington, 1880) (рис. 14), населяет северную часть Тихого океана от прибрежных вод о. Хонсю и Калифорнии на юге до Алеутских о-вов на севере [10], Хотя ранее считалось, что данный вид в северной части Тихого океана имеет амфипацифическое распространение [1, 2], то есть населяет воды по обоим (азиатскому и американскому) побережьям, его ареал разорван на севере и в тропической области.
Известные глубины поимки эрилеписа составляют от 0 до 1030 м [28]. Нерест эрилеписа происходит на материковом склоне на глубинах 300–500 м в южной части ареала. У азиатского побережья районами его размножения являются участки южного и центрального Хонсю, у американского – прибрежные воды Калифорнии. Вероятно, нерест может наблюдаться и на подводных горах. Икра и личинки поднимаются в верхние слои моря и постепенно по мере развития и роста течениями вместе с плавающими водорослями выносятся в открытый океан, где широко распространяются в субтропических и переходных водах и часто попадают в дрифтерные сети [26, 29]. Обитание в верхних слоях в открытом океане продолжается в течение нескольких лет. По достижении длины 40 см и выше в возрасте 4–6 лет эрилепис начинает приближаться к берегам и переходить к придонному образу жизни. В субарктические воды как взрослые особи, так и пелагическая молодь, проникают, по-видимому, лишь в летние месяцы или в периоды крупномасштабных потеплений.


Рис. 12. Двурогий бычок Enophrys diceraus (слева) и многоиглый керчак Myoxocephalus polyacanthocephalus (справа) (фото А.М. Токранова)

Рис. 13. Угольная рыба Anoplopoma fimbria (источник: http://images.marinespecies.org/resized/80784_anoplopoma-fimbria.jpg)

Рис. 14. Морской монах Erilepis zonifer (источник: http://2.bp.blogspot.com/-V6s1j3qmCsE/VObs3BX62lI/AAAAAAAAOEU/DFYp0V9i6sM/s1600/IMG_9367.jpg)
Первые сведения о содержании эрилеписа в неволе появились в конце 1950-х годов, когда несколько молодых экземпляров длиной 20–30 см, пойманных дрифтерными лососевыми сетями у побережья Британской Колумбии, были переданы в Ванкуверский публичный аквариум [14, 21]. Эрилепис, в отличие от многих пелагических рыб, очень легко адаптируется к содержанию в неволе, где может прожить очень долго – известны случаи содержания особей данного вида в течение почти 30 лет [10].
Бельдюговые (Zoarcidae). Обширное и очень разнообразное по составу семейство. По современным представлениям, Северная Пацифика является центром возникновения зоарцид, откуда они затем проникли в бассейны Северного Ледовитого и Атлантического океанов, а также и в антарктические воды. В настоящее время в северной части Тихого океана известно более 100 видов этих рыб [14].
Хотя зоарциды встречаются от приливно-отливной зоны до глубины 3–4 км, основная область обитания большинства из них – глубины 100–600 м. Все зоарциды характеризуются удлиненным, слизистым телом, покрытым мелкой чешуей (у ряда видов оно голое). Спинной и анальный плавники у них длинные и полностью сливаются с небольшим хвостовым плавником, образуя единую плавниковую кайму. Грудные плавники обычно большие, брюшные же, наоборот, малы (или вообще отсутствуют) и расположены на горле (рис. 15–16). Окраска этих рыб довольно своеобразна: у целого ряда зоарцид на сером, коричневом или темном фоне тела расположены яркие глазчатые пятна или светлые (поперечные и продольные) полосы.
Преобладающее большинство зоарцид – типично донные, малоподвижные рыбы, предпочитающие илистые грунты, хотя отдельные виды перешли к жизни в толще воды. Некоторые зоарциды – совсем небольшие рыбки длиной всего 10–15 см и массой в несколько десятков грамм, размеры других достигают 1 м и более, а масса тела – 4–5 кг. У всех представителей этих рыб крупная (до 3–4 мм), донная икра, но часть видов перешла к живорождению, т.е. выметывают уже вполне сформировавшихся мальков. В зависимости от своих размеров, одни зоарциды питаются мелкими донными или пелагическими рачками и червями, другие – такими сравнительно крупными беспозвоночными, как креветки, крабы, раки-отшельники или двустворчатые моллюски; третьи же перешли к хищному образу жизни, успешно охотясь на рыб и кальмаров.

Рис. 15. Ликод Эсмарка Lycodes esmarkii (источник: http://archive.serpentproject.com/1723/01//thumbnails/medium.jpg)
Шипощеки (Sebastolobus spp.). Своеобразная группа морских окуней (Sebastidae), характеризующихся дополнительными рядами колючек на щеках и специфическими чертами биологии. Все шипощеки – аборигены северной части Тихого океана, основной областью обитания которых являются придонные воды материкового склона в интервале глубин 300–800 м.
У берегов Камчатки встречаются два вида шипощеков — крупный аляскинский и мелкий длинноперый (рис. 17–18), причем последний в тихоокеанских водах юго-восточной Камчатки и Северных Курил достигает наибольшей численности по сравнению с остальными районами своего обитания.

Рис. 16. Тихоокеанский ликод Lycodes pacificus (источник: http://www.fishbase.org/images/species/Lypac_u0.jpg)

Рис. 17. Аляскинский шипощек Sebastolobus alascanus (источник: http://sanctuarysimon.org/regional_images/photo_database/KLS_122110_011_thumb.jpg)
Шипощеки созревают довольно поздно (в 10–14 лет) и обладают своеобразным способом размножения. Оплодотворение икринок происходит внутри материнского организма в момент спаривания самца и самки, затем формируется кладка, которая в желеобразной оболочке выметывается в поверхностные слои воды. Выклюнувшиеся из икры личинки длинноперого шипощека первые месяцы жизни обитают в толще воды над большими глубинами, но по мере роста молодь оседает на дно, где и живут взрослые особи этого морского окуня [21].
Обыкновенные или ромбовые скаты (Rajidae). Представители семейства обыкновенных или ромбовых скатов (Rajidae) населяют умеренные и холодные воды морей и океанов. Скаты обладают хрящевым скелетом, характеризуются широким, уплощенным ромбовидной формы телом, обычно покрытым крупными шипами и многочисленными мелкими шипиками (рис. 19–20). Скаты обладают так называемым «конвейерным» способом воспроизводства, т.е. с наступлением зрелости их самки, в течение всей последующей жизни круглый год откладывают яйца, постоянно находящиеся в яичниках на разной стадии созревания – от мельчайших безжелтковых до уже готовых к вымету. Каждое яйцо облачено в гибкую, но прочную роговую капсулу с четырьмя отростками в виде «рожек», с помощью которых оно крепится к грунту. Форма, размеры яиц и роговых отростков и структура яйцевой оболочки специфичны для каждого вида скатов и могут служить надежным инструментом для определения видовой принадлежности [15].


Рис. 18. Длинноперый шипощек Sebastolobus macrochir в судовом аквариуме (фото И.А. Бирюкова)

Рис. 19. Скат Ричардсона Bathyraja richardsoni (источник: https://upload.wikimedia.org/wikipedia/commons/2/2e/Bathyraja_richardsoni.jpg)

Рис. 20. Bathyraja trachura (источник: http://images.marinespecies.org/resized/80790_bathyraja-trachura.jpg)
Треска (Gadus spp.). Необходимо отметить, что даже широко известные промысловые объекты могут быть представлены формами, в силу специфики их биологии демонстрирующими интересные и необычные варианты окраски. В различных акваториях обитают группировки трески как с пелагической (с вариациями оттенков: серо-черный, коричневый, оливковый и даже пойманный в прибрежье Шпицбергена единственный экземпляр трески с золотистой окраской), так и прибрежной (криптической) окраской (рис. 21–24). Причем последний тип окраски в значительной степени «привязан» к цветовой гамме окружающей среды. Так, например, различной интенсивности красно-коричневая окраска трески прибрежных и фиордовых акваторий северо-восточной и северо-западной Атлантики связана с обитанием в зарослях бурых водорослей. Более того, такая треска прибрежья Западного Мурмана даже получила название «турянка» (от слова тура – водоросли, ламинария). Ярко выраженная пятнистость кильдинской трески (рис. 21) несет защитную функцию при питании на галечниковых мелководьях. Темно-серая окраска трески прибрежья Охотского моря, видимо, обусловлена превалирующими тонами грунтов [7, 13, 24, 25, 30, 31].

Рис. 21. Пятнистая треска из озера Могильного (фото Г.А. Рубцовой)

Рис. 22. «Красная треска» залива Мэн (по [25, 31])

Рис. 23. «Черная треска» Охотского моря (фото М.Н. Белого)

Рис. 24. «Золотая треска» из вод Шпицбергена (по [30])
Семейство терпуговые (Hexagrammidae). Все терпуги (рис. 25–26) обитают только в северной части Тихого океана. Семейство представлено 9 видами, объединенными в 3 рода. Несмотря на различия во внешнем виде и образе жизни, общего у них гораздо больше. Более всего сходные черты проявляются при размножении терпуговых рыб. Нерест проходит только при положительных температурах в хорошо аэрируемых водах, икра донная, клейкая, кладки охраняются самцами. Икра откладывается в трещины, расщелины скал и каменистых плит, а также в пространства между камнями и другими укрытиями. Хотя икринки в кладках склеены друг с другом очень крепко, сама кладка пористая, что обеспечивает хороший доступ кислорода по всему ее объему [5].
Семейство камбаловые (Pleuronectidae). Только в северной части Тихого океана представлено почти 50 видами, около 20 из которых встречаются у берегов Камчатки. Целый ряд из них довольно многочисленны, а потому играют существенную роль в трофической системе и служат ценными объектами прибрежного рыболовства. Являясь типично донными рыбами, камбаловые в большинстве своем имеют пелагическую икру, которая сразу же после оплодотворения всплывает в поверхностные слои воды, где происходит эмбриональное, личиночное развитие до метаморфоза. Исключением является лишь северная двухлинейная или белобрюхая камбала, у которой икра развивается на дне.
Несмотря на сходство внешнего строения, камбаловые довольно различны по размерам и окраске (рис. 27–28). Наряду с такими гигантами, как белокорый палтус, достигающий размеров 3 м и 400 кг, длина многих видов камбал не превышает 30–40 см, а масса тела 1 кг [11].

Рис. 25. Северный одноперый терпуг Pleurogrammus monopterygius (фото А.М. Орлова)

Рис. 26. Японский терпуг Hexagrammos otakii (источник: http://namako-sasakic.sakura.ne.jp/~namako/animals/VERTEBRATA/ACTINOPTERYGII/Scorpaeniformes/Image/ainame9.jpg)

Рис. 27. Глубоководная камбала Embassichthys bathybius (фото А.М. Орлова)

Рис. 28. Звездчатая камбала Platichthys stellatus (источник: http://www.floranimal.ru/pages/animal/k/3847.jpg)
Семейство зубатковые (Anarhichadidae). Также очень интересная и специфическая группа морских рыб, отличающихся необычными чертами строения и биологии. Представители семейства зубатковых обитают амфибореально, населяя акватории северных частей Атлантического и Тихого океанов, а также некоторые арктические моря. Центром образования семейства считается Северная Пацифика. Характеризуются длинным уплощенным с боков телом, длинными спинным и анальным плавниками, отсутствием брюшных плавников, крупной головой с мощными зубами. Чрезвычайно хорошо развитая челюстная мускулатура обеспечивает эффективное раздавливание толстых стенок раковин (рис. 29). Питаются моллюсками, иглокожими, ракообразными, рыбой [8].

Рис. 29. Синяя зубатка Anarhichas denticulatus (фото А.А. Новичковой)
Заключение
Представленный обзор представителей бореально-арктической ихтиофауны демонстрирует многообразие объектов, использование которых в составе аквариальных экспозиций позволяет создавать не только эстетически привлекательные композиции, но также и способствует значительному росту экологического знания, пониманию особенностей формирования условий внешней среды, их хрупкости и подверженности различным воздействиям.
Цветовая привлекательность и яркость объектов экспозиций, с одной стороны, привлекает внимание зрителей, а с другой стороны – позволяет лучше узнать население российских прибрежных вод. Необходимо отметить и особенности биологии целого ряда объектов: это и единственная в мире полностью репродуктивно самостоятельная популяция озерной трески, и обладающий сложным родительским поведением пинагор, и живородящие бельдюги, эмбрионы которых имеют наиболее сильно развитую провизорную дыхательную систему, и скаты, каждое яйцо которых облачено в гибкую, роговую капсулу с четырьмя отростками в виде «рожек», с помощью которых оно крепится к грунту, и морские слизни, откладывающие икринки в околожаберную полость крупных крабов и т.д.
Сложность различного рода адаптаций бореально-арктической ихтиофауны обусловлена в том числе особенностями расселения и формобразования в сложных и постоянно (а нередко и кардинально) меняющихся геоморфологических и гидрологических условиях северных акваторий в плиоцен-голоценовый период, подвергшихся череде оледенений и межледниковий, опреснения и осолонения вод, опусканий и поднятий морского дна и др.
Авторы признательны своим коллегам А.А. Новичковой (Московский государственный университет им. М.В. Ломоносова, г. Москва), А.М. Токранову (Камчатский филиал Тихоокеанского института географии ДВО РАН, г. Петропавловск-Камчатский), Р.М. Сабирову (Казанский (Приволжский) федеральный университет, г. Казань), И.А. Бирюкову (ФГБНУ СахНИРО, г. Южно-Сахалинск), Г.А. Рубцовой (Институт общей генетики им. Н.И. Вавилова РАН, г. Москва) и М.Н. Белому (ФГБНУ МагаданНИРО, г. Магадан) за предоставленные фотографии рыб. Статья подготовлена при частичной финансовой поддержке Российского фонда фундаментальных исследований в рамках гранта РФФИ 13-04-00803 «Расселение и эволюционные взаимосвязи популяций тихоокеанской трески в Охотском море».
Библиографическая ссылка
Орлов А.М., Орлов А.М., Строганов А.Н., Телегин А.В. ПЕРСПЕКТИВНЫЕ ДЛЯ ОКЕАНАРИУМОВ ПРЕДСТАВИТЕЛИ БОРЕАЛЬНО-АРКТИЧЕСКОЙ ИХТИОФАУНЫ // Успехи современного естествознания. 2015. № 9-2. С. 317-330;URL: https://natural-sciences.ru/ru/article/view?id=35585 (дата обращения: 06.03.2026).



