Теллурорганические соединения широко используются в современном органическом синтезе как полупродукты и синтоны [7]. Известны соединения теллура, обладающие высокой биологической активностью и проходящие клинические исследования [6, 8–10]. Проводятся систематические исследования по изучению свойств соединения четырехвалентного теллура, трихлор(диоксоэтилен-О,О’)теллурата аммония (препарат AS-101), обладающего мощной иммуномодулирующей активностью [6, 8–10]. Установлено, что это соединение нетоксично и очень эффективно для профилактики и лечения многих заболеваний. Перспективными полупродуктами и синтонами для органического синтеза являются функциональные теллурорганические соединения, которые можно получить на основе реакций присоединения тетрагалогенидов теллура к алкенам [7].
Продолжая исследования реакций присоединения тетрагалогенидов теллура к ненасыщенным соединениям [1–5], авторы изучили взаимодействие тетрахлорида теллура с аллилфениловым и аллилбензиловым эфирами и тетрабромида теллура с аллилбензиловым эфиром. Целью исследования является разработка региоселективных способов получения новых функциональных теллурорганических соединений – перспективных полупродуктов и синтонов для органического синтеза с потенциальной биологической активностью.
Материалы и методы исследования
Спектры ЯМР 1Н и 13С регистрировали на приборе Bruker DPX-400 (рабочие частоты 400.13, и 100.61 МГц, соответственно) в CCl4, внутренний стандарт – ГМДС. Элементный анализ выполнен на приборе Thermo Finigan EA 1112.
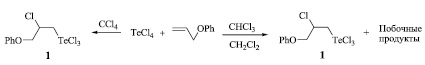
3-Фенилокси-2-хлорпропилтеллуртрихлорид (1). К смеси тетрахлорида теллура (0.54 г, 2 ммоль) и 20 мл CCl4 добавили по каплям раствор аллилфенилового эфира (0.268 г, 2 ммоль) в 5 мл CCl4 и кипятили смесь с обратным холодильником при перемешивании в течение 8 часов. Смесь фильтровали, растворитель отогнали на роторном испарителе, остаток сушили в вакууме. Получили 0.776 г (выход 96 %) 3-фенилокси-2-хлорпропилтеллуртрихлорида (1).
Спектр ЯМР 1Н (400.13 МГц, CDCl3, δ, м.д.): 4.35 м (4H, OCH2, CH2Te, ), 4.82 с (2H, PhCH2), 4.96 м (1H, CHCl), 6.81 м (3Н, Ph), 7.23 м (2Н, Ph).
Спектр ЯМР 13С (100.61 МГц, CDCl3, δ, м.д.): 65.12 (CHCl), 71.97 (CH2Te), 77.92 (CH2O), 115.17 (Ph), 121.55 (Ph), 129.97 (Ph), 158.44 (Ph).
Найдено, %: C 27.02; H 2.65; С1 34.94; Te 32.01. С9Н10ОС14Те. Вычислено, %: C 26.78; H 2.50; С1 35.14; Te 31.62.
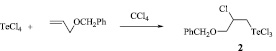
3-Бензилокси-2-хлорпропилтеллуртрихлорид (2). К смеси тетрахлорида теллура (0.54 г, 2 ммоль) и 20 мл CCl4 добавили по каплям раствор аллилбензилового эфира (0.296 г, 2 ммоль) в 5 мл CCl4 и кипятили смесь с обратным холодильником при перемешивании в течение 8 часов. Смесь фильтровали, растворитель отогнали на роторном испарителе, остаток сушили в вакууме. Получили 0.794 г (выход 95 %) 3-бензилокси-2-хлорпропилтеллуртрихлорида (2).
Спектр ЯМР 1Н (400.13 МГц, CDCl3, δ, м.д.): 4.33 м (4H, OCH2, CH2Te), 4.79 с (2H, PhCH2), 4.98 м (1H, CHCl), 7.41 м (5H, Ph).
Спектр ЯМР 13С (100.61 МГц, CDCl3, δ, м.д.): 64.31 (CHCl), 69.20 (PhCH2), 73.10 (CH2Te), 77.90 (CH2O), 128.83 (Ph), 129.35 (Ph), 129.48 (Ph), 134.16 (Ph).
Найдено, %: C 29.08; H 3.08; С1 34.15; Te 30.14. С10Н12ОС14Те. Вычислено, %: C 28.76; H 2.90; С1 33.96; Te 30.55.
3-Бензилокси-2-метоксипропилтеллуртрибромид (3). К смеси тетрабромида теллура (0.894 г, 2 ммоль) и 20 мл метанола добавили по каплям раствор аллилбензилового эфира (0.296 г, 2 ммоль) в 5 мл метанола и кипятили смесь с обратным холодильником при перемешивании в течение 8 часов. Смесь фильтровали, растворитель отогнали на роторном испарителе, остаток сушили в вакууме. Получили 1.154 г (выход 97 %) 3-бензилокси-2-метоксипропилтеллуртрибромида (3).
Спектр ЯМР 1Н (400.13 МГц, CDCl3,δ, м.д.): 3.32 с (3Н, ОСН3), 3.93 м (3Н, ОСН, СН2Те), 4.26 м (1Н, СН2О), 4.52 м (1Н, СН2О), 4.78 с (2H, PhCH2), 6.85 м (3Н, Ph), 7.24 м (2Н, Ph).
Спектр ЯМР 13С (100.61 МГц, CDCl3, δ, м.д.): 56.78 (CH3O), 57.17 (TeCH2), 69.02 (PhCH2), 70.01 (CH2O), 77.37 (CHO), 114.89 (Ph), 121.13 (Ph), 129.57 (Ph), 158.25 (Ph).
Найдено, %: C 24.56; H 2.98; Br 44.13; Te 22.89. С11Н15О2Br3Те. Вычислено, %: C 24.17; H 2.77; Br 43.86; Te 23.35.
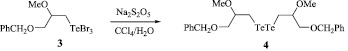
Бис(3-бензилокси-2-метокси)дителлурид (4). К 1.154 г 3-бензилокси-2-метоксипропилтеллуртрибромида (3) добавили 20 мл CCl4 и раствор 2 г Na2S2O5 в 15 мл воды. Смесь перемешивали при комнатной температуре в течение 16 часов. Органическую фазу отделили, сушили Na2SO4, фильтровали. Растворитель отогнали на роторном испарителе, остаток сушили в вакууме. Получили 0.952 г (выход 80 %) бис(3-бензилокси-2-метокси) дителлурида (4).
Спектр ЯМР 1Н (400.13 МГц, CDCl3, δ, м.д.): 3.51 с (3Н, ОСН3), 3.58 м (3Н, ОСН, СН2Те), 3.98 м (1Н, СН2О), 4.04 м (1Н, СН2О), 4.76 с (2H, PhCH2), 6.83 м (3Н, Ph), 7.02 м (2Н, Ph).
Спектр ЯМР 13С (100.61 МГц, CDCl3, δ, м.д.): 10.24 (TeCH2), 57.54 (CH3O), 68.26 (PhCH2), 69.51 (CH2O), 80.24 (CHO), 114.79 (Ph), 120.46 (Ph), 129.57 (Ph), 158.12 (Ph).
Найдено, %: C 42.94; H 5.12; Te 41.23. С22Н30О4Те2. Вычислено, %: C 43.06; H 4.93; Te 41.59.
Результаты исследования и их обсуждение
Исследование реакций тетрахлорида теллура с аллилфениловым и аллилбензиловым эфирами проводилось при использовании в качестве растворителя хлороформа, хлористого метилена и четыреххлористого углерода. Установлено, что для селективного образования моноаддукта лучшим растворителем является четыреххлористый углерод. При кипячении реагентов в четыреххлористом углероде реакция протекает региоселективно с образованием продукта присоединения по правилу Марковникова, ранее неизвестного 3-фенокси-2-хлорпропилтеллуртрихлорида (1), с выходом 96 %. При использовании в аналогичных условиях в качестве растворителя хлороформа или хлористого метилена реакция сопровождалась образованием ряда побочных продуктов.
Реакция тетрахлорида теллура с аллилбензиловым эфиром также селективно протекает при использовании в качестве растворителя четыреххлористого углерода с образованием продукта присоединения по правилу Марковникова, 3-бензилокси-2-хлорпропилтеллуртрихлорида (2), с выходом 95 %.
Установлено, что при использовании в качестве растворителя хлороформа или четыреххлористого углерода в реакции тетрабромида теллура с аллилбензиловым эфиром наблюдается низкая конверсия исходных реагентов. Однако применение метанола существенно ускоряет реакцию присоединения и приводит к полной конверсии аллилбензилового эфира. Реакция протекает региоселективно с внедрением метоксигруппы и образованием продукта присоединения по правилу Марковникова, ранее неизвестного 3-бензилокси-2-метоксипропилтеллуртрибромида (3).
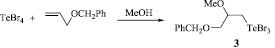
Наиболее высокий выход продукта 3 (97 %) получен при кипячении эквимольных количеств реагентов в метаноле с обратным холодильником в течение 8 часов. Образования бис-аддукта, [PhСН2OCH2CH(OMe)CH2]2TeBr2, а также возможного метанолиза связи Te-Br не наблюдается.
Восстановлением продукта 3 пиросульфитом натрия в двухфазной системе CCl4/H2O с выходом 80 % получен неизвестный ранее бис(3-бензилокси-2-метоксипропил)дителлурид (4).
Строение соединений 1–4 доказано методами ЯМР 1H, 13C и подтверждено данными элементного анализа.
Следует отметить, что тетрабромид теллура, в отличие от TeCl4, является легко доступным соединением, которое можно получить реакцией теллура с бромом при комнатной температуре. Доступность тетрабромида теллура, а также хемо- и региоселективность реакций этого реагента открывают новые возможности в химии теллурорганических соединений.
Выводы
Таким образом, на основе реакций тетрахлорида и тетрабромида теллура с аллилфениловым и аллилбензиловым эфирами разработаны хемо- и региоселективные способы получения функциональных теллурорганических соединений 1–4 – новых перспективных полупродуктов и синтонов для органического синтеза с потенциальной биологической активностью.
Работа выполнена в рамках проекта Российского научного фонда (№ 14-13-01085).
Библиографическая ссылка
Мусалова М.В., Мусалов М.В., Удалова С.И., Хабибулина А.Г., Потапов В.А., Амосова С.В. СИНТЕЗ ФУНКЦИОНАЛЬНЫХ ТЕЛЛУРОРГАНИЧЕСКИХ СОЕДИНЕНИЙ НА ОСНОВЕ ТЕТРАГАЛОГЕНИДОВ ТЕЛЛУРА // Успехи современного естествознания. 2015. № 11-1. С. 78-80;URL: https://natural-sciences.ru/ru/article/view?id=35675 (дата обращения: 17.01.2026).



