Растительные полисахариды – важнейший класс природных соединений, находящих практическое использование в различных областях науки и техники. Полисахариды в последние годы привлекают внимание исследователей в связи с тем, что являются веществами с широким спектром биологической активности [17].
Особое место среди растительных полисахаридов занимают пектиновые полисахариды. Они представляют собой уникальный комплекс биологически активных полисахаридов с детоксицирующими, радиопротекторными и другими лечебно-профилактическими свойствами [4].
Разнообразные по структуре и физико-химическим характеристикам растительные полисахариды обладают обширным набором фармакологических свойств. Они снижают такой важный фактор риска сердечно-сосудистых заболеваний, как уровень холестерина в сыворотке крови. Показано, что ряд производных биополимеров полисахаридного типа проявляют антикоагулянтную активность [4]. Кроме того, некоторые растительные полисахариды можно рассматривать как пребиотики, т.е. пищевые ингредиенты, которые стимулируют рост полезной микрофлоры кишечника и ограничивают размножение патогенных бактерий [7].
Также растительные полисахариды являются перспективными веществами для получения новых соединений путем химической модификации, используемых в нефтедобыче, буровых работах, пищевой, и косметической промышленностях [6].
Кислые полисахариды обладают широким спектром фармакологических свойств, что делает их ценными и перспективными веществами для разработки лекарственных средств при лечении ряда заболеваний.
Известно, что галактуроновая кислота (рис. 1) является главным компонентом пектиновых веществ [11]. Одним из основных этапов исследования структуры полисахаридов является процедура определения в них содержания галактуроновой кислоты.
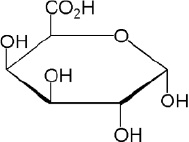
Рис. 1. Структурная формула галактуроновой кислоты
Одним из самых распространенных методов определения галактуроновой кислоты является карбазол-серный метод, основанный на цветной реакции карбазола с продуктами окисления моносахаров, образующихся после разрушения полимерных молекул полисахаридов концентрированной серной кислотой [10]. Преимуществом метода является возможность избирательного определения кислых и нейтральных сахаров. Эта особенность основана на различиях в УФ-спектрах продуктов деградации нейтральных сахаров и уроновых кислот [16]. Недостатками являются трудоемкость метода, длительность, метод требует использования вредных концентрированных кислот и щелочей, осуществляется в несколько этапах, один анализ занимает 6 часов [14].
Поэтому в данной работе в качестве альтернативы карбазол-серного метода для сравнительного определения процентного содержания галактуроновой кислоты в полисахаридах, выделенных из разного растительного сырья, предложен метод потенциометрического титрования, позволяющий оценить количество карбоксильных групп, величину рК полимера и степень ионизации α.
Преимущества данного метода заключаются в том, он более чувствителен; исключает субъективные ошибки, связанные с визуальным установлением конечной точки титрования; позволяет осуществлять титрование в мутных и окрашенных растворах; дает возможность при определенных условиях дифференцированно определять компоненты из одной пробы [9].
Материалы и методы исследования
Объектами исследования служили полисахариды, выделенные из растительного сырья: аира болотного, стебелей и листьев люцерны посевной, листьев липы, девясила, клевера лугового. Выделение полисахаридов проводили в Центре внедрения технологий СибГМУ.
Измерения оптической плотности проводили на спектрофотометре Cary 60 (Agilent Technologies, Германия) в кварцевых кюветах 10 мм.
Потенциометрическое титрование проводили на УЛК-электрохимическом стенде (ООО Томьаналит, Томск).
Определение галактуроновой кислоты карбазол-серным методом
Данный метод основан на цветной реакции карбазола с продуктами окисления моносахаров, образующихся после разрушения полимерных молекул полисахаридов концентрированной серной кислотой.
Для увеличения селективности определения галактуроновой кислоты в растительных полисахаридах и уменьшения влияния нейтральных сахаров на результаты определения галактуроновой кислоты карбазол-серным методом разрушение полимерной молекулы проводили серной кислотой в присутствии сульфаминовой кислоты, которая препятствует реакции карбазола с альдозами, образовавшимися при гидролизе растительных полисахаридов [2].
Методика заключалась в следующем: навеску 0,1000 г растительного полисахарида растворяли в 25 мл воды при интенсивном перемешивании до полного растворения (раствор А). В качестве раствора сравнения использовали дистиллированную воду (раствор Б). В пробирки с раствором А и раствором Б объемом 250 мкл добавляли 0,01 мл раствора сульфаминовой кислоты и тщательно перемешивали. Затем пробирки помещали в емкость со льдом и осторожно, по каплям, по стенке пробирки приливали 1,5 мл раствора тетрабората натрия в серной кислоте, охлажденного до комнатной температуры, не допуская нагревания смеси. Далее пробирки нагревали на кипящей водяной бане в течение 6 минут, после чего вновь охлаждали в емкости со льдом. В пробирку добавляли 0,05 мл раствора карбазола и помещали в кипящую водяную баню на 10 минут, затем охлаждали до комнатной температуры и измеряли оптическую плотность относительно раствора сравнения 525 ± 2 нм [12].
Определение галактуроновой кислоты методом потенциометрического титрования
Потенциометрическое титрование растительных полисахаридов проводили в водных растворах, а также в растворах соли NaCl, разных концентраций: 0,001; 0,025; 0,05 М.
Методика заключалась в следующем: навеску полисахарида 0,0100 г растворяли в 10 мл воды в стакане для титрования емкостью 50 мл. Для непрерывного перемешивания использовали магнитную мешалку. Электрохимическая ячейка состояла из стеклянного и хлоридсеребряного электродов. В качестве титранта использовали 0,01 Н раствор щелочи KOH. Измерение рН производили через каждые 0,2 мл добавки титранта. Точку эквивалентности определяли по методу Грана [13].
Результаты исследования и их обсуждение
Для определения галактуроновой кислоты карбазол-серным методом измеряли оптическую плотность при длине волны 525 ± 2 нм. Градуировочная зависимость оптической плотности комплекса карбазола с кислыми сахарами от концентрации галактуроновой кислоты в модельных растворах представлена на рис. 2. Прямолинейная зависимость наблюдалась в области концентраций галактуроновой кислоты от 0,03 до 0,5 мг/мл.
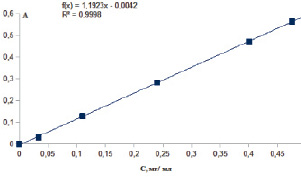
Рис. 2. Зависимость оптической плотности комплекса карбазола с кислыми сахарами от концентрации галактуроновой кислоты в модельных растворах
Общее содержание галактуроновой кислоты в исследуемых образцах полисахаридов проводили методом градуировочного графика с пересчетом результатов в процентах.
Общее содержание галактуроновой кислоты в исследуемых образцах полисахаридов, выраженное в процентах, представлено в табл. 1. Из полученных результатов видно, что наиболее богатыми галактуроновой кислотой являются растительные полисахариды аира болотного и люцерны посевной.
Таблица 1
Общее содержание галактуроновой кислоты в образцах полисахаридов
|
Растительное сырье |
Содержание галактуроновой кислоты, % |
|
Липа |
12,56 ± 0,62 |
|
Девясил |
15,55 ± 0,78 |
|
Аир болотный |
40,33 ± 2,02 |
|
Люцерна посевная |
24,31 ± 1,22 |
Несмотря на то, что карбазол-серный метод широко используется для количественного определения сахаров, он имеет ряд недостатков, таких как длительность подготовки эксперимента, использования вредных и концентрированных кислот и щелочей.
В связи с чем в качестве альтернативы в данной работе предложен метод потенциометрического титрования. На рис. 3 представлена кривая потенциометрического титрования растительных полисахаридов на примере аира болотного.
При использовании потенциометрической индикации конечной точки титрования возникают трудности, связанные с отсутствием четко выраженных перегибов на кривых титрования функциональных групп кислотного характера, что требует последующей математической обработки результатов, такой как построение кривых Грана [1]. Все кривые потенциометрического титрования растительных полисахаридов обработаны по методу Грана.
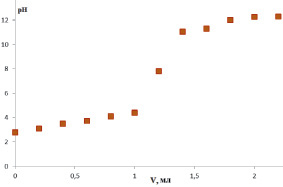
Рис. 3. Кривая потенциометрического титрования аира болотного
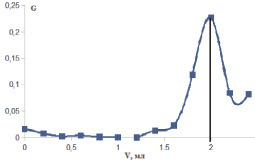
Рис. 4. Определение точки эквивалентности кривой потенциометрического титрования аира болотного методом Грана.
На рис. 4 представлен пример определения конечной точки титрования по методу Грана на примере аира болотного (зависимость величины G от объема титранта):
G = (W + V)·10–Е – для кислой среды;
G = (W + V)·10 (E–14) – для щелочной среды,
где V – объем титранта, мл; E – значения потенциала, В; W – начальный объем пробы, мл.
На основании рис. 4 конечная точка титрования равна объему 2 мл, что соответствует количеству карбоксильных групп 39,90 ± 0,06 %. Результаты по определению галактуроновой кислоты методом потенциометрического титрования в образцах полисахаридов представлены в табл. 2.
Из полученных результатов видно, что наиболее богатые галактуроновой кислотой являются растительные полисахариды, выделенные из аира болотного и люцерны посевной, что согласуется с результатами, полученными карбазол-серным методом.
Таблица 2
Общее содержание галактуроновой кислоты в образцах полисахаридов
|
Растительное сырье |
Содержание галактуроновой кислоты, % |
|
Аир болотный |
39,90 ± 0,06 |
|
Девясил |
15,10 ± 0,04 |
|
Липа |
12,12 ± 0,04 |
|
Люцерна посевная |
24,10 ± 0,06 |
Однако результаты определения галактуроновой кислоты карбазол-серным методом завышены по сравнению с результатами метода потенциометрического титрования, что связано с мешающим влиянием нейтральных сахаров на определение кислых сахаров карбазол-серным методом.
Необходимо отметить преимущество метода потенциометрического титрования для определения количества свободных неэтерифицированных карбоксильных групп и возможностью использования для изучения конформационных свойств растительных полисахаридов.
Известно, что в водных растворах растительным полисахаридам свойственна высокая специфичность уровней структурной организации макромолекул, что оказывает влияние на определенные параметры, определяемые инструментальными методами анализа. Так, например, при подборе элюента для эксклюзионной хроматографии необходимо учитывать конформационные свойства растительных полисахаридов в водных и солевых растворах [8].
Полимеры являются сложными системами, которые имеют вторичную структуру в виде α-спирали и β-спирали за счет слабых электростатистических сил притяжения. Данные свойства проявляются в аномальном ходе кривой титрования, по сравнению с веществами, не обладающими данными свойствами [3].
Исследование конформационных переходов растительных полисахаридов заключается в исследовании зависимости величины константы диссоциации (рК) от степени ионизации (α) [3, 8].
Величину рК определяют из данных потенциометрического титрования растительных полисахаридов и низкомолекулярного аналога (галактуроновой кислоты) по формуле
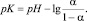
Величина степени ионизации (α) может быть определена либо из справочных данных, либо экспериментально из потенциометрического титрования растворов растительных полисахаридов стандартным раствором KOH. Для нахождения α принимают, что в отсутствии щелочи степень диссоциации = 0, а в точке нейтрализации = 1 и что между количеством добавленной KOH и α существует прямолинейная зависимость [5].
При титровании водных растворов растительных полисахаридов происходит разрушение вторичной структуры макромолекул вследствие взаимного отталкивания одноименных заряженных звеньев цепи. Кооперативный конформационный переход проявляется в аномальном ходе кривых титрования по сравнению с аналогичными кривыми для полиэлектролитов, макромолекулы которых не обладают вторичной структурой в водном растворе [15].
На рис. 5 представлена зависимость константы диссоциации (рК) растительных полисахаридов от степени ионизации (α) в водных растворах на примере полисахаридов аира болотного.
На рисунке можно выделить 3 участка:
I – ионизация внешних карбоксильных групп в структурированной форме (α ~ 0–0,6).
II – участок соответствует конформационному переходу, сопровождающемуся резким увеличением величины рК от α с небольшим пологим участком. На этом участке величина рК с ростом заряда на цепи не увеличивается в связи с компенсацией разворачивания цепи за счет электростатистического отталкивания одноименно заряженных групп и уменьшения линейной плотности заряда.
III – участок подъема кривой, который отвечает ионизации макромолекулы в неструктурированной форме.
Рис. 5. Зависимость константы диссоциации от степени ионизации полисахаридов аира болотного
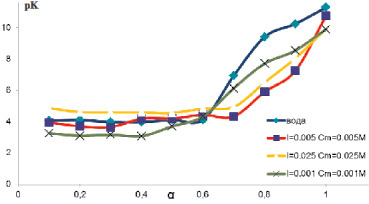
Рис. 6. Зависимости константы диссоциации от степени ионизации аира болотного, полученные при нейтрализации полимера в водном растворе NaCI разных концентраций
Согласно рис. 5 можно отметить, что кривая титрования имеет участок II, что указывает на наличие вторичной структуры (спираль или клубок) в водном растворе.
С введением в раствор растительных полисахаридов сильного электролита происходит ионизация полимера в неструктурированной форме и участок II исчезает.
На рис. 6 представлена кривая титрования зависимости величины рК от α растительных полисахаридов в водном растворе и в солевых растворах разной концентрации на примере аира болотного.
Очевидно, что в водном растворе NaCI при повышении его концентрации аномальный переход кривой титрования не наблюдается. В растворах солей для растительных полисахаридов свойственно разрушение вторичной структуры. В связи с этим в водном растворе NaCI (0,005 М) кривая титрования приобретает стандартный вид. Таким образом, методом потенциометрического титрования можно учесть результаты исследования конформационных свойств растительных полисахаридов при подборе подвижной фазы для определения молекулярной массы методом эксклюзионной хроматографии.
Выводы
Проведено сравнительное определение галактуроновой кислоты в растительных полисахаридах карбазол-серным методом и методом потенциометрического титрования. Результаты определения галактуроновой кислоты карбазол-серным методом завышены по сравнению с результатами метода потенциометрического титрования, что связано с мешающим влиянием нейтральных сахаров на определение кислых сахаров карбазол-серным методом. Наиболее богатыми галактуроновой кислотой являются растительные полисахариды, выделенные из аира болотного. Отмечено, что метод потенциометрического титрования является достаточно простым в использовании, экспрессным и недорогим по сравнению с карбазол-серным методом.
Исследованы конформационные свойства растительных полисахаридов при анализе кривых титрования растворов полисахаридов (зависимость рК от α) без и с последующим добавлением растворов NaCI разных концентраций. Выявлено, что при концентрации NaCI 0,05 М аномальный ход кривой титрования не наблюдается, что связано с ионизацией полимера из неструктурированной формы, вторичная структура полимера исчезает при введении сильного электролита в раствор полисахарида.
Библиографическая ссылка
Гашевская А.С. ПОТЕНЦИОМЕТРИЧЕСКИЙ И КАРБАЗОЛ-СЕРНЫЙ МЕТОДЫ ОПРЕДЕЛЕНИЯ ГАЛАКТУРОНОВОЙ КИСЛОТЫ В РАСТИТЕЛЬНЫХ ПОЛИСАХАРИДАХ // Успехи современного естествознания. 2016. № 2. С. 9-15;URL: https://natural-sciences.ru/ru/article/view?id=35778 (дата обращения: 11.02.2026).



