Антоцианы являются подклассом флавоноидов, их особенность – высокая растворимость в воде, существование в растворах нескольких рН-зависимых и независимых форм, некоторые из которых обладают окраской, а также высокая антиоксидантная активность и связанная с ней высокая биологическая активность [3]. В сфере интересов ученых антоцианы находятся с начала 20-го века, поэтому к настоящему времени накоплена обширная информация о свойствах этих соединений, которая, к сожалению, не всегда учитывается в современных работах. Так, например, при спектрофотометрическом определении антоцианов [1, 6] в пересчете на цианидин-3-глюкозид (или на мальвидин-3-глюкозид), выполняемом по принятой во всем мире методике, измеряют оптическую плотность растворов при двух рН для исключения из суммы полимерных антоцианов. При этом, во-первых, не совсем понятно, зачем делают такое исключение, поскольку никто не анализировал влияние присутствия полимерных антоцианов ни на красящие свойства, ни на антиоксидантные свойства сложных смесей антоцианов. Но, во-вторых, наиболее любопытно требование выдержки раствора после понижения установления рН (1,0 или 4,5) 15 мин и не более 1 ч. По мнению авторов [6], при большей выдержке возможно получение завышенных показаний спектрофотометра (All measurements should be made between 15 min and 1 hr after sample preparation, since longer standing times tend to increase observed readings). Это довольно странно, поскольку дополнительный биосинтез антоцианов в экстрактах при рН = 1, представляется маловероятным. Настоящая работа посвящена экспериментальному анализу обоснованности данного требования.
Экспериментальная часть
Для проведения исследований в настоящей работе были выбраны антоцианы экстрактов плодов паслена черного и черники, а также антоцианы экстракта оберток пурпурной кукурузы. Антоцианы первого источника представлены ацилированными гидроксикоричными кислотами 3,5-дигликозилированных производных антоцианидинов дельфинидинового ряда [2]; они были выбраны в качестве наиболее стабильных (по литературным данным) антоцианов [7]. Во втором случае в экстракте обнаруживают сложную смесь простых моногликозидов антоцианидинов дельфинидинового и цианидинового рядов [3], а в третьем случае в антоциановом комплексе превалируют производные только цианидина, большей частью ацилированные малоновой кислотой [4].
Экстракты получали настаиванием растительного материала в 0,1 М водном растворе HCl с последующим отделением экстракта от остатка фильтрованием через бумажный фильтр. Заданное значение рН (перед пробоподготовкой к спектрофотометрическому определению) устанавливали добавлением к аликвотной порции экстракта 1 М водных растворов HCl и NaOH с потенциометрическим контролем реакции среды (рН-метр Эксперт-рН, стеклянный комбинированный электрод ЭСК-1). Перед измерением оптической плотности растворов (спектрофотометр Shimadzu UV-2550, кварцевые кюветы с длиной оптического пути 1 см) растворы готовили по методике [6].
Результаты исследования и их обсуждение
В средах от сильнокислых до слабокислых антоцианы могут существовать в виде четырех различных структур, между которыми устанавливается равновесие. Наиболее важна (как природный краситель) флавилиевая форма, I, в водных растворах окрашенная в красные тона – от оранжевого до синеватого оттенков (λmax = 490–530 нм), – в зависимости от строения. Считается, что при рН = 1 и ниже на ее долю в растворах приходится основная часть антоцианов. При повышении рН флавилиевая форма переходит в форму псевдооснования (полуацетальную), II. Эта форма не окрашена, – максимум абсорбции находится в коротковолновой области (около 270 нм). Полуацетали изомеризуются до цис- и транс-халконных форм (III и IV), которые должны иметь лишь немногим более длинноволновые максимумы абсорбции в УФ-диапазоне (330 и более нм) (рис. 1).
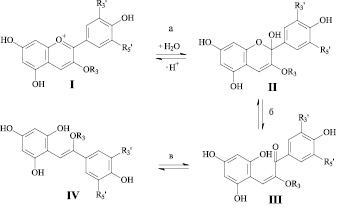
Рис. 1. Равновесия между четырьмя формами антоцианов
Рассмотрим равновесие (a) между флавилиевой формой антоцианов (A+, I) и полуацетальной (B, II), которое можно представить уравнением
A+ + Н2О = В + Н+. (1)
Такое равновесие описывается кажущейся константой равновесия (К):
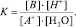 (2)
(2)
Если при одинаковой суммарной концентрации антоцианов изменять рН раствора, то характеристическая (для многих производных цианидина с максимумом абсорбции в районе 510–515 нм) окраска раствора будет ослабевать вследствие образования бесцветной полуацетальной формы В:
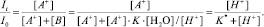 (3)
(3)
Введенная константа K* определяется как К·[H2O]. При этом результаты моделирования изменения окраски, представленные на рис. 2, показывают, что для значений констант на границах интервала (0,001; 0,003) следует ожидать недоопределения антоцианов из-за неполного превращения (на 1 и 3 % соответственно) их во флавилиевую форму, а также из-за неполного обесцвечивания (на 3 и 1 % соответственно) при переходе в форму полуацеталя. При этом как рост, так и уменьшение константы приведет только к увеличению недоопределения антоцианов из-за крутых спуска и подъема кривых на рис. 2.
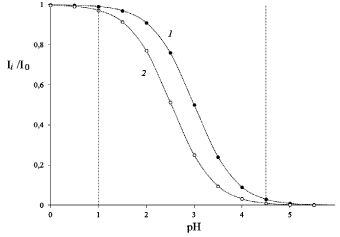
Рис. 2. Моделирование изменения интенсивности окраски раствора антоцианов в зависимости от рН и константы гидратации флавилиевого иона: К* = 0,001 (1) и 0,003 (2)
Вовлечение халконных форм (при установлении равновесия) ничего не меняет, поскольку равновесие между этими формами не зависит от рН. Таким образом, выбор рН трудно считать обоснованным. Действительно, тенденция к снижению оптической плотности при повышении рН ниже рН = 4,5 была установлена нами для ряда экстрактов. Впрочем, значительное повышение рН может привести к появлению окрашенных хиноидных структур, а неполнота определения антоцианов при использовании указанных рН может быть скорректирована изменением (уменьшением на 4 %) коэффициента молярного погашения. Следует также учитывать, что предложение добавлять к экстракту более чем четырехкратного объем ацетатного буфера, без контроля рН полученного раствора, строго говоря, некорректно. Растительные экстракты также представляют собой буферные растворы, поэтому и буферной емкости добавки может не хватить для достижения рН = 4,5.
Из литературных данных известно, что равновесия (рис. 1, а и б) устанавливаются быстро, но равновесие (рис. 1, в) – очень медленно [8], хотя представить себе возврат менее напряженной структуры IV в стерически напряженную структуру III трудно. В другой работе [9] в качестве медленной стадии рассматривается переход II в III, а возврат трансхалконной формы IV в III и далее через II в I возможен при УФ-облучении или под действием кислотного катализа.
В настоящей работе мы исследовали поведение в растворах не индивидуальных соединений, а экстрактов, которые кроме антоцианов могут содержать сопутствующие экстрактивные вещества; именно этот случай имеет первостепенное значение для реального определения суммы антоцианов в исследуемых объектах. При этом эксперимент был проведен так, что каждый из исходных экстрактов делили на три равные части, создавая в одной из них рН = 1 (что требуется по методике [1]). В другой части рН повышали до ~3 (имитация соков или иных прохладительных напитков, которые могут быть стартовым материалом), а в третьей – рН ~ 4,5 (для полного, по мнению составителей методик [1, 6], перехода антоцианов из I в II–IV. Затем после выдержки в течение примерно 1 ч получали по три раствора для каждого объекта с одинаковой суммарной концентрацией антоцианов, в которых рН был возвращен до рН = 1 – для определения антоцианов.
В результате выполненных исследований было установлено, что в случае экстракта плодов черники всех трех растворов (с рН = 1; 3 и 4,5) после возврата к рН = 1 наблюдается далеко не мгновенное превращение всех форм в I (рис. 3). Выдержка раствора даже в течение 1 ч (не говоря уже о 15 мин) недостаточна для возврата к равновесной концентрации флавилиевой формы – недоопределение антоцианов по методикам, предложенным в [1, 6], находится на уровне 2,5–3,5 процентов и вырастает до 5–7 % при выдержке в течение 15 мин. При этом увеличение выдержки до 1 суток (по нашим данным) приводит обычно к росту оптической плотности растворов еще на 1–2 %, хотя иногда этот рост компенсируется разрушением антоцианов.
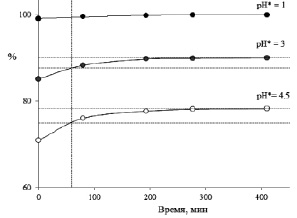
Рис. 3. Превращение во флавилиевую форму антоцианов плодов черники при возврате рН к 1 от трех различных стартовых рН*
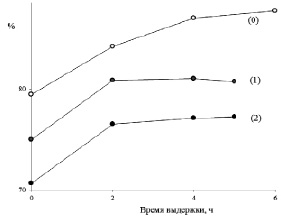
Рис. 4. Возврат к флавилиевой форме антоцианов плодов черники после хранения при рН = 4,5 в течение 0; 1 и 2 суток (числа в скобках) после возврата к рН = 1
При исследовании стабильности антоцианов растворы выдерживали при рН = 3 и при рН = 4,5 в течение 0, 1 и 2-х суток с последующим возвратом к рН = 1. В результате выполненной работы было установлено, что необратимые потери антоцианов даже при небольшой выдержке оказываются весьма значительными – от 10 до 21 % при минимальной выдержке и с тенденцией к росту потерь с увеличением рН промежуточного раствора и времени выдержки такого раствора (рис. 4).
Причин таких потерь может быть несколько – от окисления менее устойчивых по отношению к внешним воздействиям форм II–IV до образования формы IV, не превращающейся обратно в III в условиях проведения эксперимента. Дифференциация и определение типа потерь можно выполнить, исследуя индивидуально выделенные антоцианы, но в данной работе мы основное внимание уделяем образцам, для контроля концентрации антоцианов в которых и разработана методика [5]. Но в целом полученные данные не противоречат идее о том, что равновесие (б) устанавливается не мгновенно, а равновесие (в) вообще трудно достичь, при быстрой скорости превращения цис-халконной формы в трансхалконную. Так при рН = 3 на долю флавилиевого иона может приходиться менее половины антоцианов (по графику на рис. 2), а при рН = 4,5 флавилиевая форма остается только в небольших количествах (до 5 %). То есть доля, приходящаяся на полуацетальную форму, в первом случае изначально примерно вдвое меньше, чем во втором. Соответственно, в тех же соотношениях будут находиться цис-халконные формы, и тогда понятно, почему безвозвратных потерь (из-за перехода в транс-форму) во втором случае вдвое больше, чем в первом. В принципе, увеличение невозвратных потерь с ростом времени выдержки раствора при «неблагоприятных» для флавилиевой формы рН, рис. 4, также укладывается в высказанную идею, хотя для строгих выводов следует провести работу по исключению возможности окисления продуктов кислородом воздуха.
Для аналогичного эксперимента с экстрактом плодов паслена черного безвозвратные потери антоцианов оказались существенно меньшими (около 5 % при минимальной выдержке растворов), что подтверждает большую устойчивость антоцианов, ацилированных замещенными коричными кислотами, по сравнению с простыми гликозидами антоцианидинов [7]. Причиной такой устойчивости может быть стабилизация форм I и II за счет внутримолекулярного стэкинга – упаковки кольца В флавилиевой основы и ароматического кольца радикала пара-кумаровой кислоты, ацилирующей рутинозидный фрагмент структуры. Такой стэкинг-эффект может обеспечить жесткость конструкции антоцианов и, как следствие, к большим энергетическим барьерам на пути превращения псевдооснования в халконные формы.
В случае антоцианов оберток початков кукурузы, особенность которых – ацилирование малоновой кислотой, невозвратные потери антоцианов также не превышали 5 %, но наблюдался более медленный и длительный возврат к флавилиевой форме. Такое поведение не удивительно, поскольку повышение стабильности (без указания причин этого повышения) для антоцианов, ацилированных алифатическими, особенно дикарбоновыми кислотами, известно [10]. Для этого объекта для завершения рассматриваемого процесса необходима выдержка раствора в течение суток и более, поэтому по [1, 6] недоопределение антоцианов превысит 6 %.
Таким образом, при определении общего содержания антоцианов по методикам [1, 6] в общем случае требуется выдержка раствора с рН = 1 в течение не менее 6 ч. Но лучше рекомендовать выдержку в течение ночи, например, сопряженную с экстракцией антоцианов из растительного материала.
Библиографическая ссылка
Дейнека Л.А., Блинова И.П., Кульченко Я.И., Озер П.С., Саенко И.И., Дейнека В.И. СОХРАННОСТЬ И ПЕРЕХОД МЕЖДУ ФОРМАМИ АНТОЦИАНОВ В РАСТВОРАХ // Успехи современного естествознания. 2016. № 2. С. 16-20;URL: https://natural-sciences.ru/ru/article/view?id=35779 (дата обращения: 11.02.2026).



