В последние годы химиотерапии уделяют особое внимание как средству блокировки злокачественной трансформации на ранних стадиях заболевания и прогрессирования на более поздних стадиях. Фитотерапия по-прежнему является наиболее распространенным источником первичной медико-санитарной помощи у 65–80 % населения мира, в основном в развивающихся странах. Это связано с лучшей культурной приемлемостью, лучшей совместимостью с человеческим телом и меньшим количеством побочных эффектов. Листья, цветы, стебли, корни, семена, плоды являются составляющими растительных лекарственных средств. Именно растения имеют фитохимические компоненты, которые оказывают определенные физиологические действия на организм человека. Наиболее важными из этих компонентов являются алкалоиды, дубильные вещества, флавоноиды и фенольные соединения [8].
Ареалом происхождения растений рода Brassica являются Западная Европа, Средиземноморье и умеренные области Азии. В дополнение к культивируемым видам, которые выращиваются по всему миру, многие из диких видов растут как сорняки, особенно в Северной и Южной Америке, Австралии. Растения этого рода являются самыми главными представителями семейства Brassicaceae. Виды Brassica находят широкое применение в кухне многих стран и признаны в качестве ценного источника пищевых волокон, витаминов и минералов. Они содержат мало жира и большое количество фитохимических веществ, некоторые из которых защищают от канцерогенеза. Следовательно, крестоцветные, как полагают, могут быть полезными в профилактике лечения раковых заболеваний.
Капуста белокочанная (Brassica oleracea L.) – двулетнее растение семейства Brassicaceae, распространенное во всех странах мира с умеренным климатом. Эта культура хорошо известна в народной медицине. Ее применяют при лечении таких заболеваний, как язвенные болезни желудка и двенадцатиперстной кишки, воспалительных процессов слизистых покровов, а также рака желудка и кишечника. Экстракты капусты белокочанной проявляют цитотоксическую активность по отношению к раковым клеткам in vitro, что предположительно обусловлено действием цитотоксических метаболитов растения.
Цель настоящей работы – изучить цитотоксическое действие экстрактов, полученных из растений-регенерантов капусты белокочанной (Brassica oleracea L.), на линию опухолевых клеток М HeLa.
Материалы и методы исследования
Работу проводили на кафедре генетики, биотехнологии, селекции и семеноводства РГАУ ‒ МСХА имени К.А. Тимирязева. Растительный экстракт получали из листьев гаплоидных и диплоидных растений Brassica oleracea L., полученных из репродуктивных органов in vitro.
Для получения экстракта брали сухую массу образца (200...500 мг), которую экстрагировали 100 %-ным метанолом (3...5 мл), путем растирания ее в ступке. После этого полученную массу помещали в стеклянные пробирки и оставляли при комнатной температуре на 1 сутки. По истечении времени экстракции анализируемый образец дважды фильтровали через фильтровальную бумагу, после чего растительный экстракт лиофильно высушивали. В дальнейшем осадок растворяли в дистиллированной воде (1 мл) и стерилизовали через бактериологический фильтр. Полученные стерильные экстракты добавляли в культуральную среду в различных концентрациях.
Изучение цитотоксичности проводили в лаборатории молекулярной биологии Института проблем химической физики РАН. Для исследования цитотоксичности использовали линию клеток M HeLa (эпителиоидная карцинома шейки матки человека, сублиния HeLa, клон M HeLa, коллекция Института цитологии РАН, Санкт-Петербург). Культивирование опухолевых клеток проводили согласно общепринятой методике [2]. Клетки выращивали на среде EMEM (Игла-МЕМ) с добавлением 10 % эмбриональной телячьей сыворотки и 1 % NEAA (незаменимые аминокислоты) в атмосфере 5 % СО2 и температуре 37 °С.
Для проведения экспериментов клетки рассевали в 96-луночные культуральные планшеты с плотностью культуры 50000 кл/мл по 100 мкл среды в лунку. Через 24 ч после посева культуральную среду удаляли и заменяли средой с различными концентрациями растительных экстрактов. Инкубацию клеток с экстрактами проводили в течение 72 ч.
Повторность в одном эксперименте каждого варианта 8-кратная, представлены данные 2 независимых экспериментов. Для определения количества выживших клеток использовали метод МТТ-теста. В каждую лунку после 72 ч культивирования наносили 10 мкл раствора МТТ-красителя и инкубировали в стандартных условиях в течение 3 ч. Культуральную среду удаляли водоструйным насосом и окрашенные клетки растворяли в 200 мкл ДМСО. Планшет помещали на шейкер для полного растворения клеток (15...20 мин). Измерение поглощения проводили при длине волны 570 нм на планшетном фотометре «Эфос». Затем проводили расчет интенсивности МТТ-окрашивания в процентах относительно контроля (контроль – 100 %). Чем выше процент окрашивания, тем выше жизнеспособность клеток и ниже цитотоксичность экстрактов.
Статистическую обработку результатов эксперимента проводили с использованием параметрических критериев Стьюдента и Дункана с помощью программы AGROS (версия 2.11), а также стандартных пакетов программы Windows Excel 2010.
Результаты исследования и их обсуждение
В первой серии экспериментов было изучено действие растительных экстрактов, полученных из растений-регенерантов селекционного образца 11-30 (ВНИИССОК) капусты белокочанной на клетки M HeLa. В работе изучали влияние экстрактов в концентрации 50 и 500 мкл/мл (рис. 1).
В результате проведенных исследований нами было установлено, что максимальной цитотоксической активностью по отношению к клеткам M HeLa обладают экстракты, полученные из гаплоидных растений, независимо от исследуемой их концентрации. Вероятно, это обусловлено более высоким накоплением вторичных метаболитов в клетках растений, в частности фенольных соединений, обладающих цитотоксической активностью [1].
Кроме того, нами установлено, что высокие концентрации растительных экстрактов гаплоидных растений приводили к гибели раковых клеток в 28,7 % случаев, в то время как экстракты диплоидных растений – в 10,0 % случаев. При низких концентрациях (50 мкл/мл) цитотоксический эффект был слабо выражен. Поэтому в следующей серии эксперимента нами было изучено действие экстрактов, полученных из других селекционных образцов, только в концентрации 500 мкл/мл (рис. 2).
Установлено, что для всех изучаемых селекционных образцов максимальной цитотоксической активностью обладали экстракты, полученные из гаплоидных растений капусты белокочанной. В этих вариантах жизнеспособность раковых клеток составила в среднем 75–78 %, в то время как при использовании экстрактов диплоидных растений этот показатель находился в пределах 86–95 %.
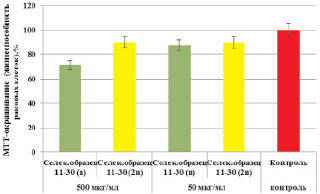
Рис. 1. Влияние концентрации экстракта капусты белокочанной на жизнеспособность опухолевых клеток M HeLa
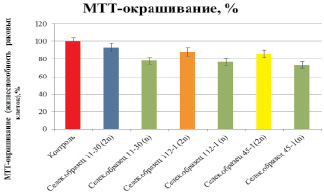
Рис. 2. Влияние экстракта капусты белокочанной на жизнеспособность опухолевых клеток M HeLa
Уменьшение роста клеток может быть связано с влиянием какого-либо соединения, особенно таких, как изотиоцианаты – сульфорафан, эруцин (4 метилсульфинил-3-бутенил), которые связаны с индукцией II фазы детоксикации ферментов (монофункциональные индукторы), играющие важную роль в детоксикации канцерогенов [6, 7]. Также сульфорафан участвует в ингибировании пролиферации опухолевых клеток, индукции апоптоза, защиты от повреждений ДНК, вызванных различными ксенобиотиками [3]. Эруцин (4 метилсульфинил-3-бутенил), который является аналогом сульфорафана, также представляет интерес для исследователей в области здравоохранения [10]. Именно он участвует в остановке клеточного цикла на клетках Т-лейкемии Jurkat и в будущем может служить в качестве химиопрофилактического агента [5]. Эти изотиоцианаты уменьшают риск развития различных видов рака, таких как рак молочной железы, рак желудка и рак кожи [9]. Многие исследования показали, что некоторые соединения, такие как индолы, естественным образом присутствуют в растениях рода Brassica, и они индуцируют апоптоз в различных типах рака [4]. Вероятно, этим и обуславливается цитотоксическое действие экстрактов растений рода Brassica по отношению к опухолевым клеткам.
Выводы
Таким образом, полученные результаты свидетельствуют о том, что у растений-регенерантов капусты белокочанной, полученных из репродуктивных органов in vitro, синтез вторичных соединений сохраняется на более высоком уровне у гаплоидных растений, что, вероятно, и оказывает влияние на цитотоксическую активность их экстрактов.
Библиографическая ссылка
Киракосян Р.Н., Балакина А.А., Калашникова Е.А. ВЛИЯНИЕ ЭКСТРАКТОВ КАПУСТЫ БЕЛОКОЧАННОЙ (BRASSICA OLERACEA L.) НА ЛИНИЮ ОПУХОЛЕВЫХ КЛЕТОК М HELА // Успехи современного естествознания. 2016. № 2. С. 85-88;URL: https://natural-sciences.ru/ru/article/view?id=35794 (дата обращения: 10.03.2026).



