Исследование взаимодействия солей РЗЭ с амидами представляет интерес для синтеза новых комплексных соединений, перспективных в качестве физиологически активных веществ [1].
РЗЭ обладают уникальным комплексом физико-химических свойств в силу особенностей электронного строения атомов, и области применения их соединений неуклонно расширяются год от года. В литературе отсутствуют сведения о координационных соединениях гольмия с амидом никотиновой кислоты. В связи с этим поиск и синтез новых металлоамидных комплексов с полезными свойствами является актуальной задачей.
Целью настоящей работы является исследование взаимодействия хлорида гольмия с амидом никотиновой кислоты, выяснение условий образования соединения и изучение их физико-химических свойств.
Экспериментальная часть
Исследование процессов комплекс образования в системе хлорид гольмия – никотинамид – вода проводилось изотермическим методом растворимости при 30 °С. В качестве исходных веществ использовали предварительно перекристаллизованные из водных растворов хлорид гольмия и никотинамид марки «хч». Равновесие в системе устанавливалось в течение 48 ч. Составы твердых фаз (в мас. %) устанавливали методом «остатков» Скрейнемакерса [2]. Химический анализ проводили на ионы гольмия, трилонометрическим методом [3], а азот никотинамида определяли известным методом Къельдаля [4].
Таблица 1
Данные по растворимости в системе НоCl3–C6H6N2O–H2O при 30 °С
|
№ п/п |
Состав жидкой фазы, мас. % |
Состав твердой фазы, мас. % |
Кристаллизующаяся фаза |
||
|
HoCI3 |
C6H6N2O |
HoCI3 |
C6H6N2O |
||
|
1 |
51,28 |
– |
71,61 |
– |
HoCI3∙6H2O |
|
2 |
50,80 |
1,67 |
62,65 |
0,69 |
|
|
3 |
50,50 |
4,57 |
63,60 |
1,79 |
|
|
4 |
51,59 |
8,80 |
63,44 |
3,22 |
|
|
5 |
51,61 |
8,81 |
68,44 |
12,80 |
HoCI3∙6H2O + HoCI3∙3C6H6N2O∙6H2O. |
|
6 |
51,60 |
8,81 |
57,85 |
28,42 |
|
|
7 |
51,58 |
8,79 |
40,98 |
37,00 |
HoCI3·3C6H6N2O·6H2O |
|
8 |
41,90 |
8,82 |
37,27 |
43,22 |
|
|
9 |
36,25 |
11,60 |
36,42 |
33,20 |
|
|
10 |
31,24 |
13,65 |
35,50 |
43,60 |
|
|
11 |
26,50 |
16,70 |
32,10 |
36,60 |
|
|
12 |
24,90 |
20,89 |
33,00 |
41,20 |
|
|
13 |
22,80 |
22,97 |
32,90 |
43,22 |
|
|
14 |
20,50 |
26,60 |
27,58 |
38,80 |
|
|
15 |
18,40 |
30,43 |
27,50 |
42,40 |
|
|
16 |
16,60 |
35,30 |
28,40 |
46,80 |
|
|
17 |
16,58 |
43,44 |
25,76 |
59,90 |
HoCI3·3C6H6N2O·6H2O + C6H6N2O |
|
18 |
16,56 |
43,46 |
18,20 |
69,20 |
|
|
19 |
16,55 |
43,42 |
5,38 |
82,21 |
C6H6N2O |
|
20 |
13,40 |
42,62 |
3,18 |
86,00 |
|
|
21 |
8,00 |
42,80 |
2,10 |
83,90 |
|
|
22 |
3,98 |
43,90 |
1,30 |
80,00 |
|
|
23 |
– |
45,89 |
– |
– |
|
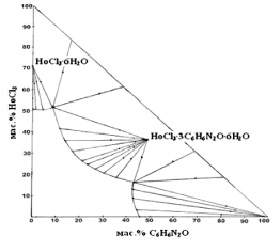
Рис. 1. Изотерма растворимости системы НоCl3–C6H6N2O–H2O при 30 °С
Система НоCl3–C6H6N2O–H2O при 30 °С
Изотерма растворимости данной системы характеризуется наличием трех ветвей кристаллизации твердых фаз (табл. 1, рис. 1). Первая ветвь кривой ликвидуса отвечает насыщенным растворам, из которых в твердую фазу кристаллизуется шестиводный хлорид гольмия, растворимость которого при 30 °С составляет 51,28 %. Точки 5, 6 являются переходными точками.
Вторая ветвь кривой растворимости, лежащая между точками 7–16, соответствует равновесным с твердой фазой растворам, из которых выделяется в твердую фазу новое комплексное соединение, растворяющееся в воде конгруэнтно с соотношением реагентов 1:3:6. На это указывает пересечение лучей Скрейнемакерса на гипотенузе в одной точке, которой соответствует следующее содержание реагирующих веществ: хлорида гольмия 36,38 %, амида никотиновой кислоты 49,20 %, воды 14,42 %.
С целью подбора индифферентной жидкости для установления относительной плотности исследована растворимость нового соединения в органических растворителях. Определение растворимости проводили широко известным методом по разности масс.
В качестве растворителя использовались этиловый спирт, ацетон, бензол и диэтиловый эфир (табл. 2).
Соединение хорошо растворяется в этаноле, несколько хуже в ацетоне, эфире и нерастворимо в бензоле. Относительная плотность нового соединения резко отличается от плотности исходной соли и имеет меньшее значение. Это указывает на более рыхлую структуру нового соединения.
Для определения места локализации химической связи никотинамида в комплексе исследованы ИК спектры поглощения никотинамида и его координационного соединения с хлоридом гольмия в области 400–4000 см–1 на спектрометре «Nicolet-IR-1200» в виде таблеток с бромистым калием. Значения характеристических частот на ИК спектре поглощения приведены в табл. 3.
Таблица 2
Растворимость комплексного соединения в органических растворителях
|
Соединение |
Растворимость, мас. % |
Пикнометрическая плотность, г/см3 |
Рентгеновская плотность, г/см3 |
|||
|
Спирт |
Ацетон |
Эфир |
Бензол |
|||
|
HoCI3∙3C6H6N2O∙6H2O |
10,32 |
4,96 |
1,17 |
н.р. |
1,4345 |
1,4260 |
Таблица 3
Основные колебательные частоты (см–1) никотинамида, комплексного соединения и их отнесение
|
Предполагаемые отнесения |
Полосы поглощения в никотинамиде C6H6N2О |
Полосы поглощения в комплексе HoCI3·3C6H6N2О·6H2O |
|
νas(NН2), ν(ОН) |
3367 |
3309 |
|
νs(NН2) |
3164 |
– |
|
ν(CO) |
1698 |
1660 |
|
δ(NН2), δ(Н2О) |
1619 |
1608 |
|
ν(кольца) |
1592, 1574 |
1592 1570 |
|
ν(кольца) |
1485 |
– |
|
δ(ССН) |
1422 |
1424 |
|
ν(CN) |
1340 |
1401 |
|
δ(ССС) |
1202 |
1202 |
|
δ(NН2), ν(CO) |
1154 |
1157 |
|
δ(ССН) |
1123, 936 |
1121 |
|
ν(кольца) |
1029 |
1029 |
|
ν(СС) |
829 |
827 |
|
δ(СО), δ(CNС) |
628 |
616 |
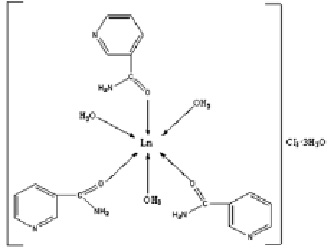
В ИК спектре поглощения никотинамидного комплекса хлорида гольмия наблюдается понижение частоты валентного колебания C=O [n(C=O)] в низкочастотную область от 1698 до 1660 см–1 по сравнению с некоординированным никотинамидом и повышение частот валентного колебания связи С-N [n(C-N)] от 1340 до 1401 см–1.
Эти изменения в положениях полос «амид I» и «амид II» позволяют говорить о координации лиганда через атом кислорода карбонильной группы.
Полосы деформационных колебаний δ(NH2)-группы несколько смещены в область низких частот от 1619 до 1608 см–1, что объясняется упрочнением связи C-N [5]. В области 1600–1700 см–1 проявляются полосы δ(H2O), перекрывающиеся с интенсивными полосами n(СО) и n(NH). Исходя из вышеизложенного, предполагаемое строение комплексного соединения можно представить следующим образом.
Таким образом, в изученном нами комплексе координация никотинамида к иону гольмия осуществляется через атом кислорода карбонильной группы.
Кристаллическая рентгенограмма комплекса снята на приборе ДРОН-3 (СоКα излуч.).
По данным рентгенофазового анализа рассчитаны интенсивности линий, межплоскостные расстояния, параметры элементарных ячеек (табл. 4) и сделан вывод, что в рентгенограмме комплекса имеются характерные линии, которые хорошо индицируются в моноклинной сингонии.
Термографический анализ был снят на дериватографе NETZSCHSTA 409PC/PG. Термограмма соединения HoCl3·3C6H6N2O·6Н2О характеризуется наличием нескольких термических эффектов. По характеру кривых ДТА и ТГ следует, что процесс разложения соединения протекает ступенчато. В первом эндотермическом эффекте при 125,6° происходит дегидратация соединения и удаление одной молекулы никотинамида. Это подтверждается потерей массы, которая согласно кривой термогравиметрии составляет 32,18 % от взятой навески и хорошо согласуется с теоретическим содержанием одной молекулы лиганда (17,69 %) и шести молекул воды (14,49 %, рис. 2).
Дальнейшее повышение температуры (экзотермические эффекты при 349,6 и 362 °С) приводят к отщеплению оставшихся молекул никотинамида и горению продуктов распада. Общая убыль массы при этом составляет 31,37 % от взятой навески и соответствует двум молекулам никотинамида. Остаточным продуктом разложения комплекса является хлористый гольмий, что было подтверждено количественным анализом, который составляет 36,45 % от взятой навески.
Таблица 4
Данные рентгенофазового анализа соединения НоCI3·3C6H6N2O·6H2O
|
d(Å)экс. |
d(Å)теор. |
Δ |
h |
k |
l |
Сингония |
|
9,783 |
9,781 |
0,001 |
0 1 |
0 1 |
2 0 |
моноклинная a = 13,342 b = 14,332 c = 19,729 β = 114°66′ |
|
7,191 |
7,19 |
0,001 |
0 |
2 |
0 |
|
|
6,6806 |
6,673 |
0,0076 |
0 2 |
0 0 |
3 0 |
|
|
5,5865 |
5,516 |
0,0705 |
1 |
1 |
3 |
|
|
5,1042 |
5,049 |
0,0552 |
2 |
1 |
–2 |
|
|
4,6288 |
4,63 |
0,0012 |
0 |
1 |
4 |
|
|
4,0715 |
4,071 |
0,0005 |
1 |
3 |
–2 |
|
|
3,7948 |
3,725 |
0,0698 |
2 |
1 |
–4 |
|
|
3,5392 |
3,589 |
0,0498 |
1 |
1 |
–5 |
|
|
3,1387 |
3,08 |
0,0587 |
1 |
4 |
3 |
|
|
3,0185 |
3,048 |
0,0295 |
1 |
4 |
–3 |
|
|
2,8658 |
2,876 |
0,0102 |
0 |
5 |
0 |
|
|
2,7424 |
2,794 |
0,0516 |
0 |
0 |
7 |
|
|
2,6684 |
2,669 |
0,0006 |
5 1 |
0 3 |
0 6 |
|
|
2,4154 |
2,399 |
0,0164 |
0 0 |
0 6 |
8 0 |
|
|
2,2313 |
2,224 |
0,0073 |
6 |
0 |
0 |
|
|
2,1921 |
2,19 |
0,0021 |
0 1 |
0 4 |
9 7 |
|
|
2,06408 |
2,054 |
0,01008 |
0 |
7 |
0 |
|
|
1,89605 |
1,907 |
0,01095 |
7 1 |
0 4 |
0 9 |
|
|
1,73191 |
1,728 |
0,00391 |
1 |
5 |
9 |
|
|
1,5986 |
1,598 |
0,0006 |
0 1 |
9 6 |
0 –9 |
|
|
1,5509 |
1,556 |
0,0051 |
1 |
7 |
–8 |
|
|
1,5331 |
1,52 |
0,0131 |
0 2 |
0 7 |
13 –8 |
|
|
1,44904 |
1,447 |
0,00204 |
2 |
7 |
–9 |
|
|
1,43317 |
1,439 |
0,00483 |
0 |
10 |
0 |
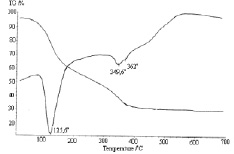
Рис. 2. Дериватограмма соединения HoCl3·3C6H6N2O·6Н2О.
Библиографическая ссылка
Осмонова С.С., Сулайманкулов К.С., Байдинов Т.Б. ГЕТЕРОГЕННЫЕ РАВНОВЕСИЯ В ТРОЙНОЙ СИСТЕМЕ ХЛОРИД ГОЛЬМИЯ – НИКОТИНАМИД – ВОДА ПРИ 30 °С И ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА ТВЕРДЫХ ФАЗ // Успехи современного естествознания. 2016. № 4. С. 43-47;URL: https://natural-sciences.ru/ru/article/view?id=35859 (дата обращения: 07.03.2026).



