В природных условиях выявление особенностей биологического действия радиационного фактора является довольно сложной задачей в связи с модифицирующим влиянием сопутствующих физических и химических факторов, которые в значительной степени могут изменять зависимость «доза ‒ эффект» для организмов, населяющих территории с повышенным радиационным фоном. В таком случае наиболее приемлемым является проведение модельных экспериментов на лабораторных животных, позволяющих строго стандартизировать условия воздействия, соблюдение которых необходимо для оценки генетических последствий как у непосредственно облученных животных, так и у их потомства. Перспективным для изучения биологических эффектов длительного воздействия ионизирующего излучения (ИИ) в малых дозах нам представляется исследование ответной реакции щитовидной железы (ЩЖ), которая состоит преимущественно из медленно обновляющихся клеточных популяций. По данным литературы ткани с низкой пролиферативной активностью способны на протяжении длительного времени сохранять и накапливать структурные изменения ДНК, связанные с влиянием различных повреждающих факторов [1, 2].
Существует ряд методов, позволяющих оценить результаты воздействия малых доз ИИ на живые организмы как на клеточном (микроядерный тест), так и на молекулярном (метод «ДНК-комет») уровнях. Микроядерный тест, основанный на подсчете интерфазных клеток с микроядрами (МЯ), широко распространен для оценки мутагенного действия радиационного загрязнения среды и в экспериментах по выявлению радиационно-индуцированных эффектов в разных дозах. С появлением метода «ДНК-комет» стало возможным исследовать повреждения ДНК в индивидуальных клетках, определяя их количественно, и выявлять, таким образом разнородность ответа клеток на генотоксическое воздействие [5]. Есть мнение, что по чувствительности этот метод сопоставим с традиционными цитогенетическими тестами, а в случаях, когда низкие дозы сочетаются с большой длительностью воздействия фактора, может даже превосходить их [6].
Цель исследования. Цель работы состояла в оценке стабильности генома фолликулярных клеток ЩЖ у мышей линии Af, облученных в хроническом режиме в малой дозе (0,3 Гр), а также в том, чтобы проследить возможность наследования радиационно-индуцированных изменений у их потомков (F1-F4).
Материалы и методы исследования
Эксперименты с моделированием ситуации хронического γ-излучения проводили на половозрелых мышах линии Af (F0). Источником γ-излучения служили две ампулы, содержащие 0,474·106 и 0,451·106 кБк 226Ra, разнесенные на расстояние 2,5 м. Животные находились под воздействием ИИ в течение 84 суток при мощности экспозиционной дозы 150 мкГр/ч, суммарная поглощенная доза за этот период составила 0,3 Гр (опытная группа). Дозовая нагрузка на организм опытных животных определялась мощностью экспозиционной дозы (радиометр ДРГЗ-01Т1) и сроками их содержания в условиях воздействия ИИ. Суммарную поглощенную дозу облучения рассчитывали по показаниям термолюминесцентных дозиметров (ДТУ-01) с детекторами ДТГ-4 (LiF) на дозиметрической термолюминесцентной установке ДВГ-02ТМ (НПП «Доза», Россия). Через четыре месяца после прекращения облучения мышей (F0) (8–9 мес., масса тела 24–28 г) декапитировали с последующим взятием материала для молекулярного и цитогенетического анализов ЩЖ. Для получения потомства первого-четвертого поколений (F1-F4) облученных самцов спаривали с облученными самками (один самец на одну/две самки), при этом учитывали их родословную, подбирая неродственных животных. Мыши контрольных групп были посажены на размножение одновременно с соответствующими группами опытных животных в идентичные условия. Для выявления возможности наследования радиационно-индуцированных изменений полученных самцов-потомков (F1-F4) (3 мес., масса тела 20–27 г) декапитировали с последующим взятием материала для исследования генома клеток ЩЖ. На животных F4 был проведен дополнительный эксперимент с радиационной (острое гамма-облучение) и нерадиационной (уретан (этилкарбамат)), Sigma-Aldrich, USA) нагрузками. Потомков мышей случайным образом делили на три группы, в каждую входили потомки как опытной, так и контрольной групп животных. Первая группа состояла из мышей, которых не подвергали воздействию факторов («без воздействия»), вторую группу животных подвергали острому облучению в дозе 4 Гр на установке «Исследователь» при мощности дозы 0,75 Гр/мин («облучение 4 Гр») и третьей группе животных («уретан») внутрибрюшинно вводили 10 % раствор уретана в количестве 1 мг/г массы тела (контрольная группа мышей аналогичным образом получала эквивалентное массе тела количество 0,9 % раствора NaCl). Уретан является одним из широко исследованных канцерогенов-промоторов, который проявляет свою эффективность в трансгенерационных канцерогенных исследованиях [7, 9]. Животных выводили из эксперимента через 48 часов после воздействий. Исследования проводили в соответствии с «Правилами проведения работ с использованием экспериментальных животных» (Приложение к приказу Министерства здравоохранения СССР от 12.08.77, № 755).
Суспензию клеток ЩЖ получали с помощью ферментативной диссоциации путем обработки ткани в 0,25 % растворе коллагеназы (Collagenase type IА, Sigma, USA), время инкубации составляло 40–60 мин. Для проведения микроядерного теста в полученные суспензии клеток добавляли гипотонический раствор (0,56 % КCl, 20 мин, 37 °С) с последующей фиксацией охлажденной смесью метанола и ледяной уксусной кислоты (3:1), после чего суспензию клеток раскапывали на холодные предметные стекла. Для изучения степени фрагментации ДНК использовали нейтральную версию рН метода ДНК-комет, которая ориентирована преимущественно на анализ двунитевых разрывов ДНК (ДР ДНК) [10]. Суспензии клеток смешивали с 1 % раствором легкоплавкой агарозы (тип IV, Sigma, USA) и наносили на предварительно покрытые 1 % нормоплавкой агарозой предметные стекла. Лизис клеток осуществляли в холодном (4 °C) лизирующем буфере (2,5 M NaCl, 100 мM Na2EDTA, 20 мM Tris-HCl, pH 10, 1 % Triton X-100 и 10 % DMSO) в течение 24 ч. Далее слайды переносили на 20 мин в трис-боратный буфер (рН 8,2, при 4 °C) с последующим проведением электрофореза в этом же буфере при напряжении 1 В/см при 4 °C в течение 20 мин. Для фиксации слайдов использовали 70°этанол (10 мин). Генетический материал для микроядерного теста и метода ДНК-комет окрашивали акридиновым оранжевым («Sigma», USA; 2 мкг/мл в фосфатно-солевом буфере, рН 7.4). Число клеток с МЯ подсчитывали на 1 тыс. клеток под флуоресцентным микроскопом «Axioscop» (Carl Zeiss, Jena). «ДНК-кометы» визуализировали с помощью видеосистемы на основе цифровой камеры «AxioCam» при флуоресцентном режиме, длина волны возбуждающего света составляла 450–490 нм (запирающий фильтр 510 нм). Обработку микрофотографий выполняли с помощью программного обеспечения «СоmetScore 1.5» (TriTek Corp., USA), анализировали по 50–100 «комет» на одно животное. Долю повреждений ДНК в клетках оценивали с помощью показателя «Olive tail moment» (ОТМ) по [10], который равен произведению расстояния от центра ядра до центра плотности хвоста «кометы» и процента ДНК в хвосте. Рассчитывали также среднее значение %ТDNA, отражающий процент ДНК в хвосте «кометы» [8] и частоту распределения тироцитов по величине %ТDNA. Вычисляли средние значения частоты клеток с неповрежденной ДНК (практически не имеющие хвоста «кометы») и с высоко фрагментированной ДНК (имеющие более 40 % ДНК в хвосте «кометы») [3]. О достоверности различий судили по величине t-критерия Стьюдента.
Результаты исследования и их обсуждение
Результаты проведенного эксперимента показали, что через четыре месяца после хронического воздействия ИИ в дозе 0,3 Гр на мышей линии Af (F0) частота клеток с МЯ в ЩЖ была в пределах значений, характерных для контрольных животных (табл. 1).
Таблица 1
Молекулярные и цитогенетические показатели клеток ЩЖ мышей линии Af после хронического облучения в дозе 0,3 Гр и их необлученных потомков
|
Поколение |
Группа животных (число животных) |
МЯ, ‰ |
ОТМ, усл. ед. |
%ТDNA |
Клетки с неповрежденной ДНК, % |
Клетки с высокофрагментированной ДНК, % |
|
F0 |
контрольная (11) |
8,0 ± 0,2 |
22,1 ± 1,8 |
31,7 ± 1,0 |
18,59 ± 1,1 |
33,3 ± 1,3 |
|
опытная (6) |
9,0 ± 0,2 |
13,5 ± 1,8* |
30,4 ± 1,0 |
16,79 ± 2,0 |
21,3 ± 2,2* |
|
|
F1 |
контрольная (5) |
5,5 ± 0,1 |
9,2 ± 1,4 |
15,8 ± 0,8 |
42,6 ± 2,9 |
5,2 ± 1,3 |
|
опытная (7) |
6,8 ± 0,9 |
9,0 ± 1,0 |
15,7 ± 0,7 |
46,6 ± 2,1 |
4,8 ± 0,9 |
|
|
F2 |
контрольная (5) |
3,8 ± 0,7 |
7,9 ± 1,1 |
14,2 ± 0,6 |
44,9 ± 2,9 |
2,7 ± 0,9 |
|
опытная (6) |
4,7 ± 1,2 |
4,5 ± 0,3* |
10,7 ± 0,4* |
58,9 ± 2,5* |
0,5 ± 0,4* |
|
|
F3 |
контрольная (7) |
4,1 ± 0,7 |
5,1 ± 0,9 |
12,3 ± 0,4 |
53,1 ± 2,1 |
1,5 ± 0,5 |
|
опытная (7) |
5,5 ± 0,8 |
3,6 ± 0,4 |
11,4 ± 0,5 |
66,0 ± 2,1* |
1,2 ± 0,5 |
|
|
F4 |
контрольная (10) |
4,1 ± 0,7 |
6,3 ± 0,2 |
13,9 ± 0,4 |
53,0 ± 1,9 |
3,5 ± 0,7 |
|
опытная (10) |
4,6 ± 0,6 |
5,4 ± 0,6 |
13,1 ± 0,4 |
55,4 ± 2,1 |
4,4 ± 0,9 |
Примечание. Здесь и далее *р ≤ 0,05 по сравнению с соответствующей контрольной группой.
При сравнительном изучении потомков (F1-F4), полученных от облученных и необлученных животных, различий по частоте встречаемости микронуклеированных тироцитов также не обнаружено. Статистически значимые изменения после воздействия ИИ на мышей были выявлены на молекулярном уровне, которые проявлялись в понижении доли ДР ДНК в клетках ЩЖ (по показателю ОТМ).
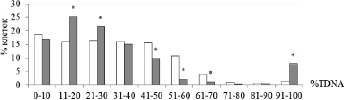
Рис. 1. Гистограмма распределения тироцитов по величине % ТDNA у мышей линии Af после хронического гамма-облучения в дозе 0,3 Гр. Примечание. Светлые столбики – контрольные животные (контрольная группа), темные столбики – облученные животные (опытная группа)
На рис. 1 продемонстрировано повышение количества тироцитов у животных после радиационного воздействия в диапазонах 11–20 и 21–30 %ТDNA и снижение доли клеток с высоко фрагментированной ДНК (диапазон – более 40 %ТDNA по сравнению с необлученными животными. Кроме того, следует отметить возрастание доли клеток элиминирующих по пути апоптоза у облученных животных над спонтанным уровнем (диапазон 90–100 %ТDNA). Это повлияло на понижение среднего значения частоты встречаемости тироцитов с высоко фрагментированной ДНК у животных после действия ИИ. Малые дозы облучения могли явиться адаптирующим фактором и вызвать снижение индукции разрывов нитей ДНК в клетках ЩЖ по сравнению с нормой путем активации процессов репарации, а с другой стороны, повышенная элиминация клеток с запрограммированной гибелью способствовала удалению из клеточной популяции клеток с поврежденным геномом.
Чтобы определить значимость для потомства изменений, обнаруженных на молекулярном уровне в геноме клеток ЩЖ у облученных мышей, были продолжены исследования на животных F1-F4-поколений. В результате изучения степени фрагментации ДНК в тироцитах потомков облученных животных выявлены статистически значимые различия с контролем в F2-поколении; у мышей опытной группы частота встречаемости клеток с ДР ДНК была ниже спонтанного уровня (ОТМ в 1,8 раза; %TDNA в 1,3 раза), как и у непосредственно облученных особей (ОТМ в 1,6 раза). В других поколениях, полученных от облученных животных – F1, F3 и F4 средние значения %TDNA, ОТМ, количества клеток с неповрежденной (кроме F3) и высоко фрагментированной ДНК в клетках ЩЖ практически не отличались от контроля. На рис. 2 показано сходство частоты распределения ДНК в хвосте «кометы» в клетках ЩЖ у потомков F1 и F4 облученных и контрольных мышей, тогда как у потомков F2 и F3 облученных животных проявлялось статистически значимое повышение относительно нормы доли клеток с неповрежденной ДНК (в обоих поколениях на 14 % в диапазоне 0–10 %ТDNA).
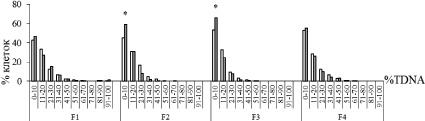
Рис. 2. Гистограмма распределения тироцитов по величине %ТDNA у потомков (F1-F4) мышей линии Af, облученных в дозе 0,3 Гр. Примечание. Светлые столбики – потомки животных контрольной группы, темные столбики – потомки животных опытной группы
Выявление резервных возможностей исследуемого органа, проведенное на F4-поколении животных с помощью острого облучения (4 Гр) позволило обнаружить различия в ответной реакции ЩЖ у потомков опытной и контрольной групп (табл. 2).
Таблица 2
Молекулярные и цитогенетические показатели клеток ЩЖ у F4-потомков опытной и контрольной групп мышей линии Af через 48 часов после острого облучения (доза 4 Гр) или воздействия уретаном (1 мг/г)
|
Потомки F4 |
Вариант эксперимента (число животных) |
МЯ, ‰ |
ОТМ, усл. ед. |
%ТDNA |
Клетки с неповрежденной ДНК, % |
Клетки с высокофрагментированной ДНК, % |
|
Контрольная группа |
без воздействия (10) |
4,1 ± 0,7 |
6,3 ± 0,2 |
13,9 ± 0,4 |
53,0 ± 1,9 |
3,5 ± 0,7 |
|
облучение (6) |
4,0 ± 0,8 |
5,8 ± 0,3 |
11,8 ± 0,7* |
64,1 ± 2,3* |
3,2 ± 0,8 |
|
|
уретан (10) |
4,6 ± 0,7 |
4,6 ± 0,3* |
9,1 ± 0,5* |
73,7 ± 2,1* |
1,5 ± 0,6* |
|
|
Опытная группа |
без воздействия (10) |
4,6 ± 0,6 |
5,4 ± 0,6 |
13,1 ± 0,4 |
55,4 ± 2,1 |
4,4 ± 0,9 |
|
облучение (6) |
4,5 ± 0,8 |
7,2 ± 0,4* |
15,3 ± 0,8* |
56,9 ± 2,5 |
8,9 ± 1,5* |
|
|
уретан (10) |
5,6 ± 0,7 |
4,8 ± 0,5 |
10,4 ± 0,3* |
65,5 ± 1,7* |
1,1 ± 0,4* |
Примечание. *р ≤ 0,05 по сравнению с группой «без воздействия».
У потомков облученных мышей после воздействия ИИ в острой дозе повышалась индукция ДР ДНК в тироцитах. Об этом свидетельствует увеличение интегрального показателя ОТМ и среднего значения %TDNA, происходившие за счет роста количества клеток с высоко фрагментированной ДНК (в 2 раза; р ≤ 0,05). У потомков контрольных животных ответная реакция была противоположной – после острого облучения статистически значимо повышалось среднее значение числа клеток в ЩЖ с неповрежденной ДНК, что отразилось на %ТDNA. После воздействия уретана обнаружено понижение доли тироцитов с ДР ДНК у потомков как контрольных, так и облученных животных (р ≤ 0,05). Снижение степени фрагментации ДНК может быть связано с активацией репарационных процессов, возникающей в ответ на повреждающее действие факторов. Следует отметить, что в условиях проведенного эксперимента была выявлена следующая особенность – низкое относительно нормы количество ДР ДНК у животных, которых впервые подвергали действию облучения или уретана, их предки тоже не испытывали подобного воздействия. Различий в числе клеток с МЯ в ЩЖ потомков облученных и необлученных животных через 48 часов после действия обоих факторов не обнаружено. Это связано с тем, что для формирования МЯ в клетках ЩЖ, органе с низкой пролиферативной активностью необходим длительный промежуток времени после действия факторов или/и влияние самих факторов должно быть более продолжительным. Об этом свидетельствуют исследования, проведенные нами ранее [4].
Заключение
Результаты изучения радиационно-индуцированных эффектов в модельных экспериментах на мышах линии Af и сопоставление их с данными о наследуемости таких изменений позволили сделать заключение о биологической эффективности хронического воздействия ИИ в дозе 0,3 Гр. Примененные нами тесты с химической (уретан) и радиационной (острое облучение) нагрузками показали, что на молекулярном уровне реактивность ЩЖ потомков (F4) животных контрольной и опытной групп в ответ на радиационное воздействие различается, тогда как при уретановой интоксикации прослеживается сходство в ответной реакции клеток ЩЖ у животных обеих групп (понижение доли ДР ДНК). Выявленное после острого облучения изменение индукции тироцитов с ДР ДНК косвенно может свидетельствовать о различиях в скорости развития репарационных процессов в геноме клеток потомков облученных и необлученных животных. Результаты, полученные на потомках, в целом могут свидетельствовать в пользу наследования радиационно-индуцированной нестабильности генома.
Библиографическая ссылка
Раскоша О.В. ОЦЕНКА СТАБИЛЬНОСТИ ГЕНОМА В КЛЕТКАХ ЩИТОВИДНОЙ ЖЕЛЕЗЫ МЫШЕЙ ПОСЛЕ ХРОНИЧЕСКОГО ВОЗДЕЙСТВИЯ ИОНИЗИРУЮЩЕГО ИЗЛУЧЕНИЯ В МАЛОЙ ДОЗЕ И ИХ ПОТОМКОВ // Успехи современного естествознания. 2016. № 4. С. 48-52;URL: https://natural-sciences.ru/ru/article/view?id=35860 (дата обращения: 01.03.2026).



