Танниды – дубильные материалы растительного происхождения, широко используются при выделке шкур. В России для промышленного получения дубильных экстрактов используются кора и древесина дуба, кора ели, ивы, лиственницы, корни бадана, тарана и некоторых других растений. Однако с развитием и совершенствованием технологий глубокой переработки растительного сырья появляется возможность получения дубильных экстрактов из нетрадиционных и/или низкосортных видов сырья. Замена природы растворителя в процессе экстракции приводит к увеличению селективного выхода веществ из растительного сырья и, как следствие, к изменению химических свойств получаемых экстрактов.
В Бурятии в процессе лесозаготовительных работ, при окорке древесины образуется большое количество отходов, главным образом сосны, преобладающей в видовом соотношении в лесах республики. Образующиеся отходы могут быть интересны как альтернативное сырье для производства таннидов.
Целью исследования явилось изучение дубящей способности экстрактов коры сосны, полученных различными способами.
Объектами исследования были сосновые экстракты, полученные методом традиционной водной экстракции, а также водно-спиртовые и водно-щелочные [8, 3].
Исследование дубящих свойств, полученных из коры сосны экстрактов, проводили на продуктах растворения коллагена (ПРК), моделирующих поведение кожевой ткани в процессе дубления методами потенциометрического титрования и спектроскопии [2].
Методом потенциометрического титрования нативных ПРК и ПРК, обработанных экстрактами, можно определить характер взаимодействия экстрактов с белком [1]. Изменение соотношения количества функциональных групп, содержащихся в дубленых и недубленых белковых соединениях, позволяет определить характер преимущественного взаимодействия экстрактивных веществ с ПРК (табл. 1).
Таблица 1
Количество функциональных групп, содержащихся в дубленых и недублёных белках
|
Объект исследования |
рН = 1,5–6 боковые карбоксильные группы, ммоль/г |
рН = 6–8,5 α – аминогрупы, ммоль/г |
рН = 8,5–12 ε – амино- и гидроксильные группы, ммоль/г |
Содержание амидного азота |
|
ПРК |
62,691 |
0,982 |
58,451 |
61,709 |
|
ПРК, обработанный водным экстрактом сосны |
47,311 |
5,943 |
19,062 |
36,492 |
|
ПРК, обработанный водно-спиртовым экстрактом сосны |
36,492 |
0 |
60,743 |
36,492 |
|
ПРК, обработанный водно-щелочным экстрактом сосны |
47,379 |
0 |
63,154 |
47,379 |
Значительное уменьшение количества свободных функциональных групп у дубленых ПРК, по сравнению с нативными продуктами, свидетельствует об их взаимодействии с экстрактами сосны.
Химический состав полученных экстрактов в значительной степени влияет на характер взаимодействия и степень преимущественного связывания их с функциональными группами белка. При этом происходит переориентация активных центров ПРК, в результате чего часть функциональных групп высвобождается из-за разрушения межмолекулярных, водородных и координационных связей белковой спирали. Связывание водного экстракта сосны происходит преимущественно с карбоксильными группами (СОО–), ε-аминогруппами и амидным азотом белка, свободными остаются концевые α-аминогруппы. Танниды водно-спиртового экстракта связываются с группами амидного азота, α-аминогруппами и карбоксильными группами. Связывание таннидов водно-щелочного экстракта происходит преимущественно с карбоксильными (СОО–) и α-аминогруппами белка, а также с амидным азотом, при этом в значительной степени высвобождаются ε-аминогруппы.
Как видно из табл. 1, наибольшую химическую активность к продуктам растворенного коллагена проявляет водный экстракт сосны, на это указывает общее снижение количества функциональных групп у дубленых ПРК по отношению к нативным ПРК на 1 г белка: со ~185,833 ммоль/г до ~108,808 ммоль/г. Меньшая активность наблюдается у водно-спиртового экстракта сосны, который снизил общее количество функциональных групп у дубленого ПРК до ~133,727 ммоль/г. Водно-щелочной экстракт сохранил в дубленом ПРК до ~157,912 ммоль/г функциональных групп. Однако, если оценивать эффективность взаимодействия экстрактов сосны по общему количеству образовавшихся связей с концевыми карбоксильными и α-аминогруппами белка, отвечающими, по мнению А.Н. Михайлова [5]. за превращение шкуры животного в кожу, то, как видно из таблицы, наибольшую активность проявляет экстракт, полученный спиртовой экстракцией, немного уступает ему водно-щелочной экстракт сосны, в то время как традиционный водный экстракт является аутсайдером данной тройки. Взаимодействие же с другими функциональными группами большого влияния на процесс дубления коллагена не оказывает, так как в структуре дермы они прочно фиксированы внутри трехспиральной спирали межмолекулярными связями, и для экстрактивных веществ, проникающих через плотную структуру дермы, остаются недоступными.
Природу взаимодействия дубителей с белковым гидролизатом изучали методом ИК-спектроскопии [8].
ИК-спектроскопический анализ образцов был проведен в лаборатории молекулярной спектроскопии ЦКП «Прогресс» ФГБОУ ВПО ВСГУТУ на приборе ИК-Фурье спектрометр Nicolet-380, приставка Smart Multi-Bounce Hatr.
Известно, что сдвиг полосы пропускания происходит в результате сопряжения электронно-донорного эффекта соседнего заместителя, ван-дер-ваальсовских сил, водородных связей. Мерой концентрации вещества служит интенсивность линий ИК-спектров. Образование водородных связей сопровождается понижением частоты и повышением интенсивности колебания –ХН-группы. Ослабление связи может быть вызвано поляризацией другими полярными группами. Это приводит к уменьшению частоты и увеличению интенсивности поглощения, т.е. уменьшению пропускания [4, 6].
Каждой химической группе соответствуют определенные частоты колебания, а следовательно, и полосы пропускания в ИК-спектре. Различают интенсивность в максимуме поглощения и интегральную интенсивность (площадь под кривой поглощения) (рис. 1).
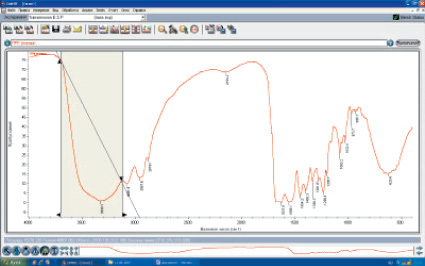
Рис. 1. Определение интегральной интенсивности
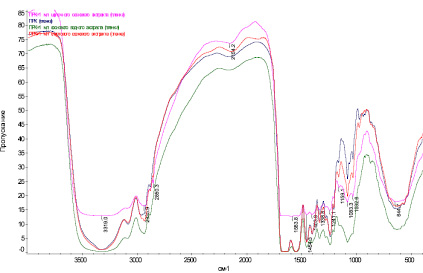
Рис. 2. ИК спектры белкового гидролизата и белкового гидролизата, обработанного экстрактами сосны
Интегральная интенсивность характеризует молекулярные процессы. Наиболее интенсивными в спектре являются пики, отвечающие валентным колебаниям функциональных групп.
ИК спектры нативных ПРК и ПРК, обработанных сосновыми экстрактами, извлеченными из растительного сырья растворителями различной химической природы, характеризуются интенсивными полосами в области валентных колебаний функциональных групп 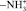 , –ОН, межмолекулярные водородные, –С–Н, –СН2, наблюдается увеличение интегральной интенсивности при обработке ПРК дубителями, а группы –С–Н, –СН3 при взаимодействии ПРК с экстрактами практически исчезают (рис. 2).
, –ОН, межмолекулярные водородные, –С–Н, –СН2, наблюдается увеличение интегральной интенсивности при обработке ПРК дубителями, а группы –С–Н, –СН3 при взаимодействии ПРК с экстрактами практически исчезают (рис. 2).
В области деформационных колебаний функциональных групп (–СО, полоса амид-1, –NH2, полоса амид-2, – – аминокислотная полоса-1,
– аминокислотная полоса-1, 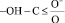 ) происходит уменьшение интегральной интенсивности. Полученные данные свидетельствуют о том, что происходит увеличение молекулы ПРК за счет связывания дубителем –NH2, –ОН, –С = О групп белка.
) происходит уменьшение интегральной интенсивности. Полученные данные свидетельствуют о том, что происходит увеличение молекулы ПРК за счет связывания дубителем –NH2, –ОН, –С = О групп белка.
Увеличение интенсивности полос колебания в области 1350–900 см–1 происходит, по-видимому, вследствие разрыва связей между спиралями белка под действием экстрактов дубителя.
Таблица 2
Интегральная интенсивность поглощения функциональных групп ПРК и ПРК, обработанных сосновыми экстрактами
|
Область поглощения |
Колебания функциональных групп |
ПРК |
ПРК, обработанный водным экстрактом сосны |
ПРК, обработанныйспиртовым экстрактом сосны |
ПРК, обработанный водно-щелочным экстрактом сосны |
|
Интегральная интенсивность поглощения |
|||||
|
Валентные колебания |
|||||
|
3669–3000 |
– Колебания – Колебания ОН межмолекулярные водородные связи |
15278,23 |
15134,396 |
15902,854 |
15071,013 |
|
3019–2883 |
Колебания С–Н СН3 |
607,58 |
430,729 |
692,102 |
342,998 |
|
Деформационные колебания |
|||||
|
1751–1582 |
– Полоса поглощения СО, Полоса амид-1-третичны емиды – Полоса поглощения амид1 (СО) – другие кислоты – Колебания |
2486,28 |
2460,962 |
2422,457 |
– |
|
1587–1477 |
Колебания NH2, Полоса амид 2 – |
685,509 |
473,615 |
781,786 |
6173,166 |
|
1484–1351 |
– Колебания – (Неплоские) колебания |
246,043 |
94,556 |
204,641 |
60,574 |
|
1351–1290 |
Колебания ОН и С–Н Третичные спирты, фенолы |
184,94 |
67,986 |
143,665 |
38,646 |
|
1290–1207 |
Колебания С = О, – колебания С–О или колебания ОН |
278,761 |
116,692 |
264,041 |
100,678 |
|
1124–930 |
– Внеплоскостные колебания СН–, – Колебания С = О, – (вне плоскостные) колебания ОН |
120,812 |
1018,434 |
281,123 |
152,327 |
|
910–555 |
– Колебания. – О–N = O – Колебания С–Н 1-3-т |
6725,442 |
5413,035 |
6596,510 |
5656,018 |
Уменьшение количества групп и интегральной интенсивности –NH2, –С = О групп и усиление интегральной интенсивности –ОН группы (табл. 1) свидетельствуют о том, что при добавлении экстрактов дубителей к белковому гидролизату происходит взаимодействие –NH2, –ОН и –С = О групп гидролизата с экстрактами. Это взаимодействие, как показало потенциометрическое титрование, сопровождается уменьшением количества свободных функциональных групп в молекуле белка.
Таким образом, проведенные исследования, связанные с определением характера взаимодействия в процессе дубления экстрактов коры сосны, полученных растворителями различной природы, с белковыми веществами, содержащимися в кожевой ткани, свидетельствуют о значительном влиянии способа экстракции на химическую активность таннидов. Спиртовые и щелочные экстракты сосны согласно полученным результатам потенциометрического титрования и ИК-спектроскопии проявляют большую химическую активность с концевыми карбоксильными и α-аминогруппами белка, что позволяет их рассматривать как перспективные дубители.
Данная работа выполнена в рамках госбюджетного задания № 01201462824.
Библиографическая ссылка
Сячинова Н.В., Гончарова Н.В. ВЗАИМОДЕЙСТВИЕ БЕЛКОВОГО ГИДРОЛИЗАТА С ЭКСТРАКТАМИ СОСНЫ // Успехи современного естествознания. 2016. № 4. С. 57-61;URL: https://natural-sciences.ru/ru/article/view?id=35862 (дата обращения: 01.03.2026).




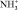 –
–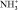 – аминокислотная полоса1
– аминокислотная полоса1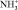
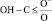 )
)