Разработка и изучение систем контролируемой доставки фармацевтических препаратов на основе биодеградируемых полимерных мембран является одним из наиболее перспективных и быстро развивающихся направлений химической технологии [5].
Одной из возможных областей применения данных систем контролируемой доставки является покрытие медицинских изделий типа «стент», служащих для расширения сузившихся полых органов организма человека. Локальное высвобождение лекарственных агентов из биодеградируемых покрытий способно решить целый ряд возникающих послеоперационных осложнений в месте имплантации стентов: образование повторного сужения-рестеноза, возникновение воспалительной реакции, тромбоза и др. Возникновение данных послеоперационных осложнений ведет к необходимости повторного хирургического вмешательства и замене стента, что ведет к дополнительным рискам для пациента. Поэтому в настоящее время идет активное исследование как материалов основы биодеградируемых покрытий, так и возможных для введения в покрытие лекарственных средств.
Основное преимущество систем контролируемой доставки состоит в возможности длительного и стационарного поддержания необходимого уровня фармацевтического препарата в тканях или биологических жидкостях в течение необходимого для терапии времени. Эффективность систем с контролируемой доставкой фармацевтических препаратов во многом определяется свойствами самих материалов [9]. Они должны быть атравматичными, биосовместимыми, биодеградируемыми, иметь целый ряд необходимых физико-химических и механических свойств. Предполагается, что перспективным материалом для получения систем с контролируемой доставкой фармацевтических препаратов является полилактид.
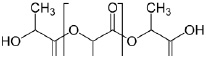
Рис. 1. Химическая формула полилактида
Полилактид алифатический полиэфир, мономером которого является молочная кислота (рис. 1). Сегодня существует 2 способа синтеза полилактида:
1) поликонденсация молочной кислоты;
2) полимеризация лактида.
Зачастую в производстве используется комбинация этих способов. С помощью реакции поликонденсации молочной кислоты можно получить только низкомолекулярный полилактид. Данное ограничение связано с тем, что в процессе поликонденсации выделяется вода, которую сложно отвести из реакции и которая приводит к терминации роста полимерной цепи. Такой низкомолекулярный полилактид в дальнейшем деполимеризуют до димера молочной кислоты, лактида. Полученный лактид полимеризуют при высокой температуре до высокомолекулярного полилактида. Он биоразлагаем, биосовместим и термопластичен. Очевидным плюсом является то, что сырьем для производства полилактида служат возобновляемые ресурсы, а именно силосообразующие сельскохозяйственные культуры. Полилактид уже используется в медицине, для изготовления хирургических нитей и обработки штифтов [3, 7, 8, 10]. Нами создан ряд технологических решений получения биодеградируемых полимерных мембран и покрытий на основе полилактида с нужными механическими свойствами, однако принципиальная возможность создания на их основе систем контролируемой доставки фармацевтических препаратов до сих пор не подтверждена. Цель данной работы заключалась в исследовании кинетики высвобождения фармацевтического препарата линкомицина (антибиотик группы линкозамидов) (рис. 2) из биодеградируемых биополимерных мембран на основе полилактида.
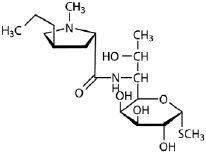
Рис. 2. Химическая формула линкомицина
Принципиальная новизна представленной работы заключается в создании и исследовании различных биодеградируемых полимерных мембран на основе полилактида, обладающих необходимыми механическими свойствами и способных без остатка высвобождать фармацевтический препарат линкомицин во временном интервале от 1 суток до 1 месяца.
Мембраны на основе полилактида получали методом литья раствора полимера с последующим испарением растворителя. Приготовление 3 % растворов полилактида (Nature Work, USA), в 100 % хлороформе (Иреа 2000, Россия) проводили перемешиванием до гомогенного состояния в течение 1 ч при температуре раствора 57 °С. Для депонирования в мембрану лекарственных препаратов в однородный раствор добавляли порошок линкомицин гидрохлорида (Акрихин ХФК, Россия) в массовом соотношении 2 %. Полученный раствор разливали по 6–12 мл в пластиковые формы диаметром 85 мм. После застывания мембраны высушивали при атмосферном давлении и температуре 40 °С. В итоге получаются пластичные мембраны, содержащие линкомицин и имеющие толщину от 200 до 400 мкм. Непосредственно перед экспериментом мембраны помещали в водные растворы для экстракции с разными значениями рН. Изучение кинетики высвобождения линкомицина из мембран на основе полилактида в раствор для экстракции проводили методом дифференциальной спектроскопии в видимой и ультрафиолетовой части спектра. Измерения проводили в кварцевых кюветах с длиной оптического пути 1 см при помощи спектрофотометра Cary 100 (Varian, Австралия) [2, 4]. Суть метода заключается в сравнении спектральных свойств двух растворов, отличающихся по одному признаку. В нашем случае проводили сравнение раствора, образующегося над полилактидной мембраной с антибиотиком, и раствора над полилактидной мембраной без антибиотика. Данный подход позволяет учесть влияние полилактида, который тоже частично растворяется в водных растворах. Контроль рН растворов проводили с помощью прибора Эксперт-001 (Эконикс, Россия) [1]. Для контроля растворения полилактида использовали сравнение раствора, образующегося над полилактидной мембраной, не содержащей антибиотик, и изначального раствора, в котором проходила экстракция веществ из мембран. Для моментальных количественных оценок высвобождения антибиотика из мембран на основе полилактида было необходимо определить коэффициенты молярного поглощения линкомицина, мы приняли его за 8300 л/моль при 192 нм [9].
Исследовано влияние рН на высвобождение линкомицина из биодеградируемых биополимерных мембран на основе полилактида. В большинстве исследованных нами случаев скорость высвобождения антибиотиков из биодеградируемых биополимерных мембран на основе полилактида зависит от значений рН (табл. 1, 2). Хотя есть и свои исключения, например высвобождение линкомицина из фильтра толщиной 400 мкм, созданного на основе полилактида, слабо зависит от рН (табл. 3). В остальных случаях общей является следующая закономерность: чем ниже значение рН, тем быстрее идет высвобождение антибиотика. Так для фильтров толщиной 200 мкм при рН 5,8 и при рН 9,0 динамика выхода линкомицина на начальных участках отличается почти в 2 раза. Для фильтров толщиной 300 мкм при рН 5,8 и при рН 9,0 динамика выхода линкомицина на начальных участках отличается только в 1,5 раза.
Таблица 1
Высвобождение линкомицина из 200 мкм биодеградируемой биополимерной мембраны, созданной на основе полилактида, при разных значениях рН экстрагирующего водного раствора
|
Время, сутки |
Экстракция линкомицина, моль/г сухого фильтра |
|||
|
рН 5,8 |
рН 6,3 |
рН 7,4 |
рН 8,5 |
|
|
1 |
0,0106 ± 0,0006 |
0,0049 ± 0,0004 |
0,0047 ± 0,0005 |
0,0046 ± 0,0004 |
|
2 |
0,0105 ± 0,0006 |
0,0099 ± 0,0006 |
0,0100 ± 0,0005 |
0,0096 ± 0,0007 |
|
3 |
0,0132 ± 0,0008 |
0,0166 ± 0,0010 |
0,0157 ± 0,0009 |
0,0222 ± 0,0013 |
|
5 |
0,0163 ± 0,0011 |
0,0204 ± 0,0012 |
0,0257 ± 0,0016 |
0,0302 ± 0,0019 |
|
7 |
0,0163 ± 0,0010 |
0,0218 ± 0,0013 |
0,0298 ± 0,0019 |
0,0361 ± 0,0023 |
|
10 |
0,0178 ± 0,0011 |
0,0220 ± 0,0014 |
0,0320 ± 0,0019 |
0,0431 ± 0,0027 |
|
13 |
0,0192 ± 0,0012 |
0,0233 ± 0,0014 |
0,0330 ± 0,0020 |
0,0454 ± 0,0023 |
|
15 |
0,0214 ± 0,0014 |
0,0233 ± 0,0015 |
0,0363 ± 0,0021 |
0,0456 ± 0,0030 |
|
30 |
0,0212 ± 0,0013 |
0,0250 ± 0,0016 |
0,0363 ± 0,0028 |
0,0456 ± 0,0027 |
Таблица 2
Высвобождение линкомицина из 300 мкм биодеградируемой биополимерной мембраны, созданной на основе полилактида, при разных значениях рН экстрагирующего водного раствора
|
Время, сутки |
Экстракция линкомицина, моль/г сухого фильтра |
|||
|
рН 5,8 |
рН 6,3 |
рН 7,4 |
рН 8,5 |
|
|
1 |
0,0058 ± 0,0004 |
0,0044 ± 0,0006 |
0,0060 ± 0,0005 |
0,0061 ± 0,0004 |
|
2 |
0,0107 ± 0,0007 |
0,0114 ± 0,0007 |
0,0118 ± 0,0008 |
0,0121 ± 0,0007 |
|
3 |
0,0145 ± 0,0009 |
0,0159 ± 0,0011 |
0,0169 ± 0,0013 |
0,0277 ± 0,0015 |
|
5 |
0,0243 ± 0,0016 |
0,0257 ± 0,0016 |
0,0268 ± 0,0018 |
0,0325 ± 0,0019 |
|
7 |
0,0274 ± 0,0018 |
0,0278 ± 0,0019 |
0,0333 ± 0,0023 |
0,0395 ± 0,0025 |
|
10 |
0,0300 ± 0,0019 |
0,0281 ± 0,0017 |
0,0360 ± 0,0025 |
0,0431 ± 0,0026 |
|
13 |
0,0303 ± 0,0018 |
0,0330 ± 0,0022 |
0,0393 ± 0,0023 |
0,0451 ± 0,0029 |
|
15 |
0,0305 ± 0,0023 |
0,0330 ± 0,0020 |
0,0393 ± 0,0023 |
0,0455 ± 0,0027 |
|
30 |
0,0316 ± 0,0027 |
0,0353 ± 0,0025 |
0,0393 ± 0,0024 |
0,0476 ± 0,0029 |
Таблица 3
Высвобождение линкомицина из 400 мкм биодеградируемой биополимерной мембраны, созданной на основе полилактида, при разных значениях рН экстрагирующего водного раствора
|
Время, сутки |
Экстракция линкомицина, моль/г сухого фильтра |
|||
|
рН 5,8 |
рН 6,3 |
рН 7,4 |
рН 8,5 |
|
|
1 |
0,0029 ± 0,0002 |
0,0035 ± 0,0003 |
0,0032 ± 0,0002 |
0,0037 ± 0,0004 |
|
2 |
0,0059 ± 0,0004 |
0,0064 ± 0,0004 |
0,0061 ± 0,0004 |
0,0066 ± 0,0005 |
|
3 |
0,0140 ± 0,0008 |
0,0154 ± 0,0011 |
0,0146 ± 0,0008 |
0,0158 ± 0,0012 |
|
5 |
0,0339 ± 0,0020 |
0,0403 ± 0,0024 |
0,0365 ± 0,0018 |
0,0357 ± 0,0020 |
|
7 |
0,0973 ± 0,0050 |
0,0974 ± 0,0058 |
0,0975 ± 0,0036 |
0,1003 ± 0,0075 |
|
10 |
0,1009 ± 0,0046 |
0,0988 ± 0,0059 |
0,0970 ± 0,0039 |
0,1038 ± 0,0063 |
|
13 |
0,1013 ± 0,0045 |
0,1009 ± 0,0040 |
0,0982 ± 0,0032 |
0,1038 ± 0,0062 |
|
15 |
0,1013 ± 0,0046 |
0,1027 ± 0,0061 |
0,0982 ± 0,0044 |
0,1045 ± 0,0050 |
|
30 |
0,1020 ± 0,0034 |
0,1027 ± 0,0062 |
0,0990 ± 0,0048 |
0,1047 ± 0,0053 |
Исследовано влияние толщины биодеградируемых биополимерных мембран на основе полилактида на высвобождение из них линкомицина. При кислых рН (< 7,0) на первые и вторые сутки экстракции наблюдается следующая закономерность – чем тоньше мембрана, тем быстрее идет высвобождение. Так при рН 5,8 в первые сутки из 200 мкм мембраны в раствор выходит линкомицина около 0,010 М, из 300 мкм – 0,006 М, из 400 мкм – 0,003 М. При более длительных временах экспонирования данная зависимость инвертируется: к 10 суткам из 200 мкм мембраны в раствор выходит линкомицина около 0,01 М, из 300 мкм – 0,03 М, из 400 мкм – 0,10 М. К 30 суткам данное правило сохраняется, из 200 мкм мембраны в раствор выходит линкомицина около 0,02 М, из 300 мкм – 0,03 М, из 400 мкм – 0,10 М.
В целом кинетика выхода линкомицина из биодеградируемых биополимерных мембран на основе полилактида толщиной 200–300 мкм адекватно описывается экспоненциальным уравнением (Rise to Maximum) типа y = a∙(1 – e–bx). Нужно отметить, что данный тип уравнения при подгонке имеет корреляцию с реальными результатами не менее R2 = 0,96. Например, для формального описания кинетики выхода линкомицина из биодеградируемых биополимерных мембран на основе полилактида толщиной 300 мкм при рН 5,8 параметр а = 0,0321, b = 0,2359, при этом R2 = 0,98. Кинетика выхода линкомицина из биодеградируемых биополимерных мембран на основе полилактида толщиной 400 мкм адекватно описывается двумя уравнениями, последнее из которых является уравнением описывающим максимальное насыщение системы y = const.
Таким образом, в работе показано, что динамика высвобождения фармацевтического препарата линкомицина из биодеградируемых биополимерных мембран на основе полилактида зависит от технологии изготовления мембраны и условий, при которых проводится экстракция. Биодеградируемые биополимерные мембраны, используемые в данном исследовании, по техническим параметрам вполне пригодны для изготовления покрытий стентов и протезов с пролонгированным и контролируемым высвобождением лекарственных препаратов в окружающие ткани [6].
Библиографическая ссылка
Севостьянов М.А., Баикин А.С., Насакина Е.О., Сергиенко К.В., Леонов А.В., Каплан М.А., Конушкин С.В., Хватов А.В., Тертышная Ю.В., Колмаков А.Г. КИНЕТИКА ВЫСВОБОЖДЕНИЯ АНТИБИОТИКА ЛИНКОМИЦИН ИЗ БИОДЕГРАДИРУЕМЫХ БИОПОЛИМЕРНЫХ МЕМБРАН НА ОСНОВЕ ПОЛИЛАКТИДА В ВОДНЫХ РАСТВОРАХ // Успехи современного естествознания. 2016. № 5. С. 43-46;URL: https://natural-sciences.ru/ru/article/view?id=35895 (дата обращения: 25.01.2026).



