Современные медицинские материалы, используемые в практике любого врача, а также среднего медицинского персонала, на сегодняшний день очень разнообразны, поэтому при приобретении того или иного материала необходимо производить четкий анализ всех свойств, ожидаемых от него. К таким свойствам можно отнести устойчивость к действию внешних температур, токсичность, наличие антибактериальных свойств и т.д.
Зачастую современные материалы практически лишены всех нежелательных свойств, но при их использовании имеется вероятность возникновения ряда побочных эффектов у пациентов. До сих пор существует риск инфицирования медицинского материала в условиях стационара. В данном случае речь идет о различных катетерах, интубационных трубках и других материалах, полученных из такого материала, как силикон. Следовательно, многие ученые стремятся минимизировать нежелательные отрицательные свойства, присущие этому материалу.
Имеется предположение, рассматриваемое в статье, что силиконовое масло придает силикону повышенные антибактериальные свойства путем впитывания в силикон части силиконового масла, что препятствует инфицированию катетерного и дренажного материала [6].
Большую опасность представляют такие микроорганизмы, как Pseudomonas aeruginosa, Escherichia coli, Staphylococcus epidermidis [2, 4, 5, 7, 8].
Присутствие данных микроорганизмов на катетерах и дренажах, а также последующая их контаминация в живом организме вызывают ряд бактериальных инфекций.
Хотя предположение о повышении антибактериальных свойств силикона при обработке его силиконовым маслом и является существенным, но оно не позволяет использовать данный обработанный материал в медицинской практике. Для этого необходимо провести ряд тестов, определяющих безопасность его использования [1, 3, 9–11].
Цель исследования – определение токсичных свойств силикона, дополнительно обработанного силиконовым маслом, с использованием LDH-тестирования для определения возможности его использования в медицинской практике.
Материалы и методы исследования
LDH-тест (лактатдегидрогеназный тест) используется для определения токсичности тех или иных материалов, химических соединений, растворов.
В данном случае имелись 2 образца различного вида силикона (кружки цилиндрической формы, диаметром 1 см), используемого в медицинских целях (в качестве интубационных трубок). В качестве первого экспериментального материала использовался Material Silicon Tubes, полученный из Высшей медицинской школы г. Ганновера (Medizinische Hochschule Hannover, MHH, Germany), применяемый для послеоперационного дренажа пациентов. Вторым экспериментальным материалом был стандартный полидимексилсилоксан – PDMS Sylgarol 184. Силиконовое масло – Silicone Oil 317667 – 250 ml.
Для выполнения эксперимента использовались следующие материалы и оборудование:
1. Инкубатор Thermo HERA cell 150.
2. 2 штуки 96 well-plate.
3. 3Т3 клетки (мышиные фибробласты).
4. Чистый медиум (DMEM) – питательная среда для клеток.
5. Тритон Х-100 – неионное поверхностно-активное вещество, перфорирующее клеточную мембрану с последующей гибелью клеток.
6. LDH-субстрат – субстрат, необходимый для колорометрической оценки погибших клеток.
7. Plate Reader – прибор для количественного определения по числовому показателю постоянного LDH (в случае, когда все клетки убиты, следовательно, LDH максимальный) и спонтанного LDH (в случае варьирования количества убитых клеток).
Исследовательская работа выполнялась в 2 этапа.
1 этап. Подготовка обработанных силиконовым маслом образцов силикона.
Сначала были приготовлены чашки Петри с предварительно выращенными 3Т3 клетками (мышиными фибробластами) в растворе чистого медиума (DMEM) в количестве 100 тыс. клеток в 1 мл, инкубированные в течение 1 суток в инкубаторе при температуре 37 °С и газовом соотношении 95 % О2 и 5 % CO2.
Имеющиеся силиконовые кружки помещались в силиконовое масло на 1 сутки. После этого они извлекались из силиконового масла и промокались стерильными салфетками. Затем они помещались на 2 суток в раствор медиума (DMEM) в 1-ую 96 well-plate в 1-й и 2-й ряды соответственно с целью определения отсутствия или же наличия силиконового масла с последующим удалением его остатков с поверхности материала.
В этой же 1-й 96 well-plate в 7-й ряд добавлялось 230 чистого медиума и 50 мкл тритона Х-100.
2 этап. Окончательное приготовление экспериментальных образцов для непосредственного исследования.
Работа проводилась во 2-й новой 96 well-plate.
В 1-й ряд добавлялся клеточный медиум, полученный на первоначальном этапе подготовки материала в размере 50 мкл. Во 2-й ряд добавлялся чистый медиум в объеме 50 мкл. В 3-й ряд добавлялось 50 мкл смеси чистого медиума с тритоном Х-100 из 7 ряда 1-й 96 well-plate. Затем в 4-й и 5-й ряды соответственно добавлялись полученные перемешанные растворы медиума и силиконового масла с двух образцов силиконовых трубок в объеме 50 мкл каждого из 1-й 96 well-plate. 6-й ряд – смесь клеточного медиума с тритоном Х-100 (по 25 мкл каждого). 7-й ряд – чистый, а 8-й – чистый медиум в объеме 200 мкл.
Ко всем первым 6-ти рядам 2-й 96 well-plate в объеме 150 мкл добавлялся LDH-субстрат. После этого производилось погружение well-plate в Plate Reader для считывания информации.
Результаты исследования и их обсуждения
Измерения в Plate Reader производились каждые 15 минут в течение 1 часа. Визуально уже через 5–10 минут наблюдалось изменение окраски в 6-м ряду: желтый цвет изменялся на красный. Это связано со способностью тритона Х-100 перфорировать клеточную мембрану, вызывая гибель клеток, которая визуализируется на рис. 1 в 6-м ряду.
Для более точной верификации результатов был убран «шум», исходящий от чистого медиума, и нормированы результаты, которые были получены из Plate Reader. Для этого выполнено следующее: из средних значений 1-го ряда (контрольной группы), 4-го ряда (1-го экспериментального образца) и 5-го ряда (2-го экспериментального образца) вычиталось среднее значение 2-го ряда (шум, который исходил от чистого медиума). После этого были получены окончательные результаты (табл. 2).
По результатам, полученным с помощью Plate Reader, была составлена диаграмма, на которой графически изображено соотношение токсических свойств двух экспериментальных образцов, погруженных в силиконовое масло (рис. 2).
Числовые значения, представленные в табл. 1 и диаграмме (рис. 2), указывают на то, что токсичность экспериментальных образцов практически в 2 раза ниже токсичности контрольной группы, что в свою очередь является практически невозможным. Следовательно, данный факт позволяет сделать вывод о том, что, скорее всего, силиконовое масло связывает c собой LDH-субстрат, что и приводит к двукратной разнице по сравнению с экспериментальной группой.
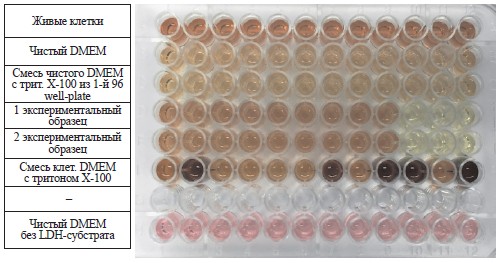
Рис. 1. Графическое изображение 2-й 96 well-plate через 10 минут после добавления LDH-субстрата
Таблица 1
Графическое изображение результатов, полученных с использованием Plate Reader (усредненные значения после 4-х измерений в течение часа с интервалом 15 + минут)
|
Среднее значение |
1 ряд 0,1207 |
2 ряд 0,025517 |
3 ряд 0,027533 |
4 ряд 0,078678 |
5 ряд 0,081122 |
6 ряд 0,747925 |
7 ряд |
8 ряд |
|
1 |
0,1316 |
0,0236 |
0,0269 |
0,0741 |
0,0777 |
0,1736 |
0,0004 |
|
|
2 |
0,12 |
0,0261 |
0,0273 |
0,0775 |
0,0778 |
1,3635 |
0,0004 |
|
|
3 |
0,1164 |
0,0261 |
0,0273 |
0,0842 |
0,0745 |
0,1289 |
0,0001 |
|
|
4 |
0,1294 |
0,0228 |
0,0243 |
0,0712 |
0,0798 |
0,1165 |
0 |
|
|
5 |
0,1113 |
0,0247 |
0,0274 |
0,0819 |
0,0807 |
0,1034 |
0,0009 |
|
|
6 |
0,1285 |
0,0233 |
0,0279 |
0,0727 |
0,0825 |
0,1186 |
-0,0003 |
|
|
7 |
0,1164 |
0,0262 |
0,027 |
0,0758 |
0,0819 |
1,0448 |
0,0002 |
|
|
8 |
0,1179 |
0,0306 |
0,0306 |
0,0835 |
0,0866 |
0,1438 |
0,0005 |
|
|
9 |
0,1228 |
0,0255 |
0,0295 |
0,0872 |
0,0886 |
1,7159 |
0,0005 |
|
|
10 |
0,1122 |
0,0267 |
0,0273 |
2,241 |
0,0007 |
|||
|
11 |
0,1211 |
0,0204 |
0,0265 |
0,1907 |
-0,0002 |
|||
|
12 |
0,1208 |
0,0302 |
0,0284 |
1,6344 |
1E-04 |
Таблица 2
Графическое изображение окончательной обработки полученных результатов из Plate Reader
|
Контр. гр. |
ЭО1 |
ЭО2 |
Мертвые клетки |
|
|
Среднее значение |
0,095183 |
0,053161 |
0,055606 |
0,747925 |
|
1 |
0,106083 |
0,048583 |
0,052183 |
0,1736 |
|
2 |
0,094483 |
0,051983 |
0,052283 |
1,3635 |
|
3 |
0,090883 |
0,058683 |
0,048983 |
0,1289 |
|
4 |
0,103883 |
0,045683 |
0,054283 |
0,1165 |
|
5 |
0,085783 |
0,056383 |
0,055183 |
0,1034 |
|
6 |
0,102983 |
0,047183 |
0,056983 |
0,1186 |
|
7 |
0,090883 |
0,050283 |
0,056383 |
1,0448 |
|
8 |
0,092383 |
0,057983 |
0,061083 |
0,1438 |
|
9 |
0,097283 |
0,061683 |
0,063083 |
1,7159 |
|
10 |
0,086683 |
2,241 |
||
|
11 |
0,095583 |
0,1907 |
||
|
12 |
0,095283 |
1,6344 |
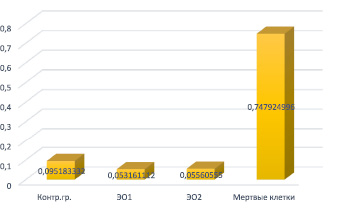
Рис. 2. Графическое изображение определения токсичности исследуемых материалов по сравнению с контрольной группой (клеточный медиум) и группой мертвых клеток (смеси клеточной DMEM с тритоном Х-100)
Использование данных видов силикона, обработанных дополнительно силиконовым маслом, предполагается возможным, несмотря даже на некую специфичность методики для этого эксперимента, описанной выше. Даже в случае отсутствия связывания LDH-субстрата с силиконовым маслом двукратное увеличение концентрации убитых клеток в экспериментальных группах по сравнению с контрольной группой будет также меньше, чем в группе с максимальной летальностью клеток.
Проведение дополнительных исследований в данной области с применением методик, позволяющих оценить как антибактериальные, так и токсические свойства комбинации силиконового масла с различными медицинскими материалами, поможет с более высокой точностью сделать заключение о свойствах экспериментальных образцов.
Выводы
Таким образом, в ходе проведенного исследования установлено, что LDH-тестирование с применением Plate Reader для количественной оценки погибших клеток позволяет с высокой достоверностью выявить токсичность тех или иных медицинских материалов посредством определения количественного соотношения погибших клеток в экспериментальных и контрольных образцах.
Токсичность экспериментальных образцов после их нахождения в силиконовом масле не превышает допустимых значений и существенно ниже группы с максимальной летальностью клеток, поэтому данные виды силикона могут быть использованы в качестве интраоперационного и анестезиологического материала.
Работа выполнена при поддержке Министерства образования и науки РФ в рамках программы «Стипендия Президента РФ для обучения за рубежом». Коллектив авторов выражает благодарность за предоставление научно-технической базы для проведения исследований и получение результатов руководителю отдела нанотехнологии Лазерного центра г. Ганновер д.ф.-м.н., проф. Б.Н. Чичкову.
Библиографическая ссылка
Мельников В.Л., Митрофанова Н.Н., Агейкин А.В., Сурнина М.А. ЦИТОТОКСИЧНОСТЬ ИНТРАОПЕРАЦИОННОГО И АНЕСТЕЗИОЛОГИЧЕСКОГО МАТЕРИАЛА НА ОСНОВЕ СИЛИКОНА, ОБРАБОТАННОГО СИЛИКОНОВЫМ МАСЛОМ // Успехи современного естествознания. 2016. № 6. С. 31-35;URL: https://natural-sciences.ru/ru/article/view?id=35961 (дата обращения: 17.01.2026).



