В последние годы среди специалистов существует мнение, что низкий уровень технологического использования водных ресурсов в значительной мере обусловлен неадекватным пониманием реакции воды на факторы внешнего воздействия [5]. В данной работе принимается, что внешние факторы (температура, постоянное магнитное поле и другие) влияют на воду через водородные связи (Н-связи).
Вопросы стабильного существования Н-связей и локальных ассоциаций молекул Н2О исследованы ещё слабо, хотя их роль в создании структуры и свойств воды может быть значительной.
Выявление и учёт условий стабильного существования Н-связей позволяют регулировать свойства воды и улучшать технологические показатели ee использования.
Результаты исследования и их обсуждение
В модели резонансного взаимодействия (РВ) атомов разных молекул, ответственного за создание Н-связей, внешние факторы влияют на воду через Н-связи [3]. Для создания Н-связи между молекулами должно быть выполнено экранирование влияния валентного электрона атома водорода на его ядро (протон) и сдвиг протона к неподелённой электронной паре соседней молекулы, причём оба действия нужно осуществить во взаимной привязке.
Поэтому для описания процесса формирования Н-связи удобно использовать формулу для знакопеременного переносимого заряда, т.е. формулу
QH = e0 (2α – 1), (1)
где e0 – универсальная единица заряда.
В формуле (1) величина QH обладает свойствами:
 (2)
(2)
При вышеприведённом описании процесса создания Н-связей унитарный параметр α РВ атомов разных молекул, зависящий от факторов внешнего воздействия, может быть представлен в виде
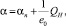 (3)
(3)
где αп – поляризуемость молекулярной основы Н-связи, а величина QH определяется формулами (1) и (2). Рост унитарного параметра α РВ атомов разных молекул сопровождается деформацией замкнутой орбиты валентного электрона, а при α > 1/2 – сдвигом протона.
Так как деформация орбиты происходит с сохранением её замкнутости, то деформация имеет вид растяжения орбиты вдоль главной оси эллипса.
Унитарный параметр α по мере роста влияния внешнего фактора последовательно осуществляет процессы экранирования влияния электронного заряда на протон и последующий его перенос, в котором величина QH играет роль заряда, переносимого при образовании Н-связи. Поэтому Н-связь имеет физически сложную природу и пространственную конфигурацию. Из-за локальности структуры описание Н-связи должно быть локальным. Кроме того, из-за свойства диссипативности вода не может быть описана статическим потенциалом.
В работах [1, 3] показано, что в качестве взаимодействия, ответственного за создание Н-связей, может быть использовано известное в квантовой механике резонансное взаимодействие (РВ) атомов разных молекул [4, 7]. В рамках РВ атомов разных молекул были определены основные характеристики Н-связей и их локальных ассоциаций [2]. Так, избыточная энергия Н-связи определяется равенством
εН = ε0•α(1 – α), (4)
где ε0 – постоянная с размерностью энергии, не зависящая от унитарного параметра α РВ атомов разных молекул. Как видно из определения (4), εН имеет наибольшее значение при α > 1/2, что согласно равенствам (1) и (2) соответствует экранированию электронного заряда и нулевому переносу протонного заряда (начало отсчёта формирования Н-связей).
Обратимся теперь к анализу избыточной энергии Н-связи (формула (4)). Величина εН представляет совокупность энергии РВ атомов разных молекул и энергии их дисперсионного взаимодействия. При интерпретации формирования Н-связи на языке зарядов унитарный параметр α РВ атомов разных молекул следует представить в виде суммы поляризуемости молекулярной основы Н-связи αп и переносимого заряда QH. Поэтому характеристики Н-связи следует представлять с помощью равенств
εН = ε0•α(1 – α);
α = αп + QH. (5)
В формулах (5) энергетический параметр ε0 целесообразно выразить через энергию диссоциации Н-связи, которая по данным [8] равна 58 кДж/моль.
Так как Н-связь распадается на две молекулы, то на одну молекулу приходится 29 кДж/моль, что сравнительно мало. Например, энергия разрыва связи О–Н в молекуле Н2О составляет 490 кДж/моль. Поэтому энергия связи О–Н в молекуле в 7,24 раза больше энергии диссоциации Н-связи. Здесь также целесообразно привести максимальное значение избыточной энергии Н-связи: 14,5 кДж/моль.
Из практики известно, что Н-связь может легко менять свою конфигурацию и зарядовое состояние. К примеру, Н-связь можно деформировать путём изменения температуры в интервале
(23–66) °С. (6)
При таких деформациях Н-связи её зарядовое состояние изменяется в интервале
е0 (0,16–0,6). (7)
Для исследования влияния внешних факторов на воду через водородные связи оказываются важными как условия формирования Н-связей, так и их свойства. Существует ряд условий, при выполнении которых они могут изменить свою структуру. Так, к примеру, давно было замечено, что наибольшей устойчивостью обладают Н-связи с линейной конфигурацией, когда молекула-донор, протон и молекула-акцептор лежат на одной прямой. Из практики известно, что отклонения от линейной конфигурации Н-связи достигают 30° и более [8]. Здесь интересно определить характеристики Н-связей, соответствующие таким 30-градусным отклонениям линии Н-связей от линейной конфигурации.
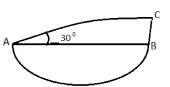
Схема расчёта параметров Н-связи
Относительное отклонение конфигурации Н-связи от линейной в дуговом измерении может быть определено равенством
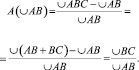 (8)
(8)
Так как искривлённые линии Н-связи обусловливают изменение переносимого при образовании Н-связи заряда, то их удобно описать с помощью формулы (1). Такой заряд Н-связи естественно называть деформационным. Из-за того, что искривление линий Н-связи одновременно является отклонением от линейной конфигурации, должно иметь место равенство
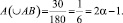 (9)
(9)
Значения параметров Н-связи, соответствующие 30-градусным отклонениям её конфигурации от линейной, можно определить по формулам (1) и (9). Эти значения определяются равенствами
αп = 0,417; QH = 0,166. (10)
Температура как внешний фактор, создающий 30-градусное отклонение конфигурации Н-связи от линейной, может быть найдена из зависимости унитарного параметра α РВ атомов разных молекул от температуры T [1] и составляет
Тпр = 23,208 °С. (11)
С точки зрения практического использования важным свойством воды с локальными ассоциациями молекул является их устойчивость относительно изменения внешних условий и параметров. Ещё на эмпирическом уровне было замечено, что чем больше размеры локальных ассоциаций молекул, тем меньше их устойчивость.
В используемой модели резонансных сил условие устойчивости Н-связей оказывается обеспеченным, если энергия дисперсионного взаимодействия атомов разных молекул превосходит избыточную энергию Н-связи, т.е.
ε0α(1 – α) < ε0α2 или α > 1/2. (12)
Условие устойчивости существования локальных ассоциаций молекул аналогично выполняется при преобладании избыточной энергии Н-связи над энергией взаимодействия деформационных зарядов Н-связей, входящих в состав локальной ассоциации, т.е. при выполнении неравенства
α•(1 –α) > (2α – 1)2. (13)
Естественно, что при выполнении обратного неравенства будет происходить распад локальных ассоциаций на отдельные Н-связи.
Для практики использования динамики Н-связей целесообразно определить граничные значения параметров Н-связей. Граничные значения унитарного параметра РВ атомов разных молекул определяются из равенства α•(1 – α) = (2α – 1)2, т.е. из уравнения
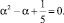 (14)
(14)
Удовлетворительный с точки зрения физики корень этого уравнения определяется величиной αc = 0,72.
Наконец, используя равенство (3), находим значения параметров Н-связей локальных ассоциаций молекул на границе их стабильности:
αп = 0,33; QH = 0,44; Tc = 42,68 °С. (15)
Обратимся теперь к рассмотрению свойств энергоёмкости [1]. Отметим, что энергоёмкость I(T) в отличие от конфигурационной энергии пригодна для описания произвольной локальной ассоциации молекул. Зависимость энергоёмкости от температуры как от внешнего фактора определяется равенством
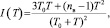 (16)
(16)
где nв – среднее число свободных центров захвата протона молекулами локальной ассоциации. Энергоёмкость имеет непосредственное отношение к высокой внутренней энергии воды. Она позволяет в локальных областях воды создавать ассоциации молекул Н2О различных размеров и формы. Поэтому экстремальные свойства функции I(T) представляют практический интерес. Так, определяя условие экстремальности функции I(T) из равенства (16), находим, что в точке экстремума I(Т) температура определяется величиной
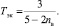 (17)
(17)
Проверка условия экстремума I(T) показывает, что точка экстремума I(T) является также точкой её максимума. Так, например, при среднем заполнении центров захвата, равном 0,5, температура максимума энергоёмкости I(T) составляет 24,9 °С. Анализ зависимости I от nв как от параметра показывает, что энергоёмкость в максимуме тем меньше, чем выше заполнение центров захвата протонов молекулами локальных ассоциаций молекул. Это утверждение является прямым следствием сохранения части энергии образования Н-связи. В этом случае сохранённая в структуре локальной ассоциации молекул энергия пропорциональна величине
Tmax(nв) – Tmax(nв – αп). (18)
При значениях унитарного параметра α, больших αс = 0,72, локальные ассоциации молекул различных размеров, за исключением одиночных Н-связей (димеров), распадаются. Так как рост унитарного параметра α связан с увеличением локального сжатия [3], то его предельное значение, определяемое выражением αнб = 0,8, соответствует температуре Тнб = 66,4 °С. Если принять, что длина отдельной Н-связи уменьшается со сжатием её молекул, то необходимо допустить, что разрыв Н-связи происходит при наименьшей длине. Поэтому можно полагать, что чем больше сближены молекулы Н-связи, тем меньше их поляризуемость αп. Вышеприведённые результаты анализа структуры и свойств получены на основе учёта влияния внешнего фактора на воду через Н-связи.
Действительно, если воздействие внешнего фактора на воду происходит в форме электрических сил, то его влияние должно выразиться поляризуемостью Н-связи. В случае влияния магнитного поля воздействие на воду выражается через магнитную восприимчивость Н-связи [8]. В случае влияния энергетического (теплового) поля на воду через Н-связи воздействие удобно учитывать через зависимость унитарного параметра α от температуры.
Из вышеприведённого анализа динамики Н-связей ясно, что в минерализованной воде Н-связи могут привести к значительным изменениям ресурсности воды. Так, к примеру, появление деформационного заряда у Н-связей может привести к поляризации ионов растворённых веществ. Уменьшение длины и поляризуемости Н-связей может происходить под влиянием эффекта давления, производимого внешним фактором на унитарный параметр α. В этом случае длина Н-связи является её характеристикой, подвергающейся сжатию со стороны внешнего фактора. Одновременное уменьшение длины и поляризуемости и увеличение деформационного заряда Н-связи может создавать благоприятные условия разделения и опреснения минерализованных вод методом обратного осмоса [6].
Подготовка воды с димерным типом ассоциаций и всем набором параметров Н-связей сейчас является разрешимой проблемой. По данным расчёта использование минерализованных вод с димерными ассоциациями молекул при решении задач опреснения и очистки может оказаться эффективным. Для технологических показателей при прохождении потока Н-связей через обратноосмотическую мембрану может оказаться важным соотношение между длиной Н-связи и диаметром пор мембраны. У большинства типов мембран размер пор находится в интервале 3–5 нм. Длины сжатых Н-связей составляют порядка 1 нм. В случае использования минерализованной воды с димерным типом ассоциаций для стабильного её существования необходимо преобладание давления резонансных сил 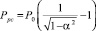 над осмотическим давлением Росм = ΔCRT, т.е. выполнение неравенства
над осмотическим давлением Росм = ΔCRT, т.е. выполнение неравенства
Ррс > Росм. (19)
Оценочная проверка неравенства (19) при фиксированной температуре показывает, что неравенство (19) верно при значениях минерализации до 30–40 г/л.
Выводы
1. Определены локальные параметры водородных связей (Н-связей), через которые оказывают своё влияние внешние факторы. В качестве пояснения можно заметить, что внешние факторы, т.е. электрическое, магнитное поля и другие величины оказывают влияние на поляризуемость, магнитную восприимчивость и др., введенные впервые для Н-связей в нашей работе.
2. Рассчитаны свойства Н-связей и показано, что они имеют сложную природу со слагаемыми различного физического содержания. Известны случаи, когда отклонения от линейной конфигурации достигают 30 градусов. В данной работе определены значения параметров Н-связей, соответствующие 30-градусным отклонениям от линейных, и найдены температуры, вызывающие указанные отклонения (формулы (10) и (11)).
3. Найдены значения температуры ТС и параметров Н-связей (формула (15)), при которых происходит распад локальных ассоциаций молекул на одиночные Н-связи (димеры), обладающие заметно более высокой термостойкостью, чем локальные ассоциации молекул больших размеров.
4. Очень важный вопрос теории Н-связей касается резервирования в образующейся структуре части энергии, выделяемой при образовании Н-связи в виде конфигурационной или резонансной энергии. Из-за возможного взаимодействия Н-связей между собой конфигурационная энергия нами была заменена энергоёмкостью, пригодной для описания ассоциации молекул произвольной формы. Исследование энергоёмкости как функции температуры и числа свободных центров захвата протонов на экстремум показало, что при высоком заполнении центров максимум энергоёмкости достигается при меньшей температуре, чем при низком их заполнении. Этот эффект достаточно наглядно подтверждает вклад энергии образования Н-связей в максимум энергоёмкости локальных ассоциаций молекул. Получается, что вода может поддерживать максимум энергоёмкости путём увеличения числа Н-связей при фиксированной температуре в молекулах их локальных ассоциаций.
5. Выяснено, что поток Н-связей с деформационным зарядом может поляризовать ионы растворённых веществ. В воде с димерным типом ассоциаций возможные одиночные молекулы могут димерно ассоциироваться на основе кооперативной природы процесса образования Н-связей.
6. При использовании воды с димерной ассоциацией молекул из-за значительной сжатости Н-связей и уменьшения их поляризуемости по сравнению с молекулами Н2О следует ожидать значительного повышения производительности обратноосмотической мембраны по фильтрату.
7. В случае использования высокоминерализованных вод для обеспечения стабильности димерных ассоциаций молекул необходимо обеспечить преобладание давления резонансных сил над осмотическим давлением (формула (19)).
Библиографическая ссылка
Алхасов А.Б., Абдуллаев А.А., Рабаданов Г.А. РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ ВОДОРОДНЫХ СВЯЗЕЙ ВОДЫ И ПЕРСПЕКТИВЫ ИХ ИСПОЛЬЗОВАНИЯ В ТЕХНОЛОГИЯХ ОПРЕСНЕНИЯ И ОЧИСТКИ // Успехи современного естествознания. 2016. № 7. С. 9-13;URL: https://natural-sciences.ru/ru/article/view?id=35994 (дата обращения: 07.03.2026).



