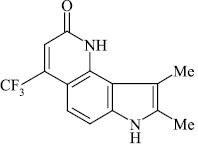
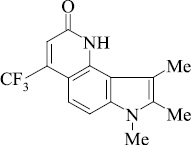
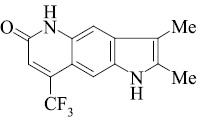
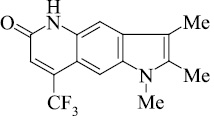
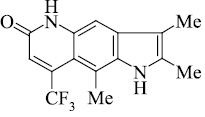
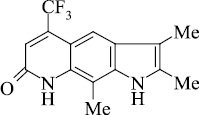
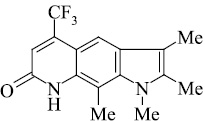
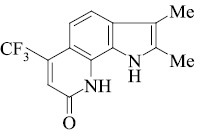
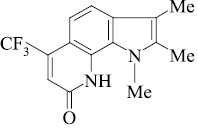
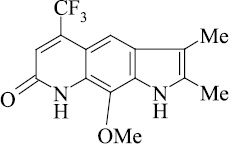
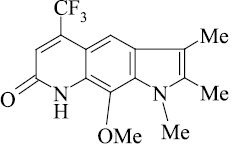
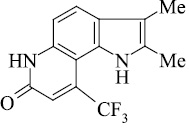
Мы, коллектив авторов, проводим исследование противогрибковой и противомикробной активности трифторметил производных индольного [3] и пирролохинолонового ряда [1, 2] в рамках реализации одного из фундаментальных принципов преодоления антибиотикорезистентности микроорганизмов – поиска новых соединений с противомикробной активностью и, возможно, с иным механизмом действия.
Получены предварительные результаты о противомикробном действии для некоторых трифторметилпирролохинолонов.
Определение чувствительности микроорганизмов к исследуемым препаратам проводили методом серийных разведений в бульоне (макрометодом «пробирочным») и диско-диффузионным методом.
В качестве тест-микроорганизмов использовали 14 музейных штаммов: Staphylococcus aureus 29213, Escherichia coli 25922, Pseudomonas aeruginosa 27853, Streptococcus pyogenes 1238, Salmonella enteritidis 5765 ATСС, Shigella sonnei S-форма 20, Pseudomonas aeruginosa 453, Escherichia coli М17 штамм, Staphylococcus aureus 906, Enterococcus faecalis 2919 АТСС, Citrobacter freundii 101/57, Proteus vulgaris 222, Klebsiella pneumoniaе 9172, Bacillus cereus 96.
Музейные штаммы, используемые в работе, получены из коллекции музея живых культур ФГУН ГИСК им. Л.А. Тарасевича Роспотребнадзора. В качестве опытных исследовались штаммы микроорганизмов Staphylococcus spp., Streptococcus spp., Enterococcus spp., Klebsiella spp., Salmonella spp., S. sonnei, E. coli, Enterobacter spp., Proteus spp., M. morganii, C. freundii, A. baumani, P. aeruginosa, изолированных из материала, взятого от больных ГБУЗ РМ «РИКБ» с неспецифическими заболеваниями органов дыхания и мочевыводящих путей. Источником выделения патогенов служила моча, мокрота, слизь из зева, носа и носоглотки.
Изучение спектра противомикробной активности соединений 8, 10, 16 в отношении тест-штаммов микроорганизмов показало, что они обладают различным спектром активности как относительно грамотрицательных микроорганизмов, так и грамположительных микроорганизмов.
Чувствительность к исследуемому соединению 16 наблюдалась у клинических штаммов грамположительных микроорганизмов S. aureus, S. pyogenes, S. salivarius, S. uberis, S. mitis, S. mutans, S. agalactia, B. cereus и грамотрицательных микроорганизмов E. coli, S. enteritidis, S. typhimurium, S. sonnei, C. freundii, E. cloaceae, E. aerogenes, M. morganii, A. baumani,. Другие исследуемые микроорганизмы E. faecalis, E. faecium, K. oxytoca, K. pneumoniaе, P. vulgaris, P. mirabilis, P. aeruginosa были малочувствительны к исследуемому соединению.
Исследование соединения 10 показали, что данное вещество обладает широким спектром активности. Оно проявляет противомикробный эффект как в отношении грамотрицательных, так и грамположительных микроорганизмов.
Соединение 8 обладает более узким спектром действия как в отношении тест-штаммов, так и клинических штаммов микроорганизмов. Оно проявляло противомикробную активность только в отношении представителей рода Streptococcus spp. и, в частности, было наиболее активно в отношении S. pyogenes.
Таким образом, изученные нами фторпирролохинолоны обладают достаточно широким спектром действия и в отношении тест-штаммов и клинических штаммов микроорганизмов.
На основании, вышеприведенных данных можно предположить, что синтезируемые и исследуемые нами соединения могут являться новой группой противомикробных препаратов и требуют дальнейшего изучения.
В связи с вышеизложенным нами, для точного доказательства структуры исследуемых соединений использован масс-спектрометрический метод. Проведен анализ масс-спектрального распада ранее полученных нами серии различно сочлененных с разными заместителями соединений [4–16].
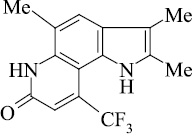
Масс-спектральный распад метилзамещенных трифторметилпирролохинолонов 1-9, как и полиметилированных индолов [2], подчиняется схеме 1. Значения Jотн, приведенные в табл. 1, свидетельствуют о высокой стабильности анализируемых пирролохинолонов.
Введенная по азоту пиридинового кольца метильная группа (соединение 10), по-видимому, способствует элиминированию оксида углерода с образованием пирролоиндола из молекулярного иона пирролохинолона, а также иона пирролохинолона из иона пиридохинолона (схема 2).
Введенная в бензольное кольцо метоксигруппа (соединения 11, 12) дестабилизирует пирролохинолоны к электронному удару. При этом изменяется схема масс-спектрального распада (схема 3).
Определяет при этом направление масс-спектрального распада O–Me группа. Молекулярный ион пирролохинолона 11 элиминирует метильный радикал с последующим отщеплением молекулы оксида углерода с максимальным пиком иона m/z 267. Аналогичная схема распада наблюдается и для пирролохинолона 12. Соединение более устойчиво к действию электронного удара из-за наличия дополнительной метильной группы. Пик молекулярного иона m/z 324 является самым интенсивным.
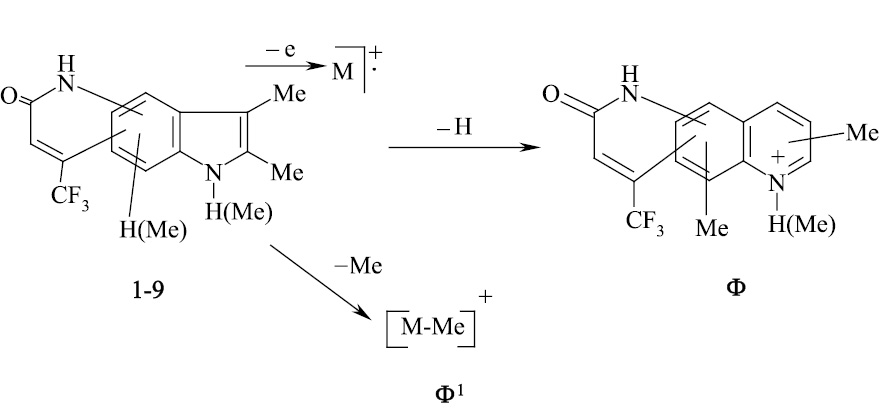
Схема 1
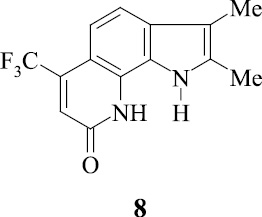
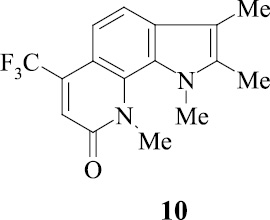
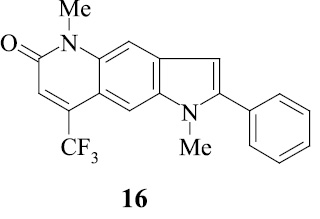 Таблица 1
Таблица 1
Значения Jотн в % для молекулярных и фрагментных ионов Ф, Ф1 в масс-спектрах соединений 1-9
|
№ п/п |
Соединения |
Масс-спектр, m/z (Jотн, %) |
||
|
М |
Ф |
Ф1 |
||
|
1 |
2 |
3 |
4 |
5 |
|
1 |
|
290 (100) |
279 (83) |
265 (37) |
|
2 |
|
294 (100) |
293 (87) |
279 (48) |
|
3 |
|
280 (100) |
279 (73) |
265 (40) |
|
4 |
|
294 (100) |
293 (73) |
279 (38) |
|
5 |
|
294 (100) |
293 (67) |
279 (29) |
|
1 |
2 |
3 |
4 |
5 |
|
6 |
|
294 (100) |
293 (61) |
279 (29) |
|
7 |
|
308 (100) |
307 (45) |
293 (59) |
|
8 |
|
280 (100) |
279 (96) |
265 (34) |
|
9 |
|
294 (100) |
293 (90) |
279 (50) |
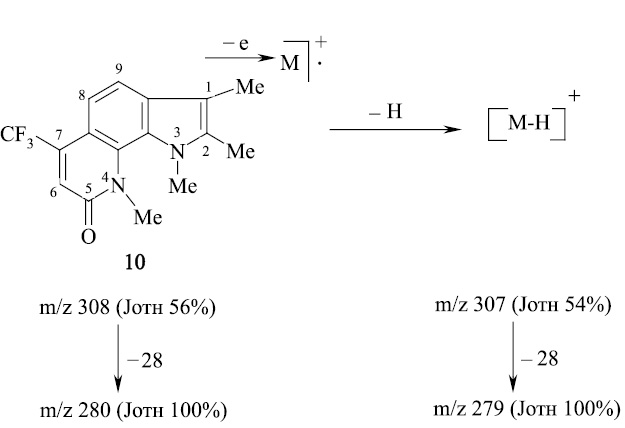
Схема 2
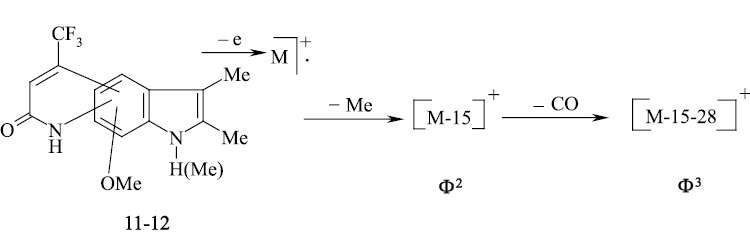
Схема 3
Таблица 2
Значения Jотн в % для молекулярных и фрагментных ионов Ф2, Ф3 в масс-спектрах соединений 11–12
|
№ п/п |
Соединения |
Масс-спектр, m/z (Jотн, %) |
||
|
М |
Ф2 |
Ф3 |
||
|
11 |
|
310 (74) |
295 (35) |
267 (100) |
|
12 |
|
324 (100) |
309 (33) |
291 (79) |
Схема 4
Таблица 3
Значения Jотн в % для молекулярных и фрагментных ионов Ф4–Ф6 в масс-спектрах соединений 13, 14
|
№ п/п |
Соединения |
Масс-спектр, m/z (Jотн, %) |
|||
|
М |
Ф4 |
Ф5 |
Ф6 |
||
|
13 |
|
100 |
23 |
30 |
45 |
|
14 |
|
100 |
10 |
– |
23 |
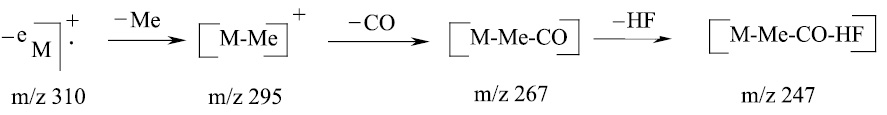
Схема 5
В масс-спектре пирролохинолонов 13, 14 кроме пиков молекулярного иона с максимальной интенсивностью имеются сигналы с m/z [M-20]+ и [M-1-20], обусловленные, по-видимому, элиминированием HF от взаимодействующих пери-заместителей (CF3, N–H) и образованием иона полициклической структуры.
В рассмотренном масс-спектральном распаде пирролохинолона 15 помимо ионов Ф2, Ф3, обусловленных наличием метоксильной группы, имеется сигнал с m/z 247, по-видимому образующийся по следующей схеме (схема 5).
Таким образом, из анализа масс-спектрального распада различно сочлененных трифторпирролохинолонов следует, что они ведут себя как полиметилированные индолы и их метоксипроизводные. В случае наличия метоксильной группы первоначальное направление масс-спектрального распада определяет O–CH3 группа.
При наличии в молекуле пери-расположенной к N–H пиррольного кольца трифторметильной группы под действием электронного удара происходит элиминирование молекулы фтористого водорода с образованием полициклической структуры с узловым атомом азота.
Резко изменяется схема распада трифтор[3,2-h]пирролохинолона 10 с пери-заместителями.
Подробные масс-спектры трифторпирролохинолонов получены на масс-спектрометре FINNIGAN MAT. INCOS-50 с прямым вводом образца в ионный источник при энергии ионизации 70 эВ и приведены в процитированных источниках без анализа.
Все масс-спектрально проанализированные трифторпирролохинолоны исследуются на антимикробную активность.
Библиографическая ссылка
Степаненко И.С., Ямашкин С.А., Котькин А.И. БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ И АНАЛИЗ МАСС-СПЕКТРАЛЬНОГО РАСПАДА ТРИФТОРМЕТИЛПИРРОЛОХИНОЛОНОВ // Успехи современного естествознания. 2016. № 8. С. 55-60;URL: https://natural-sciences.ru/ru/article/view?id=36078 (дата обращения: 05.02.2026).