Необходимость в создании препаратов, обладающих биоцидной активностью, является актуальной задачей современной науки. Учитывая требования, предъявляемые к данному классу соединений, на первый план выдвигается проблема их экологической безопасности. Синтез нового комплексного соединения – диглицинобората меди является продолжением работы по направлению создания комплексных соединений на основе бора. Полученное химическое соединение предлагается использовать в качестве антимикробного и противогрибкового средства, направленное на подавление жизнедеятельности возбудителей инфекционных заболеваний, таких как кишечная палочка, золотистый стафилококк и дрожжеподобные грибки. Предлагаемое нами комплексное соединение должно обладть достаточно выраженной биоцидной активностью и может использоваться в качестве альтернативного антимикробного средства. Особенностью полученного нами химического соединения является простота синтеза препарата и избирательная биоцидная активность при малых концентрациях комплексной соли.
Основными этапами получения нового комплексного соединения являются: синтез диглициноборной кислоты (ДГБК), реакция присоединения катиона меди (II) к ДГБК во внешнюю сферу, формирование и рост кристаллов нового комплексного соединения – диглицинобората меди (II). Методика синтеза диглициноборной кислоты (ДГБК) рассмотрена в [1]. Приведем схему этого процесса (рис. 1).
Второй этап получения соли данной кислоты с ионами меди (II) протекает по схеме (рис. 2). Подробно методика получения соединения описана в [5].
Соль ДГБК с ионами меди (II) представляет собой кристаллы голубого цвета, устойчивые на воздухе и хорошо растворимые в воде. Диглициноборная кислота имеет кристаллы белого цвета, так же устойчивые к воздействию воздушной среды и хорошо растворимые в воде (рис. 3). Для вывода эмпирической формулы полученного соединения диглицинобората меди нами проводился элементный анализ на содержание бора, углерода, водорода, азота, воды и меди. Бор определяли после сожжения вещества в присутствии карбоната натрия алкалиметрическим титрованием с маннитом с потенциометрическим окончанием. Углерод и водород определяли микросожжением, кристаллизационную воду – по методу Фишера, азот – методом Кьельдаля, ионы меди (II) – методом косвенного йодометрического титрования. Для изучения физико-химических свойств соединения использовали ИК-спектроскопический, кондуктометрический, термогравиметрический анализы, а также соединение проходило проверку на определение подавляющей концентрации соединения при воздействии на дрожжеподобные грибы рода Кандида, золотистый стафилококк и кишечную палочку. Подавляющую активность исследовали методом серийных разведений в мясопептонном бульоне. Данные получены в бактериологической лаборатории ГОУ ВО ЧГМА Минздравсоцразвития России.
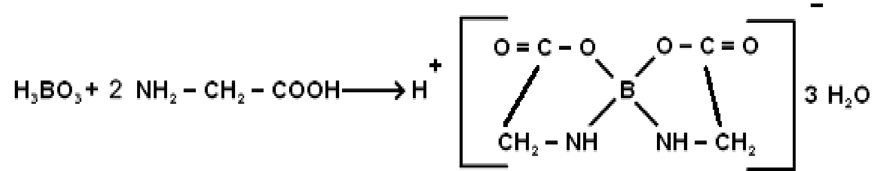
Рис. 1. Схема синтеза диглициноборной кислоты
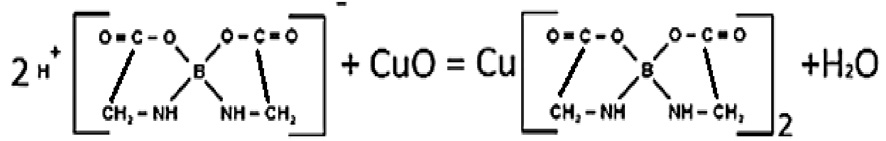
Рис. 2. Схема получения соли ДГБК с ионами меди (II)
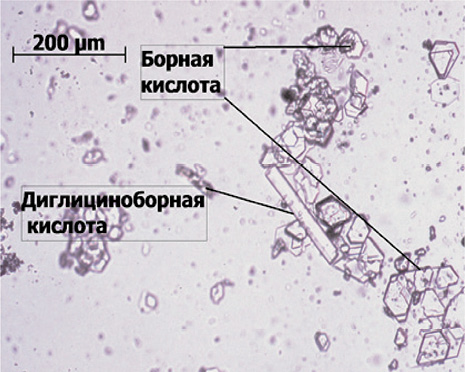

Рис. 3. Кристаллы ДГБК и соли ДГБК с ионами меди (II)
Таблица 1
Наборы индивидуальных пиков диглициноборной кислоты и диглицинобората меди
|
Соединение Группы |
ДГБК |
Соль ДГБК с ионами меди |
|
OH-группа |
3176 см–1 |
3173 см–1 |
|
СО-группа |
1500 см–1 |
1442 см–1 1411 см–1 |
|
B-N-связь |
1033 см–1 1112 см–1 1195 см–1 1132 см–1 |
1195 см–1 1132 см–1 1114 см–1 1033 см–1 |
|
В-О-связь |
800 см–1 910 см–1 |
893 см–1 910 см–1 |
|
Сu2+ |
– |
1610 см–1 |
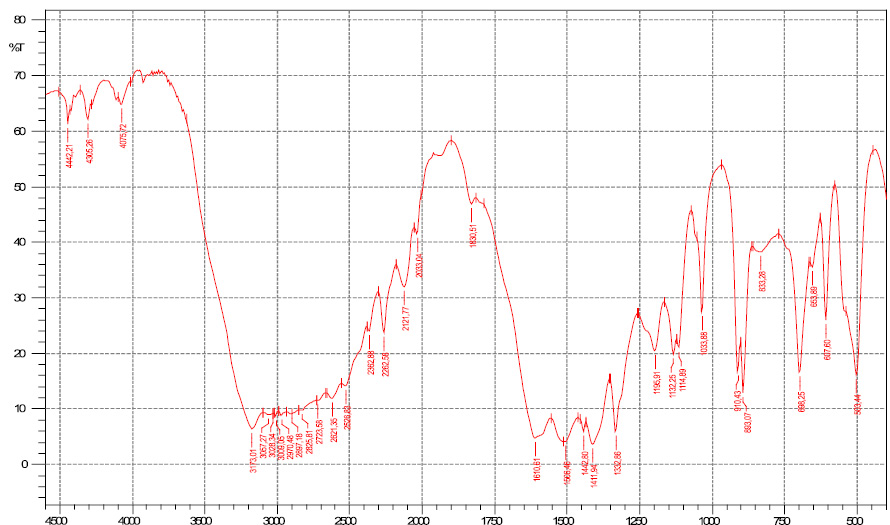
Рис. 4. ИК-спектр диглицинобората меди
Регистрация спектров выполнялась на ИК – Фурье спектрометре FTIR-8400S «Shimadzu» (интервал частот 420–4000 см–1, в таблетках с бромидом калия). Данные представлены в табл. 1, ИК-спектры показаны на рис. 4. Расшифровка спектров проводилась согласно [4].
Электропроводность водных растворов изучали с помощью кондуктометра при рабочей частоте 1 кГц. Для проведения исследования готовили растворы ДГБК и ее соли с концентрациями 0,1000, 0,0500, 0,0250, 0,0125 и 0,0060 моль/л, рассчитали удельную и молярную электрическую проводимость полученных растворов по методике [2], данные приведены в табл. 2.
По полученным данным строим график, показывающий зависимость молярной электропроводности от концентрации веществ [3].
Анализируя полученные данные, можно сделать вывод о том, что диглициноборат меди (II) (ДГБМ) ведет себя в растворе, как и диглициноборная кислота, и имеет свойства слабых электролитов. Интерполяция прямолинейного участка кривой зависимости молярной электропроводности ДГБМ от концентрации на бесконечное разбавление дает значение примерно равное 150 Ом–1·см2·моль–1, что соответствует электропроводности электролита, диссоциирующего с образованием двух ионов: катиона меди (II) и комплексного аниона.
Таблица 2
Молярная и удельная электропроводность ДГБК и ее соли, полученной двумя способами
|
Диглициноборная кислота |
|||||
|
№ п/п |
1 |
2 |
3 |
4 |
5 |
|
C, моль/л |
0,1000 |
0,0500 |
0,0250 |
0,0125 |
0,0060 |
|
R, Ом |
30000 |
41000 |
53000 |
52000 |
52000 |
|
æ, См/см |
0,00163 |
0,00120 |
0,00092 |
0,00094 |
0,00094 |
|
Ʌ, См•см2/моль |
16,3 |
24,0 |
36,8 |
75,2 |
156,7 |
|
Соль ДГБК с ионами меди (II) |
|||||
|
№ п/п |
1 |
2 |
3 |
4 |
5 |
|
C, моль/л |
0,1000 |
0,0500 |
0,0250 |
0,0125 |
0,0060 |
|
R, Ом |
470 |
470 |
440 |
570 |
240 |
|
æ, См/см |
0,0012 |
0,0012 |
0,0013 |
0,0010 |
0,0024 |
|
Ʌ, См•см2/моль |
12,0255 |
24,0511 |
51,3818 |
79,3263 |
392,5000 |
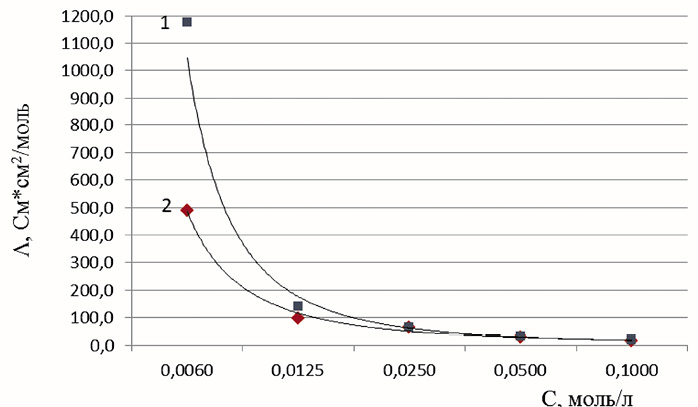
Рис. 5. Зависимость молярной электропроводности раствора диглициноборной кислоты (1) и диглицинобората меди (2) от молярной концентрации
Термогравиметрический анализ исследуемого соединения диглицинобората меди проводили на синхронном термоанализаторе STA 449 F1 Jupiter в лаборатории минералогии и геохимии ландшафта ИПРЭК СО РАН. На рисунке 6 приведены ТГ, ДТГ, ДСК результаты измерения исследуемого соединения в диапазоне температур от 0 до 500 °C в атмосфере аргона. Из графика видно, что синтезируемое соединение устойчиво к температурам до 100 °C. Далее наблюдаются пики в интервале от 100 до 200 °C, что свидетельствует о поэтапном отщеплении кристаллизационной воды, с потерей массы до 21,93 %. Затем при 200–275 °C происходит разложение лиганда, что на кривой ТГ проявляется в виде скачка. На кривой ДСК появляется эндотермический минимум при 244 °C, сопровождаемый потерей массы около 19 %. Выше 275 °C происходит горение оставшейся органической части молекулы, причем вся она улетучивается. На кривой ДСК видны несколько экзотермических пиков, что подтверждает протекание окислительных процессов в интервале 275–500 °C. Остаточная масса после сжигания 49,10 %. Летучие продукты реакции: СО, СО2, H2О [5].
Исследуемое соединение хорошо растворимо в воде и термически устойчиво. Его можно применять как в сухом виде, так и в виде водного раствора. Диглициноборат меди относится к комплексным соединениям бора и предназначен для использования в качестве антимикробных и противогрибковых средств, направленных на подавление жизнедеятельности возбудителей инфекционных заболеваний, таких как кишечная палочка, золотистый стафилококк и дрожжеподобные грибки. Согласно протоколу бактериологического исследования лаборатории ГБОУ ВО ЧГМА Минздравсоцразвития России антимикробную активность и минимальную подавляющую концентрацию диглицинобората меди (II) (ДГБМ) изучали в отношении Escherichia coli (кишечной палочки), Staphylococcus aureus (золотистый стафилококк) и Candida albicans (дрожжеподобные грибы рода Кандида). Полученные данные сравнивались с ранее исследованными комплексными соединениями: ДЦБГ – дицитратоборат гуанидиния; ДЦБО – дицитратоборат оксихинолиния. Результаты исследования показаны в табл. 3.
Анализируя полученные результаты, можно сделать вывод, что новое комплексное соединение ДГБМ проявляет избирательную активность в отношении патогенных микроорганизмов, показывая максимальную подавляющую активность при минимальных концентрациях на Staphylococcus aureus (золотистый стафилококк) и Escherichia coli (кишечная палочка) [6]. Прочерк в таблице означает, что данное вещество не оказывает никакого влияния на культуру микроорганизма. Предлагаемый спектр применения синтезированного соединения очень широк, само вещество экологически безопасно как для человека, так и для животных. Таким образом, на основе приведенного сравнительного анализа можно сделать выводы:
1. Новое синтезированное комплексное соединение имеет схожее строение и свойства с ранее изученным веществом – диглициноборной кислотой.
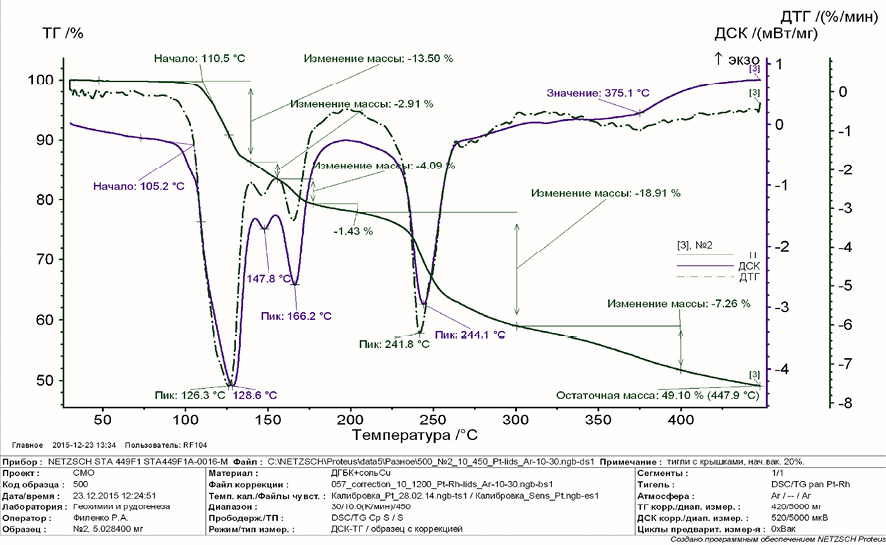
Рис. 6. Термограмма диглицинобората меди
Таблица 3
Минимальная подавляющая концентрация диглицинобората меди (II), дицитратобората гуанидиния и дицитратобората оксихинолиния на различные культуры микроорганизмов
|
№ п/п |
Название культуры микроорганизма |
МПК (мкг/мл) |
|||
|
ДГБМ |
ДЦБГ |
ДЦБО |
Гуанидин гидрохлорид |
||
|
1 |
Кишечная палочка (АТСС 25922) |
0,2 |
0,300 |
250 |
– |
|
2 |
Золотистый стафилококк (25923) |
0,002 |
0,030 |
250 |
0,090 |
|
3 |
Дрожжеподобные грибы рода Кандида |
0,2 |
0,003 |
– |
0,009 |
2. Изучены свойства диглицинобората меди (II) методами термического анализа и ИК-спектроскопии, а также поведение соединения в растворе методом кондуктометрии.
3. Отсутствие в строении агрессивных компонентов делает применение вещества доступным и безопасным как в области сельского хозяйства, так и для промышленного получения нового поколения биоцидных препаратов.
4. Наблюдается избирательная биоцидная активность даже при малых концентрациях диглицинобората меди на патогенные микроорганизмы по сравнению с имеющимися аналогами.
Библиографическая ссылка
Тютрина С.В., Бурнашева Н.Н., Хатькова А.Н., Соловьева Т.Л. СИНТЕЗ, СТРОЕНИЕ И ИЗУЧЕНИЕ БИОЦИДНЫХ СВОЙСТВ КОМПЛЕКСНОЙ СОЛИ ДИГЛИЦИНОБОРАТА МЕДИ (II) // Успехи современного естествознания. 2016. № 8. С. 61-66;URL: https://natural-sciences.ru/ru/article/view?id=36079 (дата обращения: 22.01.2026).



