Эфиры пара гидроксибензойной кислоты (название соединений по Европейской фармакопее), или парабены (название соединений по Фармакопее США), применяют главным образом при изготовлении суспензий и микстур, а также в парфюмерной промышленности в качестве антимикробных консервантов. В этой статье для краткости изложения материала использовали наименование Фармакопеи США. Кроме того, парабены могут вводиться в состав твердых желатиновых капсул для предотвращения разрушения желатина микроорганизмами. Наиболее часто применяют метилпарабен (нипагин) и пропилпарабен (нипазол), их обычно используют совместно в соотношении по массе 4:1. Кроме того, бутилпарабен применяют в качестве пластификатора при изготовлении лекарственных форм. Условия хроматографирования парабенов полностью гармонизированы в соответствующих фармакопейных статьях Европейской фармакопеи и Фармакопеи США. Следует, однако, отметить, что наряду с нейтральными (фенольными) формами парабенов в Фармакопее США описаны натриевые (растворимые) формы парабенов [6, 7]. В монографиях зарубежных фармакопей приведена методика хроматографирования парабенов на колонках С18 150×4,6 мм (5 мкм) при длине волны 272 нм. В качестве подвижной фазы применяют смесь 6,8 г/л КН2РО4 в воде – метанол (35:65). Скорость потока – 1,3 мл/мин. Данные условия хроматографирования применяют при анализе метил-, этил- и пропилпарабенов. При анализе бутилпарабена соотношение компонентов подвижной фазы – 50:50. Изменение состава подвижной фазы вызвано необходимостью определения примеси в консерванте – изобутилпарабена [5]. Н-гептилпарабен не описан в фармакопейных статьях, его применяют в качестве внутреннего стандарта при количественном определении такролимуса в мазях и некоторых других препаратов. В данном случае применение внутреннего стандарта компенсирует эффект неполной экстракции препаратов из гидрофобной мазевой основы. В этом исследовании, н-гептилпарабен использовали только как гидрофобное соединение при изучении свойств хроматографических колонок с фенильными и нитрильными сорбентами.
Цель работы – исследование возможности применения хроматографических колонок с нитрильными и фенильными сорбентами для определения антимикробных консервантов в лекарственных препаратах.
Материалы и методы исследования
Работа проводилась c использованием хроматографа Agilent, серия 1100 с диодно-матричным детектором («Agilent Technologies», США). Разделение парабенов осуществляли на следующих колонках: Zorbax XDB C18 150×4,6 мм (5 мкм), Zorbax SB Phenyl 150×4,6 мм (3,5 мкм), Zorbax XDB CN 150×4,6 мм (5 мкм), Zorbax NH2 150×4,6 мм (5 мкм) («Agilent Technologies», США), Spherisorb Phenyl 150×4,6 мм (5 мкм) («Waters», США) и Диасфер Фенил 150×4,6 мм (5 мкм) («БиоХимМак», Россия). В работе использовали стандартные образцы метил-, этил-, пропилпарабенов Европейской фармакопеи, стандартный образец бутилпарабена Фармакопеи США. Стандартный образец 4-гидроксибензойной кислоты н-гептиловый эфир (н–гептилпарабен) («Dr. Ehrenstorfer GmbH», Германия).
Результаты исследования и их обсуждение
Некоторые результаты хроматографирования парабенов приведены в табл. 1. Следует отметить, что отклик детектора при 260 нм в 1,64 раза больше, чем при детектировании парабенов при 272 нм, учитывая невысокое содержание парабенов в лекарственных препаратах и желатиновых капсулах, детектирование при 260 нм более предпочтительно. Эффективность колонок при применении подвижных фаз (метанол – 50 мМ КН2РО4 или ацетонитрил – 50 мМ КН2РО4) в среднем в 1,3 раз больше, чем при применении аналогичных по содержанию органики подвижных фаз без буферного компонента. Не было выявлено особых преимуществ в использовании в качестве органических компонентов подвижных фаз ацетонитрила либо метанола. Необходимо отметить только заметное увеличение времени удерживания бутилпарабена, и особенно н-гептилпарабена, при использовании подвижных фаз, содержащих метанол на хроматографических колонках с фенильными сорбентами. Хотя разрешение между пиками низших гомологов парабенов при этом возрастает, не наблюдается заметного увеличения их времен удерживания. Время удерживания н-гептилпарабена на колонках с фенильными и нитрильными сорбентами значительно меньше, чем на колонке Zorbax XDB C18 (табл. 1, рис. 1, 2).
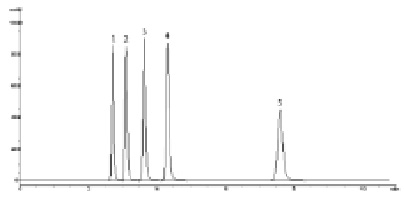
Рис. 1. Хроматограмма модельной смеси стандартных образцов парабенов. Условия анализа: колонка Spherisorb Phenyl 150×4,6 мм (5 мкм); подвижная фаза – ацетонитрил – 50 мМ КН2РО4 (рН 4,6) (40:60); скорость потока – 1,0 мл/мин; детектирование 260 нм. 1 – метилпарабен, 2 – этилпарабен, 3 – пропилпарабен, 4 – бутилпарабен, 5 – н-гептилпарабен
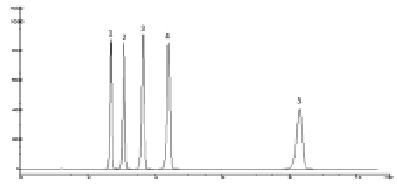
Рис. 2. Хроматограмма модельной смеси стандартных образцов парабенов. Условия анализа: колонка Zorbax XDB CN 150×4,6 мм (5 мкм); подвижная фаза – ацетонитрил – вода (40:60); скорость потока – 1,0 мл/мин; детектирование 260 нм. 1 – метилпарабен, 2 – этилпарабен, 3 – пропилпарабен, 4 – бутилпарабен, 5 – н-гептилпарабен
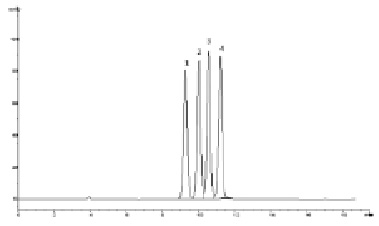
Рис. 3. Хроматограмма модельной смеси стандартных образцов парабенов. Условия анализа: колонка Zorbax NH2 150×4,6 мм (5 мкм); подвижная фаза – ацетонитрил – 2мМ КН2РО4 (98:2); скорость потока – 1,0 мл/мин; детектирование 260 нм: 1 – н-гептилпарабен, 2 – бутилпарабен, 3 – этилпарабен, 4 – метилпарабен
Времена удерживания и разрешение между пиками метил-, этил-, пропил- и бутилпарабена при различных условиях хроматографирования*
|
Колонка. Состав подвижной фазы |
Разрешение между пиками метил- и этилпарабена |
Разрешение между пиками пропил- и бутилпарабена |
Время удерживания метил-парабена, мин |
Время удерживания пропил-парабена, мин |
Время удерживания н-гептил-парабена, мин |
|
Zorbax XDB C18 150×4,6 мм (5 мкм) Ацетонитрил – 50 мМ КН2РО4 (4:6) |
9,78 |
16,08 |
2,94 |
6,07 |
69,58 |
|
Zorbax XDB C18 150×4,6 мм (5 мкм) метанол – 50 мМ КН2РО4 (55:45) |
9,29 |
16,15 |
3,14 |
8,17 |
57,33 |
|
Zorbax XDB C18 150×4,6 мм (5 мкм) Ацетонитрил – вода (4:6) |
6,51 |
13,30 |
2,65 |
6,105 |
61,57 |
|
Zorbax SB Phenyl 150×4,6 мм (3,5 мкм) Ацетонитрил – вода (4:6) |
6,87 |
10,76 |
3,17 |
5,29 |
22,1 |
|
Spherisorb Phenyl 150×4,6 мм (5 мкм) Ацетонитрил – вода (4:6) |
3,01 |
3,89 |
2,67 |
4,24 |
7,51 |
|
Spherisorb Phenyl 150×4,6 мм (5 мкм) Ацетонитрил – 50 мМ КН2РО4 (4:6) |
3,51 |
4,60 |
2,73 |
6,35 |
7,60 |
|
Spherisorb Phenyl 150×4,6 мм (5 мкм) метанол – 50 мМ КН2РО4 (4:6) |
5,79 |
6,88 |
3,31 |
6,24 |
40,88 |
|
Zorbax XDB CN 150×4,6 мм (5 мкм) Ацетонитрил – вода (4:6) |
3,43 |
5,09 |
2,72 |
3,65 |
8,30 |
|
Диасфер Фенил 150×4,6 мм (5 мкм) Ацетонитрил – 50 мМ КН2РО4 (4:6) |
5,64 |
8,26 |
3,58 |
5,86 |
22,06 |
|
Zorbax NH2 150×4,6 мм (5 мкм) Ацетонитрил – 2 мМ КН2РО4 (95:5) |
1,04 |
– |
5,31 |
4,94 |
4,48 |
|
Zorbax NH2 150×4,6 мм (5 мкм) Ацетонитрил – 2 мМ КН2РО4 (98:2) |
1,07 |
– |
10,3 |
9,60 |
8,70 |
Примечание. *средняя величина пяти определений для каждого условия хроматографирования.
Данный факт объясняется тем, что при сорбции парабенов на этих сорбентах ключевую роль имеют p-p взаимодействия между бензольными кольцами анализируемых соединений и функциональными группами сорбентов. В отличие от этого, на сорбентах С18 главным образом имеют место гидрофобные взаимодействия между поверхностью сорбента и анализируемыми соединениями, поэтому время удерживания сильно зависит от длины алифатических цепей анализируемых соединений. Аналогичный эффект повышения селективности фенильных и нитрильных сорбентов к ароматическим группировкам и к системам сопряженных двойных связей наблюдался при анализе антиоксидантов бутилгидроксианизола и бутилгидрокситолуола [1, 4], а также сорбиновой кислоты [3]. По причине присутствия фенольных гидроксильных групп в молекулах анализируемых соединений, также можно ожидать схожести поведения парабенов и антиоксидантов на колонках с аминосорбентами в условиях жидкостной хроматографии гидрофильных взаимодействий [2]. На рис. 3 приведена хроматограмма разделения модельной смеси парабенов в данных условиях хроматографирования, при этом меняется очерёдность элюирования анализируемых соединений по сравнению с обращённо-фазовой хроматографией. Следует отметить, что разрешение между пиками парабенов в условиях жидкостной хроматографии гидрофильных взаимодействий существенно меньше, чем в условиях обращенно-фазовой хроматографии (таблица). Так, при использовании в качестве подвижных фаз смесей ацетонитрила и воды, время удерживания метилпарабена на колонке Zorbax XDB CN 150×4,6 мм (5 мкм) возрастало только с 1,64 мин до 1,73 мин при увеличении содержания ацетонитрила в подвижной фазе с 90 % до 99,9 %.
Заключение
Хроматографические колонки с фенильными и нитрильными сорбентами могут быть использованы для определения парабенов в лекарственных препаратах. Исследования по хроматографии в гомологическом ряду парабенов также могут быть полезным инструментом для изучения физико-химических свойств фенильных и нитрильных сорбентов. Разрешение между пиками парабенов в условиях жидкостной хроматографии гидрофильных взаимодействий существенно меньше, чем в условиях обращенно-фазовой хроматографии.
Библиографическая ссылка
Осипов А.С., Попова О.А., Сулейманов Р.Р., Нездольева М.В. ПРИМЕНЕНИЕ МЕТОДА ВЫСОКОЭФФЕКТИВНОЙ ЖИДКОСТНОЙ ХРОМАТОГРАФИИ ДЛЯ АНАЛИЗА ЭФИРОВ 4-ГИДРОКСИБЕНЗОЙНОЙ КИСЛОТЫ // Успехи современного естествознания. 2016. № 11-2. С. 256-260;URL: https://natural-sciences.ru/ru/article/view?id=36219 (дата обращения: 07.03.2026).



