Ряд селенорганических соединений проявляет высокую биологическую активность [5, 8]. Селен является важным микроэлементом для млекопитающих, в том числе для человека [10]. В организме человека действует селенсодержащий фермент глутатионпероксидаза, катализирующий реакцию глутатиона с перекисными соединениями, присутствие которых в организме является причиной таких распространенных патологий, как сердечно-сосудистые заболевания, в том числе атеросклероз и ишемическая болезнь сердца, инсульт головного мозга, болезнь Паркинсона, артрит и многие другие заболевания [5, 8, 10]. Пероксидазоподобную активность проявляет ряд известных селенорганических соединений, например, Эбселен, который уже используется в медицине [5, 8].
Многие органические соединения, имеющие своем составе бензольные кольца с электронодонорными заместителями – гидрокси- и метоксигруппами, проявляют антиоксидантную активность [3, 9]. Из природных антиоксидантов, кроме витаминов и лигнанов, можно отметить флавоноиды [9]. Большинство флавоноидов имеют в своем составе бензольные кольца с электронодонорными заместителями – гидрокси-, метокси- и метильными группами [9].
Таким образом, сочетание в молекуле селенсодержащей группы и ароматического фрагмента с сильными электронодонорными заместителями может обеспечить высокую биологическую активность, и в первую очередь антиоксидантные и глутатионпероксидазоподобные свойства.
Одним из основных направлений наших исследований является разработка эффективных методов синтеза ненасыщенных халькогенорганических соединений – веществ с потенциальной биологической активностью и ценных полупродуктов для органического синтеза [6]. Синтез новых селенорганических соединений с целью поиска препаратов с высокой биологической активностью, в том числе с пероксидазоподобным эффектом, является актуальной задачей. С целью получения потенциально биологически активных веществ нами разработаны эффективные методы синтеза ненасыщенных 4-триметоксифенилселанов. Входящие в состав этих соединений ненасыщенные группы (аллильная, пропаргильная и винильная) обеспечивают возможность дальнейших превращений и получения новых производных. Также эти соединения представляют большой интерес как активированные субстраты в реакциях с галогенидами халькогенов, в которых может сочетаться присоединение по ненасыщенной группе и электрофильное ароматическое замещение с образованием конденсированных продуктов (ряд подобных реакций осуществлен нами ранее с использованием аллилфенилового и пропаргилфенилового эфиров [1, 6, 7]). Следует отметить, что 4-метоксифенильный фрагмент входит в структуру ряда медицинских препаратов [2].
Материалы и методы исследования
Спектры ЯМР 1Н и 13С регистрировали на приборе Bruker DPX-400 (рабочие частоты 400.13, и 100.61 МГц соответственно) в CDCl3, внутренний стандарт – ГМДС. Элементный анализ выполнен на приборе Thermo Finigan EA 1112.
Синтез винил(4-метоксибензил)селана (2) в системе NaBH4/EtOH. К раствору 0,744 г (2 ммоль) бис(4-метоксифенил)диселана в 40 мл этанола порциями добавили 0,3 г боргидрида натрия и перемешивали 1 ч при комнатной температуре. Смесь нагревали (80–100 °С) во вращающемся автоклаве (объемом 250 мл) под давлением ацетилена (10–12 атм) в течение 5 ч. Из смеси отогнали растворитель. Остаток промыли гексаном, фильтровали. После отгонки растворителя на роторном испарителе из фильтрата остаток сушили в вакууме. Получили 0,809 г (выход 95 %) селана 2 в виде желтоватой жидкости.
Спектр ЯМР 1Н, d, м.д.: 3.76 c (3Н, OCH3), 5.71 д (1Н, = CH2, 3J = 17 Гц), 5.82 д (1Н, = CH2, 3J = 10 Гц), 6.76 д. д (1Н, = CHSе, 3J = 10, 3J = 17 Гц), 6,89 д (2Наром.), 7.41 д (2Наром.).
Спектр ЯМР 13С, d, м.д.: 55.94 (OCH3), 106.12 (НCаром.), 111.68 ( = CH2), 129,06 ( = CHSе), 132,72 (Cаром.), 137,27 (ОCаром.), 153,29 (ОCаром.).
Найдено, %: С 51,12; Н 4,92; Sе 36,83. C9H10OSе. Вычислено, %: С 50,72; Н 4,73; Sе 37,05.
Синтез винил(4-метоксибензил)селана (2) в системе гидразингидрат/КOH/ДМФА/Н2О. К раствору 0.744 г (2 ммоль) бис(4-метоксифенил)диселана в 40 мл ДМФА добавили 1 г (15 ммоль) 85 %-го гидроксида калия, 0,5 мл воды и 3 мл гидразингидрата и нагревали смесь (80–90 °С) во вращающемся автоклаве (объемом 250 мл) под давлением ацетилена (10–12 атм) в течение 5 ч. Смесь разбавили водой (100 мл) и экстрагировали эфиром (3х20 мл). Органическую фазу промыли водой, сушили Na2SO4. После отгонки растворителя на роторном испарителе остаток сушили в вакууме. Получили 0,767 г (выход 90 %) селана 2 в виде желтоватой жидкости.
Аллил(4-метоксифенил)селан (4). К раствору 0,744 г (2 ммоль) бис(4-метоксифенил)диселана и 0,532 г (4,4 ммоль) аллилбромида в 40 мл этанола порциями добавили 0,3 г боргидрида натрия и перемешивали 16 ч при комнатной температуре. Из смеси отогнали растворитель. Остаток промыли гексаном, фильтровали. После отгонки растворителя на роторном испарителе из фильтрата остаток сушили в вакууме. Получили 0,863 г (выход 95 %) селана 4 в виде желтоватой жидкости.
Спектр ЯМР 1Н, d, м.д.: 3,69 д (2Н, SeCH2, 3J = 7 Гц), 3,80 c (3Н, OCH3), 5,09 д (1Н, = CH2, 3J = 17 Гц), 5,32 д (1Н, = CH2, 3J = 10 Гц), 5,79 м (1Н, = CH), 6,89 д (2Наром.), 7,43 д (2Наром.).
Спектр ЯМР 13С, d, м.д.: 35,21 (SеCH2), 55,76 (OCH3), 106,07 (НCаром.), 116,88 ( = CH2), 133,32 (Cаром.), 134,17 ( = CH), 137,14 (ОCаром.), 153,03 (ОCаром.).
Найдено, %: С 53,16; Н 5,51; Se 35,02, C10H12OSе. Вычислено, %: С 52,87; Н 5,32; Se 34,76.
Пропаргил(4-метоксифенил)селан (5). К раствору 0,744 г (2 ммоль) бис(4-метоксифенил)диселана и 0,524 г (4,4 ммоль) пропаргилбромида в 40 мл этанола добавили 0,3 г боргидрида натрия и перемешивали 16 ч при комнатной температуре. Из смеси отогнали растворитель. Остаток промыли гексаном, фильтровали. После отгонки растворителя на роторном испарителе из фильтрата остаток сушили в вакууме. Получили 0,819 г (выход 91 %) селана 5 в виде желтоватой жидкости.
Спектр ЯМР 1Н, d, м.д.: 2,26 т (1Н, CH, 4J = 3 Гц), 3,75 д (2Н, SеCH2, 4J = 3 Гц), 3,75 c (3Н, OCH3), 6,83 д (2Наром.), 7,41 д (2Наром.).
Спектр ЯМР 13С, d, м.д.: 10,87 (SеCH2), 55,88 (OCH3), 71,26 (≡СН), 81,05 (≡С), 105,81 (НCаром.), 132,72 (Cаром.), 136,92 (ОCаром.), 152,99 (ОCаром.).
Найдено, %: С 53,64; Н 4,67; Se 34,83. C10H12OSе. Вычислено, %: С 53,35; Н 4,48; Se 35,07.
Результаты исследования и их обсуждение
Разработаны удобные и эффективные способы получения 4-метоксифенилселанов, содержащих винильную, аллильную и пропаргильную группы, с выходами 90–95 % на основе бис(4-метоксифенил)диселана (1). Эффективные методы синтеза винил-, аллил-, и пропаргил-4-метоксифенилселанов основаны на восстановлении бис(4-метоксифенил)диселана до 4-метоксифенилселенолат-аниона боргидридом натрия или гидразингидратом в присутствии КОН с последующей реакцией с ацетиленом, аллилгалогенидами или пропаргилгалогенидами.
На основе диселана 1 и ацетилена разработан эффективный способ получения винил(4-метоксифенил)селана (2) с выходом до 95 % реакцией нуклеофильного присоединения 4-метоксифенилселенолат-аниона к ацетилену (Схема 1).
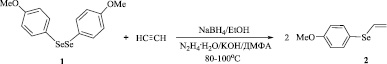
Схема 1
Для получения винилселана 2 из соединения 1 использованы две основно-восстановительные системы: NaBH4/EtOH и гидразингидрат/КОН/ДМФА/H2O. При действии боргидрида натрия или гидразингидрата и гидроксида калия на диселан 1 генерируется 4-метоксифенилселенолат-анион 3, нуклеофильное присоединение которого к ацетилену в присутствии донора протонов приводит к винилселану 2 (Схема 2). Вода или этанол играют роль донора протонов.
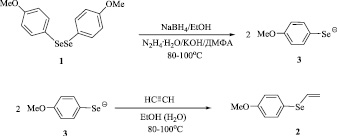
Схема 2
Реакция осуществляется под давлением ацетилена в автоклаве при температуре 80–100 °С. Система NaBH4/EtOH оказалась несколько более эффективной: выход продукта составил 95 %, в то время как в системе гидразингидрат/КОН/ДМФА/H2O винилселан 2 получен с выходом 90 %.
Разработан эффективный способ получения аллил(4-метоксифенил)селана (4) и пропаргил(4-метоксифенил)селана (5) восстановлением диселана 1 основно-восстановительной системой NaBH4/EtOH с последующей реакцией 4-метоксифенилселенолат-аниона с аллилбромидом или пропаргилбромидом. Выход полученных по этому методу продуктов 4 и 5 составил 95 % и 91 % соответственно (Схема 3).
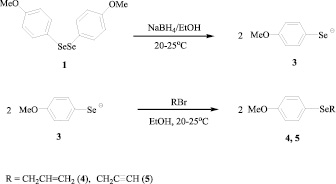
Схема 3
Бис(4-метоксифенил)диселан 1 синтезирован с выходом 72 % по известному методу [4] на основе реакции реактива Гриньяра, полученного из 4-броманизола и магния, с элементным селеном. В конце реакции обработка промежуточного 4-метоксифенилселанилмагнийбромида водой приводит к 4-метоксифенилселенолу, который легко окисляется кислородом воздуха с образованием диселана 1 (Схема 4).
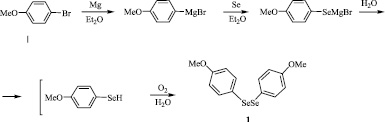
Схема 4
Строение продуктов 2, 4, 5 доказано методами ЯМР 1H, 13C и подтверждено данными элементного анализа.
В спектре ЯМР 1Н винилселена 2 присутствуют типичные для винилселанильной группы сигналы: два дублета при 5,71 и 5,82 м.д. и дублет дублетов при 6,76 м.д. с константами спин-спинового взаимодействия 10 Гц (3Jцис) и 17 Гц (3Jтранс).
В спектре ЯМР 1Н пропаргилселена 5 наблюдаются триплет протона терминальной ацетиленовой группы ≡СН при 2,26 м.д. и дублет группы CH2Se при 3,75 м.д. с константой спин-спинового взаимодействия около 3 Гц (4JНН). В спектре ЯМР 13С пропаргилселена 5 сигналы пропаргилселанильной группы проявляются при 10,87 (SеCH2), 71,26 (≡СН) и 81,05 м.д. (≡С).
В спектрах ЯМР 1Н соединений 2, 4, 5 имеются сигналы протонов бензольного кольца в виде двух дублетов в ароматической области с константами спин-спинового взаимодействия около 8 Гц (3Jцис).
Метоксигруппа в бензольном кольце соединений 2, 4, 5 проявляется синглетом при 3,75–3,80 м.д. в спектрах ЯМР 1Н и сигналом в области 55–56 м.д. в спектрах ЯМР 13С.
Полученные селаны имеют способные к дальнейшей функционализации ненасыщенные группы (винильную, аллильную и пропаргильную) и являются перспективными полупродуктами для синтеза новых селенорганических соединений с потенциальной биологической активностью.
Выводы
1. Разработаны эффективные и технологичные способы получения аллил-4-метоксифенилселана и пропаргил-4-метоксифенилселана с выходами 90–95 % на основе бис(4-метоксифенил)диселана и аллилбромида или пропаргилбромида. Реакции 4-метоксифенилселенолат-аниона с аллилбромидом и пропаргилбромидом протекают при комнатной температуре в этаноле.
2. Разработан эффективный метод синтеза винил-4-метоксифенилселана с выходом 95 % из бис(4-метоксифенил)диселана, который реализуется в автоклаве под давлением ацетилена 10–12 атмосфер при температуре 80–100 °С. Реакция протекает как нуклеофильное присоединение к ацетилену 4-метоксифенилселенолат-аниона в присутствии донора протонов (этанола или воды).
Работа выполнена в рамках проекта Российского научного фонда (№ 14-13-01085). Основные результаты получены с использованием материально-технической базы Байкальского аналитического центра коллективного пользования СО РАН.
Библиографическая ссылка
Потапов В.А., Амосова С.В. ЭФФЕКТИВНЫЕ МЕТОДЫ СИНТЕЗА НЕНАСЫЩЕННЫХ 4-МЕТОКСИФЕНИЛСЕЛАНОВ // Успехи современного естествознания. 2016. № 12-1. С. 31-35;URL: https://natural-sciences.ru/ru/article/view?id=36256 (дата обращения: 03.01.2026).



