Многокомпонентные растворы электролитов являются наиболее распространенными объектами химической технологии. Однако оптимальный подбор компонентов для получения электролитных систем с требуемыми физико-химическими и электрохимическими параметрами является сложной задачей. Так, при исследовании электропроводности смесей электролитов необходимо учитывать, что даже в отсутствие химического взаимодействия между ионами закон независимого движения Кольрауша строго выполняется только при бесконечном разбавлении. Согласно теории Онзагера и Фуосса [6], в растворах смесей электролитов, если сравнивать их с индивидуальными растворами, меняются силы релаксационного торможения. Межионные же взаимодействия в смеси электролитов уменьшают различие в подвижностях одноименнозаряженных ионов, а увеличение концентрации смеси приводит к росту ассоциаций ионов, что приводит к увеличению отклонений от аддитивности и все закономерности еще более усложняются [1, 8]. Таким образом, можно сделать вывод, что, несмотря на определенные успехи в развитии теоретических представлений, современная теория растворов смесей электролитов разработана недостаточно, а используемые теоретические модели для решения данной задачи относительно точны в области малых концентраций и имеют значительные расхождения в области высоких концентраций [5, 7, 9].
В работах [2, 3] показана возможность применения плазменной модели состояния вещества к совокупности ионов в растворах слабых и сильных электролитов, поскольку растворы электролитов по основным параметрам газовой и твердотельной плазмы занимают промежуточное положение по пространственно-временным масштабам разделения зарядов, плазменному параметру и условию квазинейтральности. Полученные результаты позволили рассчитывать теоретически, без привлечения произвольных подгоночных параметров все диссипативные свойства растворов электролитов (электропроводность, диффузия, вязкость, теплопроводность) в широком диапазоне изменения концентраций в удовлетворительном соответствии с экспериментально определенными литературными данными с точностью от 1 до 2 %. Авторами было получено уравнение для расчета электропроводности в приближении плазмоподобного состояния ионов в растворах электролитов в виде
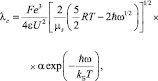 (1)
(1)
где концентрация электролита включена в значение потенциальной энергии взаимодействия частиц, определяемой выражением
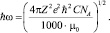
Таким образом, уравнение для расчета электропроводности индивидуальных растворов электролитов имеет вид
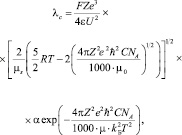 (2)
(2)
где F – постоянная Фарадея; Z – эффективный заряд; e – элементарный заряд; e – диэлектрическая постоянная среды; R – универсальная газовая постоянная; T – температура в К; h – постоянная Планка; С – концентрация электролита в моль/л; NA – постоянная Авогадро; kБ – постоянная Больцмана; U – энергия водородной связи; µ0 – приведеннная масса несольватированных ионов; µs – приведенная масса сольватированных ионов; a – степень диссоциации, для сильных электролитов степень a = 1, а для слабых электролитов возможно определение a из закона разбавления Оствальда по известным значениям Kд:
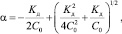
где С0 – исходная концентрация в моль/л.
Предлагаемое уравнение (2) для индивидуальных растворов электролитов в водных и неводных средах объясняет λ практически во всем диапазоне концентрации.
В настоящей работе для решения проблемы теоретических оценок электропроводности смесей электролитов с различными эквивалентными концентрациями С1, С2, ..., Сn предлагается ввести мольные доли ионов для смесей электролитов в состав приведенных масс сольватированных и несольватированных ионов, поскольку движения различных ионов в смеси электролитов являются сопряженными и коррелированными [4]:
С = С1 + С2 +...+ Сn;
1/µ0 = N1/m1 + N2/m2 +.. + Nn/mn; (3)
1/µs = N1/ms1 + N2/ms2 +...+ Nn/msn, (4)
где N1, N2, ..., Nn – мольные доли ионов:
N1 = C1/C; N2 = C2/C; ...; Nn = Cn/C,
m1, m2, ..., mn – массы несольватированных ионов в смеси; ms1, ms2, ..., msn – массы сольватированных ионов в смеси, рассчитанные по уравнению
ms = Мns + m,
где М – молярная масса растворителя; m – масса несольватированного иона; ns – cольватное число. Определение сольватных чисел отдельных ионов возможно на основе следующих рассуждений.
Ион с зарядом Zie взаимодействует с ns молекулами растворителя, имеющими дипольный момент р и дипольное расстояние R0. Такое взаимодействие является ион-дипольным. Потенциалы иона и диполя при этом равны соответственно
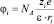 и
и 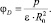 (5а)
(5а)
Их потенциальные энергии имеют следующий вид:
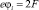 и
и 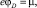 (5б)
(5б)
где m – химический потенциал молекулы растворителя; F – изохорно-изотермический потенциал или свободная энергия.
Для ион-дипольного взаимодействия можно записать первое начало термодинамики в виде
TdS + µdN = dU + A,
где А = pdE – есть работа, совершаемая ионом по ориентации ns молекул растворителя в сольватный комплекс под действием поля иона Ев. Тогда имеет место следующее выражение:
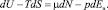 (6)
(6)
Значение этой работы pdE можно установить из выражения термодинамики диэлектриков во внешнем поле Ев в виде
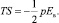 (7)
(7)
Тогда
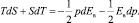
При p и s = const имеет место
 (8)
(8)
Подставляя это значение pdE в уравнение (6), получим
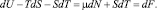 (9)
(9)
Значение SdT можно установить из определения:
dU = dF + SdT.
Выразив из этого выражения SdT и подставив в уравнение (9), получим
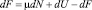
или, иначе,
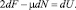 (10)
(10)
Здесь изменение внутренней энергии есть
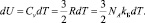
Интегрирование уравнения (10) приводит к виду
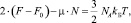
где 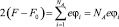 и
и 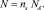 Тогда с учетом выражений (5) получим следующее уравнение:
Тогда с учетом выражений (5) получим следующее уравнение:
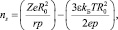 (11)
(11)
где Z – заряд иона; R0 – радиус молекулы растворителя; r – радиус иона; р – дипольный момент; е – заряд электрона; e – диэлектрическая постоянная среды; Т – температура; kБ – постоянная Больцмана.
Результаты рассчитанных величин сольватных чисел ионов и их сопоставление с литературными данными приведены в табл. 1.
Таблица 1
Данные теоретических оценок сольватных чисел ионов в воде при Т = 298 К
|
Ионы |
r*1010, м |
ns расч. |
ns Э.Э. |
ns Р.С. |
Ионы |
r*1010, м |
ns расч. |
ns Э.Э. |
ns Р.С. |
|
Li+ |
0,74 |
5,72 |
5,00 |
7,00 |
Mn2+ |
1,05 |
8,82 |
– |
– |
|
Na+ |
0,98 |
4,04 |
4,00 |
3,50 |
Fe2+ |
1,06 |
9,13 |
– |
– |
|
K+ |
1,26 |
2,92 |
3,00 |
1,90 |
Zn2+ |
0,96 |
9,34 |
– |
– |
|
Rb+ |
1,37 |
2,60 |
1,20 |
– |
Cd2+ |
0,93 |
9,67 |
– |
– |
|
Cs+ |
1,46 |
2,37 |
– |
– |
Hg2+ |
1,00 |
8,84 |
– |
– |
|
Ag+ |
1,39 |
2,55 |
– |
– |
Al3+ |
0,56 |
25,6 |
21,0 |
– |
|
Be2+ |
0,49 |
19,3 |
– |
– |
Cr3+ |
0,77 |
18,4 |
– |
– |
|
Mg2+ |
0,73 |
12,6 |
13,0 |
13,2 |
Fe3+ |
0,75 |
18,9 |
– |
– |
|
Ca2+ |
0,93 |
9,67 |
– |
12,0 |
Cl– |
1,84 |
1,67 |
3,00 |
– |
|
Sr2+ |
1,02 |
3,73 |
– |
10,7 |
Br– |
1,96 |
1,50 |
2,00 |
– |
|
Ba2+ |
1,11 |
7,94 |
– |
7,70 |
J– |
2,15 |
1,28 |
1,00 |
– |
Полученные величины сольватных чисел далее используем при расчете электропроводностей электролитных систем.
В связи с тем, что в справочной литературе отсутствуют достоверные значения электропроводностей смесей электролитов, получены их экспериментальные значения и сравнены с соответствующими данными теоретических расчетов.
Таблица 2
Эквивалентная электропроводность λ (Ом-1·см2·моль-1) смеси водных растворов
|
С1, моль/дм3 |
С1, моль/дм3 |
N1 |
N2 |
1/µ0 |
1/µs |
fM |
λрасч |
λэксп |
|
KBr + NH4Cl при Т = 293 К |
||||||||
|
1,5 |
1,5 |
0,5 |
0,5 |
0,0609 |
0,0317 |
0,6991 |
71,1 |
68,3 |
|
1,5 |
1,0 |
0,6 |
0,4 |
0,0563 |
0,0301 |
0,7303 |
74,1 |
72,8 |
|
1,5 |
0,5 |
0,75 |
0,25 |
0,0495 |
0,0276 |
0,7683 |
76,7 |
75,0 |
|
1,0 |
1,5 |
0,4 |
0,6 |
0,0654 |
0,0333 |
0,7126 |
75,2 |
72,8 |
|
1,0 |
1,0 |
0,5 |
0,5 |
0,0609 |
0,0317 |
0,7465 |
78,7 |
80,2 |
|
1,0 |
0,5 |
0,67 |
0,33 |
0,0533 |
0,0289 |
0,7891 |
81,8 |
87,3 |
|
0,5 |
1,5 |
0,25 |
0,75 |
0,0723 |
0,0357 |
0,7272 |
80,4 |
76,9 |
|
0,5 |
1,0 |
0,33 |
0,67 |
0,0685 |
0,0344 |
0,7645 |
85,0 |
83,8 |
|
0,5 |
0,5 |
0,5 |
0,5 |
0,0609 |
0,0317 |
0,8132 |
89,5 |
88,9 |
|
KBr + NaNO3 при Т = 293 К |
||||||||
|
1,5 |
1,5 |
0,5 |
0,5 |
0,0488 |
0,0243 |
0,7257 |
66,1 |
65,9 |
|
1,5 |
1,0 |
0,6 |
0,4 |
0,0467 |
0,0241 |
0,7511 |
69,4 |
70,4 |
|
1,5 |
0,5 |
0,75 |
0,25 |
0,0434 |
0,0239 |
0,7812 |
73,2 |
78,8 |
|
1,0 |
1,5 |
0,4 |
0,6 |
0,0510 |
0,0244 |
0,7415 |
68,5 |
67,6 |
|
1,0 |
1,0 |
0,5 |
0,5 |
0,0488 |
0,0243 |
0,7697 |
72,2 |
74,5 |
|
1,0 |
0,5 |
0,6666 |
0,3333 |
0,0452 |
0,0241 |
0,8039 |
80,4 |
74,8 |
|
0,5 |
1,5 |
0,25 |
0,75 |
0,0542 |
0,0247 |
0,7589 |
75,9 |
70,5 |
|
0,5 |
1,0 |
0,3333 |
0,6666 |
0,0524 |
0,0245 |
0,7986 |
79,9 |
79,7 |
|
0,5 |
0,5 |
0,5 |
0,5 |
0,0488 |
0,0243 |
0,8310 |
80,9 |
81,9 |
|
KСl + MgCl2 при Т = 288 К |
||||||||
|
0,5 |
0,5 |
0,5 |
0,5 |
0,0545 |
0,0239 |
0,7547 |
66,5 |
66,5 |
|
0,5 |
0,05 |
0,909 |
0,09 |
0,0539 |
0,0304 |
0,8126 |
83,8 |
91,8 |
|
0,5 |
0,005 |
0,990 |
0,009 |
0,0537 |
0,0317 |
0,8199 |
86,7 |
97,5 |
|
0,05 |
0,5 |
0,09 |
0,909 |
0,0551 |
0,0174 |
0,8106 |
63,2 |
65,5 |
|
0,05 |
0,05 |
0,5 |
0,5 |
0,0545 |
0,0239 |
0,9148 |
88,3 |
88,9 |
|
0,05 |
0,005 |
0,909 |
0,09 |
0,0539 |
0,0304 |
0,9365 |
103,0 |
105,1 |
|
0,005 |
0,5 |
0,009 |
0,99 |
0,0553 |
0,0161 |
0,8176 |
61,5 |
63,5 |
|
0,005 |
0,05 |
0,093 |
0,909 |
0,0551 |
0,0174 |
0,9357 |
77,8 |
83,9 |
|
0,005 |
0,005 |
0,5 |
0,5 |
0,0545 |
0,0239 |
0,9722 |
96,3 |
103,0 |
|
KСl + AlCl3 при Т = 288 К |
||||||||
|
0,5 |
0,5 |
0,5 |
0,5 |
0,0501 |
0,0211 |
0,7187 |
59,6 |
81,0 |
|
0,5 |
0,05 |
0,909 |
0,09 |
0,0531 |
0,0299 |
0,7771 |
80,1 |
95,8 |
|
0,5 |
0,005 |
0,990 |
0,009 |
0,0537 |
0,0316 |
0,7842 |
83,5 |
96,7 |
|
0,05 |
0,5 |
0,09 |
0,909 |
0,0471 |
0,0121 |
0,7885 |
52,2 |
63,1 |
|
0,05 |
0,05 |
0,5 |
0,5 |
0,0501 |
0,0211 |
0,9008 |
83,4 |
89,6 |
|
0,05 |
0,005 |
0,909 |
0,09 |
0,0531 |
0,0299 |
0,9233 |
103,1 |
105,7 |
|
0,005 |
0,5 |
0,009 |
0,99 |
0,0465 |
0,0104 |
0,7975 |
49,1 |
61,5 |
|
0,005 |
0,05 |
0,093 |
0,909 |
0,0471 |
0,0121 |
0,9276 |
66,2 |
81,6 |
|
0,005 |
0,005 |
0,5 |
0,5 |
0,0501 |
0,0211 |
0,9675 |
92,3 |
104,9 |
Для измерения удельной электрической проводимости растворов электролитов использовалась термостатируемая кондуктометрическая ячейка, подключенная к кислородомеру «Анион-410» фирмы ИНФРА-СПАК-АНАЛИТ (Россия), где в основе измерения удельной электрической проводимости раствора положен принцип измерения проводимости раствора в ячейке Кольрауша. Для обеспечения достоверности и точности измерений использовался комбинированный выносной датчик ДКВ-1, являющийся кондуктометрическим первичным преобразователем, представляющий собой четырехэлектродную ячейку погружного типа со стальным электродом марки 12Х18Н9Т.
В задачу экспериментальной части работы входило измерение электропроводности смесей растворов электролитов при 9 различных концентрациях для 171 смеси двойных систем 19 различных составов.
В табл. 2 представлены некоторые результаты экспериментально полученных и теоретически оцененных по уравнению (2) электрических проводимостей смесей растворов электролитов с учетом мольных долей каждого компонента.
Сопоставление рассчитанных величин электропроводностей с экспериментальными данными для тройных водных систем, в которых два электролита имеют общий ион, показывает лучшее соответствие. В случае двух электролитов, не имеющих общего иона, наблюдается различие рассчитанных и экспериментальных значений электропроводности. Это явление объясняется, по-видимому, тем, что в таких растворах кроме исходных электролитов образуются и перекрестные соединения.
Таким образом, теоретически оцененные величины электропроводностей смесей растворов электролитов в соответствии с уравнением (2) и учетом мольных долей ионов, хорошо согласуются с экспериментальными данными.
Библиографическая ссылка
Балданова Д.М., Танганов Б.Б. ОПРЕДЕЛЕНИЕ ЭЛЕКТРИЧЕСКОЙ ПРОВОДИМОСТИ СМЕСЕЙ ВОДНЫХ РАСТВОРОВ ЭЛЕКТРОЛИТОВ // Успехи современного естествознания. 2016. № 12-2. С. 245-249;URL: https://natural-sciences.ru/ru/article/view?id=36294 (дата обращения: 03.03.2026).



