В настоящее время интерес к карбоциклическим соединениям норборненового типа значительно вырос в связи с тем, что наличие цис-ориентированного непредельного напряженного углеводородного скелета позволяет рассматривать их как потенциальные полифункциональные мономеры. Существует теоретическая и практическая возможность и необходимость получения полимеров с реализацией различных механизмов полимеризации. Полимеризация непредельных напряженных циклов, к которым относятся норборненовый или циклопентеновый циклы, может протекать как по метатезисному механизму с раскрытием цикла и образованием углеводородной цепи с регулярным расположением двойной связи, так и по аддитивному с раскрытием двойной связи и образованием линейного полимера имеющего в цепи напряженный насыщенный цикл (рис. 1).
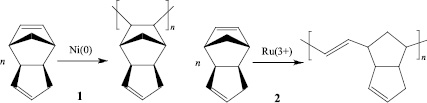
Рис. 1. Схема реакции полимеризации дициклопентадиена: 1 – аддитивный механизм; 2 – метатезисный механизм с раскрытием цикла
Одним из наиболее распространенных подходов к синтезу производных норборнена являются реакции 1,4-присоединения диенофилов к сопряженным кратным связям циклопентадиена (ЦПД) [5], позволяющие получать как карбо-, так и гетероциклические соединения [8, 6, 14]. Механизм реакций Дильса – Альдера предполагает образование эндо- и экзо-стереоизомеров и их соотношение определяется различными внутренними и внешними факторами, в том числе термодинамическими параметрами образующихся соединений [5, 7].
Исследованию каталитических реакций 1,4-присоединения различными соединениями, в том числе протонными и апротонными кислотами, посвящен ряд работ [16, 13, 15]. На результат реакции (выход аддуктов, соотношение изомеров) в значительной мере влияют используемые растворители, молекулы которых, вероятно, являются составной частью каталитического комплекса [7, 11]. Исследования каталитических реакций ЦПД с различными диенофилами, имеющими в своей структуре одну или более функциональных групп или гетероатомов, являются более актуальными ввиду своих обширных синтетических возможностей.
Такими структурами, в частности, являются непредельные соединения с силановой группой, как связанной с двойной связью, так и связанной через мостиковый фрагмент. Интерес к силановым непредельным соединениям связан с разными причинами, в частности с использованием их в качестве мономеров для получения полимерных газопроницаемых селективных мембран, а также для получения новых агентов для сшивки полиолефиновых композиционных материалов. Отличием норборненовых производных от существующих сшивающих агентов является наличие циклоолефиновой двойной С=С связи, обуславливающее возможность полимеризации и сополимеризации по катионному механизму. Такая возможность предполагает создание новых сополимерных термопластичных материалов, сшивающихся при гидролизе водой или водными растворами.
Одним из способов получения производных норборнена, имеющих в 5-положении заместители, содержащие силоксановые функциональные группы – Si(OR)3 являются реакции между ЦПД и g-метакрилоксипропилтриметоксисиланом, катализируемые протонными и апротонными кислотами.
В работе [1] было экспериментально показано, что скорость реакции между МПТМС и ЦПД и выход продукта сополимеризации зависит от типа используемого катализатора, его способности к комплексообразованию с исходными мономерами.
Изучение строения органических соединений и механизма реакций тесно связано с использованием квантово-химических расчетов, позволяющих оценить электронное строение и геометрию молекул, суммарные заряды на атомах, энтальпию образования, изменение кратности двойной связи мономера в результате вхождения его в состав донорно-акцепторного комплекса. В комплексах мономер обычно выступает как нуклеофильный агент, что влечет за собой перераспределение электронной плотности на атомах углерода двойной связи по сравнению со свободным мономером.
Хорошее соответствие между расчетными по методу PM6 и экспериментальными данными отмечалось при интерпретации ЯМР 1Н спектров комплексов эфиров метакриловой кислоты с TiCl4 [2, 3]. При изучении особенностей и механизма взаимного влияния атомов в комплексных хлорсодержащих соединениях Sn с успехом были использованы полуэмпирический метод PM3 [4] и неэмпирические методы квантовой химии [12]. Анализ экспериментальных данных по ЯКР 35Сl спектрам комплексов элементов IVA группы с расчетами различными методами квантовой химии показал [12], что целесообразно использовать метод RHF/6-31G(d), который дает наилучшее соответствие с экспериментальными данными при вычислении частот ЯКР 35Сl и параметров асимметрии градиента электрического поля на ядрах 35Сl. Использование методов более высокого уровня и более затратных (B3LYP и МР2), а также более широких базисных наборов не приводит к улучшению соответствия между экспериментальными и вычисленными параметрами ЯКР.
В настоящей работе методами ЯМР 1Н спектроскопии и полуэмпирического метода РМ7 исследованы комплексы МПТМС с протонными и апротонными кислотами как промежуточные соединения в кислотно катализируемой реакции Дильса – Альдера с циклопентадиеном.
Материалы и методы исследования
Уксусную кислоту использовали квалификации «ледяная» без дополнительной очистки. Монохлоруксусную кислоту использовали чистоты 99 %, трихлоруксусную кислоту квалификации «хч» 99,5 %, трифторуксусную кислоту квалификации «хч» 99 % («Acros Organics»). Тетрахлорид титана квалификации «осч» 99,9 %. Тетрахлорид олова использовали чистоты 99 %. Эфират трехфтористого бора, содержание BF3 48 % («Acros Organics»). g-Метакрилоксипропилтриметоксисилан (Силан А-174 Silquest) 99,9 % (Yangzhou Lida Resin Co). Комплексы МПТМС с протонными и апротонными кислотами готовили в мольных соотношениях 1:1 в стеклянных ампулах. ЯМР 1Н-спектры измеряли с использованием ЯМР Фурье-спектрометра «AVANCE AV 300» («Bruker»). Растворитель– дейтерохлороформ (99,9 %). Внутренний стандарт – ГМДС.
Квантово-химические расчеты проводили с использованием программы MOPAC2016 [17]. Геометрические параметры (длины связей, валентные и торсионные углы), определяющие положение атомов друг относительно друга и относительно реакционного центра, оптимизировали по стандартной процедуре.
Результаты исследования и их обсуждение
При образовании донорно-акцепторного комплекса непредельный мономер – кислота, мономер обычно выступает как нуклеофильный агент, что влечет за собой перераспределение электронной плотности в молекуле мономера по сравнению со свободным мономером. Это, естественно, должно отражаться в изменении ЯМР 1Н-спектров соответствующих соединений. На рис. 2 представлен спектр МПТМС и отнесение сигналов его протонов.
В табл. 1 и 2 представлены химические сдвиги сигналов протонов в ЯМР 1Н-спектрах комплексов и смещений этих сигналов относительно исходного МПТМС.
При образовании комплексов МПТМС с протонными и апротонными кислотами происходит изменение электронной плотности в молекуле мономера, что отражается в сдвиге сигналов протонов в слабое поле (табл. 1, 2). Образование комплексов подтверждается также изменением окраски раствора при смешивании исходных реагентов, что особенно ярко проявляется для комплексов SnCl4 и TiCl4.
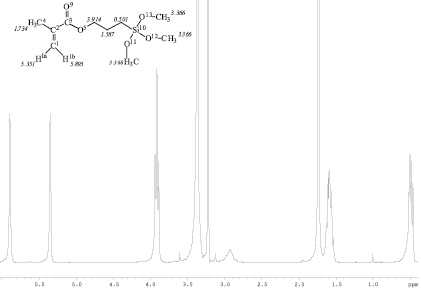
Рис. 2. ЯМР 1Н-спектр МПТМС
Таблица 1
Химические сдвиги протонов МПТМС и его комплексов с протонными кислотами
|
Группа |
Химические сдвиги протонов, δ, м. д. |
||||||
|
МПТМС |
МПТМС + +CH3COOH(1) |
Δδ |
МПТМС + +CH2ClCOOH(2) |
Δδ |
МПТМС + +CCl3СООН(3) |
Δδ |
|
|
–C8H2– |
0,501 |
0,595 |
0,094 |
0,657 |
0,156 |
0,677 |
0,176 |
|
C4H3– |
1,734 |
1,831 |
0,097 |
1,873 |
0,139 |
1,883 |
0,149 |
|
ОСН3 |
3,366 |
3,468 |
0,102 |
3,517 |
0,151 |
3,534 |
0,168 |
|
–C6H2– |
3,914 |
4,013 |
0,099 |
4,057 |
0,143 |
4,080 |
0,166 |
|
C1aH2= |
5,351 |
5,446 |
0,095 |
5,500 |
0,149 |
5,529 |
0,178 |
|
C1bH2= |
5,895 |
5,995 |
0,100 |
6,046 |
0,151 |
6,066 |
0,171 |
Таблица 2
Химические сдвиги протонов комплексов МПТМС с апротонными кислотами
|
Группа |
Химические сдвиги протонов, δ, м. д. |
|||||
|
МПТМС+ + TiCl4(4) |
Δδ |
МПТМС+ + SnCl4(5) |
Δδ |
МПТМС+ + BF3•O(C2H5)2(6) |
Δδ |
|
|
–C8H2– |
0,877 |
0,376 |
0,690 |
0,189 |
0,600 |
0,099 |
|
C4H3– |
1,963 |
0,229 |
1,923 |
0,189 |
1,866 |
0,132 |
|
ОСН3 |
3,565 |
0,199 |
3,521 |
0,155 |
3,426 |
0,060 |
|
–C6H2– |
4,380 |
0,466 |
4,170 |
0,256 |
4,093 |
0,179 |
|
C1aH2= |
5,762 |
0,411 |
5,604 |
0,253 |
5,508 |
0,157 |
|
C1bH2= |
6,375 |
0,480 |
6,144 |
0,249 |
6,037 |
0,142 |
По величине увеличения смещения сигналов протонов соответствующих групп комплексы с протонными кислотами располагаются в ряд:
1 (CH3COOH) < 2 (CH2ClCOOH) < 3 (CCl3COOH).
Для апротонных кислот:
6 (BF3O(C2H5)2) < 5 (SnCl4) < 4 (TiCl4).
Причем для комплексов TiCl4 и SnCl4 наблюдается наибольшее смещение сигналов протонов относительно свободного МПТМС. То есть апротонные кислоты оказывают более сильное влияние на перераспределение электронной плотности в молекуле МПТМС, чем протонные кислоты.
Для комплексов МПТМС с протонными кислотами наибольшее смещение сигналов протонов относительно свободного МПТМС наблюдается для метоксильной группы триметоксисилильного фрагмента, C1aH2= и C1bH2= винильной группы. Это свидетельствует о возможном участии винильной и метоксильных групп в процессе комплексообразования с протонными кислотами.
Для комплексов МПТМС с апротонными кислотами наибольшее смещение сигналов протонов относительно свободного МПТМС наблюдается для метиленовой –C6H2– группы и C1aH2=, C1bH2= винильной группы. Для метоксильной группы это смещение минимально, по сравнению с сигналами протонов других групп, что говорит о малом участии СН3О–группы в реакции комплексообразования с апротонными кислотами.
Молекула МПТМС имеет несколько реакционных центров, способных к комплексообразованию с кислотами: атом кислорода карбонильной группы, винильная группа, атомы кислорода оксипропильной группы и оксиметильной групп триметоксисилильного фрагмента. Поэтому существует возможность образования комплексов типа nϖ (n – неподеленная пара электронов карбонильной (эфирной) группы донора, ϖ – вакантная орбиталь акцептора) или πϖ (π – электроны ненасыщенных связей донора). Также следует учитывать, что TiCl4 и SnCl4 могут образовывать комплексные соединения состава 1:1, 2:1 различной пространственной структуры: тетраэдра, тригональной бипирамиды, октаэдра [9, 10]. Для выяснения особенностей строения образующихся комплексов нами был использован полуэмпирический метод PM7.
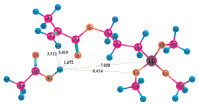
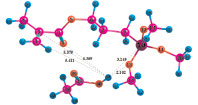
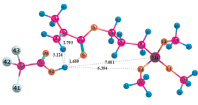
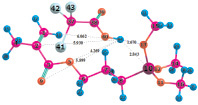
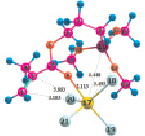
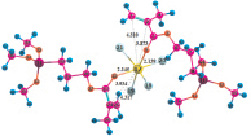
Расчеты для комплексов МПТМС с протонными кислотами показали, что карбоновые кислоты образуют наиболее устойчивые комплексы двух типов: с координацией протона кислоты по карбонильному атому кислорода, или по атому кислорода группы –OCH3. Геометрия комплексов представлена на рис. 3, термодинамические характеристики реакции комплексообразования в табл. 3. Комплексы с координацией по винильной группе и по атому O5 оксипропильной группы являются неустойчивыми.
|
|
|
|
1а |
1б |
|
|
|
|
2а |
2б |
|
|
|
|
3а |
3б |
Рис. 3. Геометрия наиболее устойчивых комплексов МПТМС с протонными кислотами: 1 – МПТМС•CH3COOH; 2 – МПТМС•CH2ClCOOH; 3 – МПТМС•CCl3COOH; а – координация по атому O9 карбонильной группы; б – координация по атому O13 группы –OCH3
Таблица 3
Термодинамические характеристики реакции образования комплексов 
|
Комплекс |
H298,r, кДж/моль |
DS298,r, Дж/(моль•K) |
G298,r, кДж/моль |
ln Kp |
|
1а |
–44,25 |
–143,38 |
–1,52 |
0,61 |
|
1б |
–42,73 |
–155,71 |
3,67 |
–1,48 |
|
2а |
–86,78 |
–173,11 |
–35,19 |
14,20 |
|
2б |
–94,61 |
–190,02 |
–37,99 |
15,33 |
|
3а |
–83,32 |
–166,80 |
–33,61 |
13,57 |
|
3б |
–108,61 |
–203,59 |
–47,94 |
19,35 |
Представленные данные свидетельствуют, что CH3COOH образует наиболее устойчивый комплекс с МПТМС с координацией протона кислоты по карбонильному атому кислорода. Для комплексов МПТМС с более сильными кислотами (CH2ClCOOH, CCl3COOH) более устойчивыми являются комплексы с координацией протона по атому кислорода группы –OCH3. Доказательством этому является то, что в ЯМР 1Н-спектре комплекса 3 наблюдается расщепление сигнала протонов группы –OCH3 на 2 дуплета: 3,534 м. д. (J = 4,5 Гц) и 3,505 м. д. (J = 5,1 Гц) с соотношением интегральных интенсивностей 2:1, чего не наблюдается в спектре комплекса 1.
|
|
|
|
4а |
4б |
|
|
|
|
5а |
5б |
|
|
|
|
6а |
6б |
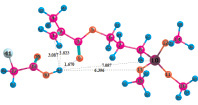
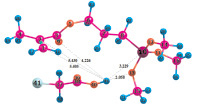
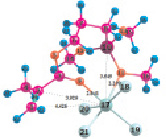
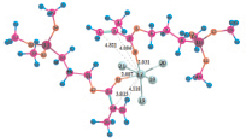
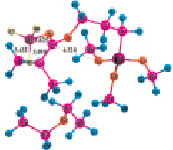
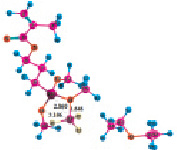
Рис. 4. Геометрия наиболее устойчивых комплексов МПТМС с апротонными кислотами: 4а – МПТМС•TiCl4; 4б – 2МПТМС•TiCl4; 5а – МПТМС•SnCl4; 5б – 2МПТМС•SnCl4; 6а – МПТМС•BF3…O(C2H5)2 (координация по атому O9); 6б – МПТМС•BF3…O(C2H5)2 (координация по атому O11)
Образование водородной связи карбоновой кислоты с группой –OCH3 триметоксильного фрагмента должно очень слабо влиять на изменение электронной плотности винильной группы МПТМС. Расчетное значение суммарного заряда на группе C1H2=C2(C4H3)–C3 МПТМС меняется следующим образом: МПТМС (0,6415); 1а (0,6849); 2б (0,6879); 3б (0,6524). То есть, трихлоруксусная кислота, несмотря на то, что образует самый прочный комплекс с МПТМС, практически не активирует двойную связь мономера. Отсюда следует вывод, что более сильные кислоты, скорее всего, будут взаимодействовать с группой –OCH3 МПТМС и практически не оказывать никакого каталитического действия на активность мономера.
Расчеты для комплексов МПТМС с апротонными кислотами показали, что эфират трехфтористого бора может образовывать комплексы с МПТМС только состава 1:1, а TiCl4 и SnCl4 – состава 1:1 и 1:2. Геометрия наиболее устойчивых комплексов представлена на рис. 4, термодинамические характеристики реакции комплексообразования – в табл. 4.
Таблица 4
Термодинамические характеристики реакции образования комплексов с апротонными кислотами
|
Комплекс |
H298,r, кДж/моль |
DS298,r, Дж/(моль•K) |
G298,r, кДж/моль |
ln Kp |
|
4а* |
–155,39 |
–260,68 |
–77,71 |
31,36 |
|
4б** |
–239,21 |
–384,30 |
–124,68 |
50,33 |
|
5а* |
–116,33 |
–218,03 |
–51,35 |
20,73 |
|
5б** |
–191,44 |
–426,56 |
–64,32 |
25,96 |
|
6а*** |
–75,41 |
–194,74 |
–17,38 |
7,01 |
|
6б*** |
–30,80 |
–97,17 |
–1,84 |
0,74 |
|
6в* |
–102,24 |
–173,30 |
–50,60 |
20,42 |
Примечания:
*
**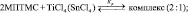
***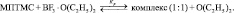
BF3•O(C2H5)2 с МПТМС образует устойчивые комплексы с координацией атома бора по карбонильному атому кислорода или по атому кислорода группы –OCH3, причем комплексы с координацией по карбонильной группе являются более устойчивыми. Как и для протоновых кислот, комплексы с координацией по винильной группе и по атому O5 оксипропильной группы являются неустойчивыми.
Взаимодействие эфирата трехфтористого бора с МПТМС является обменной реакцией, а комплексообразование TiCl4 и SnCl4 с МПТМС являются реакциями присоединения, с изменением координационного числа. Для корректного сравнения результатов по комплексообразованию апротонных кислот, в табл. 4 представлены также расчетные данные по реакции комплексообразования МПТМС с BF3 (6в).
Сравнение результатов для протонных и апротонных кислот (табл. 3 и 4) позволяет отметить следующие закономерности: реакции комплексообразования кислот Льюиса с МПТМС являются более экзотермичными; кислоты Льюиса образуют более прочные комплексы с МПТМС чем протонные кислоты; кислоты Льюиса, за исключением BF3, могут образовывать комплексы как 1:1, так и комплексы 2:1.
Представленные в табл. 4 и рис. 4 данные свидетельствуют, что BF3 и соответственно BF3O(C2H5)2 образуют наиболее устойчивые тетраэдрические комплексы с МПТМС с координацией атома бора по карбонильному атому кислорода. Для комплексов МПТМС с TiCl4 и SnCl4 более устойчивыми являются комплексы с координацией атома металла, как по карбонильному атому кислорода, так и по атому кислорода группы –OCH3. При этом реализуется цис-конфигурация искаженного октаэдрического комплекса. Устойчивость комплексов 1:1 с МПТМС увеличивается в ряду 6в ≈ 5а < 4a. Порядки связей Ti–O9 (0,5129), Ti–O11 (0,3588) значительно больше порядков связи Sn–O9 (0,2884), Sn–O11 (0,0038). Для комплексов трифторида бора порядки связи B–O9 (6а 0,4777; 6в 0,5009), B–O11 (6а 0,0; 6в 0,000004). Возможность координации атома металла по одному или по двум центрам основности молекулы МПТМС должна отразиться в разных механизмах передачи электронных эффектов и соответственно влияет на смещение сигналов протонов в ЯМР 1Н-спектрах комплексов, реакционную способность МПТМС. Это находит подтверждение в том, что расчетное значение суммарного заряда на фрагменте C1H2=C2(C4H3)–C3 МПТМС для самого прочного комплекса 4а (0,8051) меньше, чем для комплекса 5а (0,8388), но больше заряда для комплексов 6а (0,7593), 6в (0,7320). То есть активация двойной связи МПТМС за счет комплексообразования с апротонными кислотами зависит не только от прочности образующихся промежуточных комплексов, но и механизма передачи электронных эффектов в этих комплексах.
Учитывая все вышесказанное, можно предположить, что химический сдвиг сигналов протонов в спектрах комплексов МПТМС с кислотами зависит от прочности образующихся комплексов, от взаимного расположения этих протонов от центров основности МПТМС (атомы O9, O11), механизма передачи электронных эффектов. Анализ зависимостей химических сдвигов сигналов протонов в ЯМР 1Н-спектрах комплексов МПТМС с кислотами от расчетных значений ln Kp, зарядов на отдельных атомах МПТМС, суммарного заряда на фрагменте C1H2=C2(C4H3)–C3 МПТМС показал, что хорошая корреляция наблюдается только между величинами ln Kp и смещением сигналов протонов C4H3-группы в комплексах, относительно свободного МПТМС. Регрессионные уравнения для комплексов:
с протонными кислотами
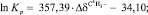
R = 0,9995; (выборка 1а, 2б, 3б);
с апротонными кислотами
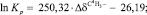
R = 0,9992; (выборка 6а, 5а, 4а).
Эти уравнения позволяют оценить прочность образующихся комплексов МПТМС с кислотами по химическим сдвигам сигналов протонов C4H3–группы, что очень важно при выбора катализатора.
В реальных условиях проведения реакции сополимеризации МПТМС с другими мономерами катализатор используется в каталитических количествах, то есть в условиях синтеза реализуется большой избыток мономера по отношению к катализатору. В этих условиях преимущественно образуются комплексы состава 2:1. Как показывают результаты расчета, в этом случае наиболее вероятно образование комплексов состава 2:1 с координацией TiCl4 или SnCl4 по двум карбонильным атомам O9 разных молекул МПТМС (рис. 4–4б; 4–5б). Для комплексов состава 2:1 отмечается больший перенос заряда на молекулу акцептора (4б –0,68344; 5б –0,39163; против 4а –0,5931; 5а –0,20858) и, как следствие, достаточно высокое значение суммарного заряда на фрагменте C1H2=C2(C4H3)–C3 МПТМС (4б –0,794821; 5б 0,819144). Таким образом, TiCl4 и/или SnCl4, независимо от состава образующихся комплексов, активируют молекулу МПТМС, создавая избыточный положительный заряд на фрагменте молекулы, содержащем двойную связь, и могут служить эффективными катализаторами различных процессов.
Выводы
1. С помощью ЯМР 1Н-спектроскопии и полуэмпирического метода PM7 исследованы комплексы МПТМС с протонными и апротонными кислотами и установлено, что величина смещения сигналов протонов МПТМС в комплексах зависит от устойчивости образующихся комплексов.
2. Для комплексов с карбоновыми кислотами и кислотами Льюиса раздельно установлены линейные зависимости между расчетными величинами ln Kp и экспериментальными значениями химического сдвига сигналов протонов метильной группы метакрилового фрагмента МПТМС в комплексах, что позволяет использовать найденные регрессионные уравнения для оценки устойчивости различных комплексов МПТМС.
3. Методами ЯМР 1Н-спектроскопии и квантовой химии показано, что центрами основности в МПТМС являются карбонильный атом кислорода и атом кислорода CH3O–группы триметоксисилильного фрагмента. Установлено, что МПТМС с CH3COOH образует наиболее устойчивый комплекс с координацией протона кислоты по карбонильному атому кислорода, а моно- и трихлоруксусные кислоты с координацией протона кислоты по группе –OCH3.
4. Установлено, что реакции комплексообразования МПТМС с кислотами Льюиса являются более экзотермичными, чем с протонными кислотами; кислоты Льюиса образуют более прочные комплексы с МПТМС, чем протонные кислоты; кислоты Льюиса, за исключением BF3, могут образовывать комплексы как 1:1, так и комплексы 2:1; в комплексах TiCl4 и SnCl4 координация происходит как по карбонильному атому кислорода, так и по атому кислорода метоксигруппы.
Библиографическая ссылка
Бондалетов В.Г., Бочкарев В.В., Огородников В.Д., Байкова Н.А., Кухленкова Н.О. КОМПЛЕКСООБРАЗОВАНИЕ γ-МЕТАКРИЛОКСИПРОПИЛТРИМЕТОКСИСИЛАНА С КАТАЛИЗАТОРАМИ КИСЛОТНОГО ТИПА // Успехи современного естествознания. 2016. № 12-2. С. 250-258;URL: https://natural-sciences.ru/ru/article/view?id=36295 (дата обращения: 03.03.2026).