Известны перзамещенные пара-нитрозофенолы, содержащие сложноэфирные группы в орто-положениях по отношению к гидроксилу [10]:
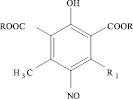
Их получают методом циклоконденсации изонитрозо-β-дикарбонильных соединений с эфирами ацетондикарбоновой кислоты в щелочных средах.
С помощью метода РСА в порошке было строго доказано, что эти соединения, в отличие от всех известных нитрозофенолов, димеризованы по типу азодиоксидов [6]. Строение димера, выясненное с помощью метода РСА в порошке для перзамещенного нитрозофенола [10], приведено на рис. 1.
Такие перзамещенные нитрозофенолы позволяют с помощью гидрирования легко получать соответствующие гексазамещенные аминофенолы [7], которые являются основой для синтеза современных противоаритмических препаратов [9]. Эти препараты получаются модификацией перзамещенных пара-аминофенолов и представляют собой диалкил 5-[(N,N-диэтилглицил)амино]-2-гидрокси-4,6-диметилизофталаты.
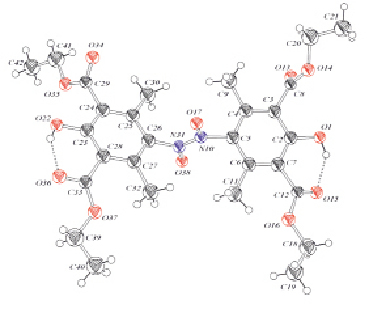
Рис. 1. Молекула 2,6-диэтоксикарбонил-3,5-диметил-4-нитрозофенола. Пунктирной линией показаны направления внутримолекулярных водородных связей
Ранее были изучены кислотные свойства перзамещенных нитрозофенолов. В работе [4] впервые определили рКа 6,35 для незамещенного 4-нитрозофенола, а позднее были найдены значения рКа для перзамещенных нитрозофенолов, отличающихся строением алкильных групп сложноэфирных заместителей. В работе [3] для пара-нитрозофенолов с R1 = CH3 приведены R (рКа) (табл. 1).
Таблица 1
Величины рКа диметилзамещенных нитрозофенолов
|
рКа |
R |
|
5,33 ± 0,01 |
CH3- |
|
5,35 ± 0,04 |
CH3CH2- |
|
5,35 ± 0,03 |
(CH3)2CH- |
|
5,38 ± 0,04 |
СН3СН2СН2СН2- |
|
5,58 ± 0,03 |
(СН3)2 СН2СН2- |
|
5,42 ± 0,03 |
СН3СН2СН2СН2СН2- |
|
5,64 ± 0,06 |
(СН3) 2СН2СН2СН2- |
Судя по приведенным экспериментальным данным, величина констант кислотности перзамещенных пара-нитрозофенолов почти не зависела от алкильных заместителей сложноэфирных групп. Количественной зависимости величины рКа от природы алкильного заместителя сложноэфирной группы авторам [3] выявить не удалось, хотя имелась тенденция к некоторому увеличению рКа с ростом алкильного заместителя сложноэфирной группы.
Недавно нами синтезированы полностью замещенные нитрозофенолы с пиридиновыми заместителями в ароматическом ядре [2], свойства которых пока малоизучены, где R1 = α-пиридил, β-пиридил либо γ-пиридил. Удалось лишь установить, что перзамещенные нитрозофенолы димеризованы в твердом состоянии, как и другие нитрозосоединения [8], в органических растворителях существует равновесие между димерной и мономерной формами. Кроме того, в мономерной форме наблюдаются 2 таутомера: нитрозофенольный и пара-бензохинонмонооксимный.

В то же время никаких данных о константах кислотности перзамещенных нитрозофенолов с пиридиновым остатком до сих пор не имеется, хотя кислотность относится к фундаментальным свойствам органических соединений.
Цель исследования
Определение константы кислотности полностью замещенных нитрозофенолов, содержащих пиридиновый заместитель. Установление зависимости кислотных свойств от строения пиридинового остатка.
Материалы и методы исследования
Определение рКа проводили спектрофотометрическим методом [1] при температуре 25 ± 0,1 °С, в цитратных буферных растворах [5]. УФ-спектры записывали на спектрофотометре HELIOS OMEGA в 0,1 н водной соляной кислоте либо в 0,1 н водном растворе едкого калия. Взвешивание образцов производилось на весах Sartorius CP2P (Германия).
Результаты исследования и их обсуждение
Спектрофотометрический метод оказался удобным для определения рКа, нитрозофенолов, т.к. спектры этих соединений и их анионов существенно отличаются и не накладываются друг на друга (рис. 2): если недиссоциированная форма нитрозофенолов поглощает в области 315 нм, то максимум поглощения нитрозофенолят-ионов смещается в область 400 нм. В качестве аналитической длины волны для определения рКа была выбрана λmах = 400 нм.
В ходе эксперимента получали значения ионизационного отношения I, представляющие собой отношения концентрации нитрозофенолят-иона к концентрации недиссоциированной формы в зависимости от величин рН растворов. После этого рассчитывали значения логарифмов ионизационного отношения при каждом значении рН буферных растворов, не менее 7–8, так, чтобы они перекрывали область, в которой нитрозофенолы ионизированы наполовину.
На графике для двух пиридилзамещенных нитрозофенолов приведены зависимости логарифмов I от рН (рис. 3). Видно, что зависимости оказались практически линейными, с тангенсом угла наклона прямой, близким к единице. Следовательно, мы наблюдаем именно процесс ионизации молекул, т.к. этот процесс описывается уравнением
lgI = pH – pKa.
По результатам измерений рассчитали средние значения констант кислотности. Расчеты проводили следующим образом: полученные экспериментальные значения pKa потенцировали, получая значения констант кислотности, затем находили средние значения Ka, взяв отрицательный логарифм которых получали средние значения pKa. Эти значения приведены с вычисленными ошибками [1] в табл. 2.
Анализ значений рКа подтверждает вывод авторов [3] о том, что замена метильного радикала сложноэфирной группы на этильный ведет к небольшому уменьшению кислотности нитрозофенолов.
Таблица 2
Величины рКа пиридилзамещенных нитрозофенолов
|
рКа |
R |
R1 |
|
4,10 ± 0,03 |
CH3- |
γ-пиридил |
|
4,24 ± 0,03 |
CH2CH3- |
γ-пиридил |
|
4,42 ± 0,05 |
СН3- |
β-пиридил |
|
4,62 ± 0,04 |
СН2СН3- |
β-пиридил |
|
4,35 ± 0,04 |
СН3- |
α-пиридил |
|
4,45 ± 0,04 |
СН2СН3- |
α-пиридил |
Важно, что при сравнении полученных нами значений с рКа перзамещенных нитрозофенолов [3], табл. 1, обнаруживается существенное повышение констант кислотности для нитрозофенолов с пиридиновыми заместителями, даже более чем на порядок. Это, вероятно, объясняется электроноакцепторными свойствами пиридинового ядра.
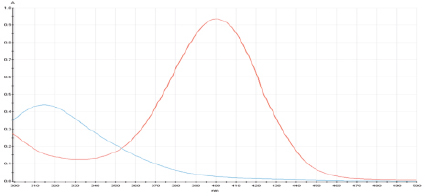
Рис. 2. Спектры 2,6-ди(метоксикарбонил)-3-метил-5-пиридин-4-ил-4-нитрозофенола в 0,1н HCl (1) и 0,1н KOH (2). D – оптическая плотность растворов
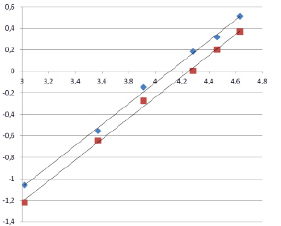
Рис. 3. Зависимость lg I от pH буферного раствора для 2,6-ди(метоксикарбонил)-3-метил-5-пиридин-4-ил-4-нитрозофенола (1) и ди(этоксикарбонил)-3-метил-5-пиридин-4-ил-4-нитрозофенола (2)
Если связывать наблюдаемое увеличение кислотности исключительно с электроотрицательностью атома азота пиридинового цикла, то наибольшая кислотность должна быть у нитрозофенолов с α-пиридиновым заместителем, затем с β-пиридиновым и наименьшую кислотность должны показывать нитрозофенолы с γ-пиридиновым остатком, т.к. индуктивный эффект затухает при увеличении числа связей.
Однако, как видно из данных табл. 2, кислотность снижается в ряду: пара-нитрозофенолов с γ-пиридиновыми заместителями > пара-нитрозофенолов с α-пиридиновыми заместителями > пара-нитрозофенолов с β-пиридиновыми заместителями. Такой характер влияния пиридиновых заместителей можно объяснить копланарным расположением бензольного и пиридинового колец в изучаемых соединениях. При этом атом азота пиридинового цикла способен влиять на реакционный центр, т.е. на фенольный гидроксил, за счет отрицательного мезомерного эффекта, передающегося по сопряженным π-связям ароматических циклов, лежащих в одной плоскости.
Данное предположение косвенно подтверждается и тем, что максимум поглощения пара-нитрозофенолят-ионов с пиридиновыми заместителями в электронных спектрах сдвинут примерно на 10 нм в длинноволновую область по сравнению с анионами нитрозофенолов без пиридиновых заместителей (400 нм и 390 нм соответственно). Такой батохромный сдвиг может быть объяснен сопряжением бензольного и пиридинового циклов при условии их копланарного расположения. Следовательно, и увеличение кислотности перзамещенных нитрозофенолов в ряду β-пиридиновый, α-пиридиновый и γ-пиридиновый заместитель, и изменение в электронных спектрах нитрозофенолов согласованно подтверждает плоскостное расположение системы пиридинового и фенольного колец
.Экспериментальная часть. Определение рКа для перзамещенных пара-нитрозофенолов проводили спектрофотометрическим методом при температуре 25 ± 0,1 °С, в цитратных буферных растворах. Оптическую плотность растворов нитрозофенолов определяли на спектрофотометре HELIOS OMEGA в кварцевых кюветах 1 см в интервале длин волн от 320 до 510 нм.
Для этого изначально готовили спиртовый раствор веществ в мерной колбе объемом V = 25 мл. Брали навеску расчетной массы, помещали в колбу № 1 (V = 25 мл), доводили до метки этиловым спиртом. Затем аликвоту в объеме V = 1 мл полученного спиртового раствора переносили в колбу № 2 (V = 50 мл) и доводили до метки 0,1 н раствором NaOH. Аналогично аликвоту 1 мл спиртового раствора гексазамещенных нитрозофенолов переносили в колбу № 3 (V = 50 мл) и доводили до метки 0,1 Н раствором НС1
Измеряли оптическую плотность полученных растворов на спектрофотометре и строили график зависимости оптической плотности (D) от длины волны (λ). Определяли аналитическую длину волны для каждого нитрозофенола. Затем готовили буферные растворы с различным значением рН.
При определении рКа гексазамещенных пара-нитрозофенолов использовали цитратные буферные растворы. Для этого готовили 7 буферных растворов по 250 мл с различным значением рН. После проверки правильности показаний рН-метра определяли рН всех приготовленных буферных растворов. Затем в каждый из буферных растворов добавляется по 1 мл приготовленного спиртового раствора полностью замещенного пара-нитрозофенола.
Для этого снова брали навеску вещества и доводили до метки этиловым спиртом в 25 мл колбе. Брали аликвоту по 1 мл и переносили в 7 колб по 50 мл и доводили до метки каждую разными буферными растворами, а в 2 колбы по 50 мл переносили аликвоты, но доводили их до метки 0,1 н раствором кислоты и 0,1 н раствором щелочи. При длине волны, на которой наблюдалась максимальная оптическая плотность перзамещенного нитрозофенола в 0,1 н растворе NаОН (λ = 400 нм), определяли значение оптической плотности полученных растворов
Вывод
1. Впервые получены значения констант кислотности шести перзамещенных пара-нитрозофенолов, содержащих пиридиновые заместители в бензольном кольце
2. Установлено, что введение пиридиновых заместителей в молекулу нитрозофенола вызывает увеличение кислотности более чем на порядок
3. Наблюдаемое увеличение кислотности может быть объяснено копланарным расположением бензольного и пиридинового циклов, при котором акцепторное действие атома азота передается по сопряженной системе π-связей. Это подтверждается и батохромным сдвигом максимума поглощения нитрозофенолят-ионов с пиридиновыми заместителями.
Библиографическая ссылка
Кукушкин А.А., Привалихина А.П., Роот Е.В., Слащинин Д.Г., Субоч Г.А., Товбис М.С. КИСЛОТНОСТЬ ПЕРЗАМЕЩЕННЫХ ПАРА-НИТРОЗОФЕНОЛОВ, СОДЕРЖАЩИХ ПИРИДИНОВЫЙ ЗАМЕСТИТЕЛЬ // Успехи современного естествознания. 2017. № 6. С. 18-22;URL: https://natural-sciences.ru/ru/article/view?id=36492 (дата обращения: 24.01.2026).



