Благодаря содержанию биологически активных соединений растения семейства Яснотковые используются как лекарственные в медицине, как эфироносы в парфюмерии, как пряно-ароматические в пищевой промышленности и являются ценными медоносами. Представители семейства Яснотковые издавна широко использовались в народной и научной медицине. В большей степени их лечебные свойства обуславливаются наличием эфирных масел, которые накапливаются в растениях [1]. Однако в последнее время внимание ученых привлекают также антиоксидантные свойства растений данного семейства [2]. К соединениям с антиоксидантными функциями относятся и полифенолы. Полифенолы представляют собой многочисленный класс природных соединений, многообразие которых обуславливается главным образом строением агликона (степенью окисленности трехуглеродного фрагмента, положением бокового фенильного радикала, величиной гетероцикла и другими признаками), а также составом гликозидного фрагмента [3].
До настоящего времени разработка единственного стандартного метода для эффективной и быстрой экстракции полифенолов из матриц растений остается проблемой [4]. Выделяют несколько основных подходов: во-первых, это так называемые «традиционные методы», основанные на способности фенольных соединений хорошо растворяться в водно-спиртовых растворах, во-вторых, это методы, относящиеся к направлению «зеленой химии». К этой группе методов относятся ультразвуковая, микроволновая экстракция, экстракция сверхкритическими флюидами, СО2-экстракция [4–6].
Целью работы явилось исследование эффективности различных методов экстракции полифенолов (жидкостной водно-спиртовой, ультразвуковой водно-спиртовой, ультразвуковой мицеллярной) из растений семейства Яснотковые: мяты луговой, шалфея лекарственного, иссопа лекарственного, лаванды узколистной, чабера садового.
Материалы и методы исследования
В качестве объекта исследования использовали растения душицы обыкновенной (Origanum vulgare L.), мяты луговой (Mеntha arvеnsis L.), шалфея лекарственного (Salvia officinalis L.), иссопа лекарственного (Hyssopus officinalis L.), лаванды узколистной (Lavandula angustifolia Mill.), чабера садового (Satureia hortensis L.), собранные в период массового цветения на территории Ботанического сада БФУ им. И. Канта в 2016 г. Растения высушивали до постоянного веса при 60 °С, измельчали и хранили в темном месте при комнатной температуре.
Экстракцию полифенолов осуществляли классическим методом жидкостной экстракции с использованием водно-спиртовых растворов и методами, основанными на использовании ультразвука (с использованием в качестве экстрагентов водно-спиртовых растворов и водных растворов додецилсульфата натрия SDS). В качестве источника ультразвука использовали ультразвуковой гомогенизатор LABSONIC M (Sartorius, Германия).
Предварительно были подобраны оптимальные условия экстракции полифенолов данными методами из растительного материала, на примере душицы обыкновенной. Дизайн эксперимента осуществляли статистическому трехуровневому пятифакторному плану Бокса-Бенкена с использованием программного обеспечения Minitab 17 (MINITAB Inc., США). Бокс-Бенкен дизайн относится к группе методов, основанных на расчёте поверхностей отклика и позволяющих проводить исследования по оптимизации условий с наименьшим количеством экспериментов по сравнению с другими статистическими подходами [7]. Для жидкостной водно-спиртовой экстракции (ЖВСЭ) оптимальными являлись следующие параметры: рН – 3,0; температура – 60 °С; соотношение этанол: вода – 50,0 %; время – 48,7 мин; соотношение экстрагент: навеска – 31,3. Для ультразвуковой водно-спиртовой экстракции (УВСЭ): соотношение этанол: вода – 50,0 %; рН – 7,0; время – 15 мин; амплитуда – 80 %; цикл – 0,8 с. Для ультразвуковой мицеллярной экстракции (УМЭ): концентрация SDS – 86,4 ммоль/л; время – 15,0 мин; амплитуда – 63,8 %; цикл – 0,8 с; соотношение экстрагент: навеска – 10,0.
Эффективность экстракции фенольных соединений оценивали по суммарному содержанию полифенолов, которое определяли спектрофотометрическим методом [8]. Количественное определение полифенолов основано на реакции образования берлинской лазури. В кислой среде фенольные соединения стехиометрически восстанавливают гексацианоферрат (III) калия до гексацианоферрата (II) калия, который в присутствии ионов трехвалентного железа образует окрашенное соединение (берлинская лазурь) с максимумом поглощения при 720 нм. Определение оптической плотности проводили на спектрофотометре Shimadzu UV-3600 (Shimadzu, Япония).
Для каждого вида экстракции эксперимент повторяли три раза. В таблицах и на рисунках приведены средние значения содержания полифенолов, выраженные на грамм сухого веса, с указанием стандартного отклонения. Достоверность различий между средними оценивали по критерию Тьюкки – Крамера (HSD). Достоверно различимые средние на рисунках обозначены различными строчными латинскими буквами.
Результаты исследования и их обсуждение
На сегодняшний день отсутствует единственный стандартный метод эффективной и быстрой экстракции полифенолов из матриц растений. Это в первую очередь связано с тем, что полифенолы представляют собой широкий класс соединений, включающий такие группы, как мономерные фенольные соединения, оксибензойные кислоты, оксикоричные кислоты, кумарины, флавоноиды [3]. В данной работе исследовали возможность использования для извлечения суммы полифенолов из растительной матрицы трех методов: жидкостной водно-спиртовой, ультразвуковой водно-спиртовой, ультразвуковой мицеллярной экстракции. Результаты исследования экстракции полифенолов из растений мяты луговой представлены на рис. 1.
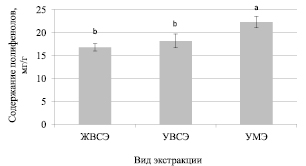
Рис. 1. Содержания полифенолов при использовании различных методов экстракции данных соединений из растений мяты луговой
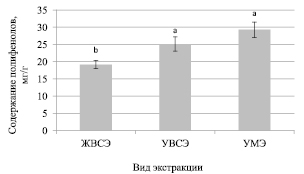
Рис. 2. Содержания полифенолов при использовании различных методов экстракции данных соединений из растений шалфея лекарственного
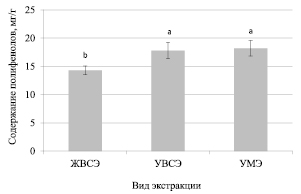
Рис. 3. Содержания полифенолов при использовании различных методов экстракции данных соединений из растений чабера садового
Как видно из представленных на рис. 1 данных, максимальный выход полифенолов наблюдался при использовании ультразвуковой мицеллярной экстракции (22,3 ± 1,2 мг/г). Между жидкостной и ультразвуковой водно-спиртовой экстракцией достоверных различий не установлено. Уровень полифенолов при использовании данных методов составил от 16,8 до 18,2 мг/г.
На рис. 2 представлены результаты исследований экстракции полифенолов из растений шалфея лекарственного. Наименьший выход полифенолов (19,2 ± 1,2 мг/г) из растительной матрицы наблюдался при использовании «традиционного метода» экстракции – жидкостной водно-спиртовой. При этом достоверных различий для мицеллярной и водно-спиртовой ультразвуковой экстракции выявлено не было. Уровень полифенолов варьировал в пределах от 25,1 до 29,3 мг/г.
Аналогичные результаты получены и при исследовании экстракции полифенолов из растений чабера садового (рис. 3). Максимальное содержание полифенолов определено при использовании метода ультразвуковой водно-спиртовой экстракции и мицеллярной ультразвуковой экстракции (17,8 ± 1,5 и 18,2 ± 1,4 мг/г соответственно). Достоверно более низкие значения получены при экстракции полифенолов «традиционным» методом – 14,3 ± 0,78 мг/г.
На рис. 4 представлены результаты исследования экстракции полифенолов из растений иссопа лекарственного. Как видно из представленных на рис. 4 данных, достоверные различия в эффективности извлечения выявлены для всех трех видов экстракции. При этом максимальный выход наблюдался для ультразвуковой мицеллярной экстракции (42,7 ± 3,2 мг/г). Минимальное содержание полифенолов было определено при использовании жидкостной водно-спиртовой экстракции – 24,9 ± 1,4 мг/г. Также стоит отметить, что растения иссопа лекарственного отличались примерно в 2–3 раза более высоким уровнем полифенолов по сравнению с другими исследованными видами растений семейства Яснотковые.
На рис. 5 представлены результаты исследования экстракции полифенолов из растений лаванды узколистной. Данный вид растений характеризовался минимальным содержанием полифенолов. Их уровень не превышал 10 мг/г. Кроме того, при использовании различных подходов к экстракции полифенолов из растений данного вида не было уставлено достоверных различий.
Как правило, при экстракции биологически активных соединений из растительной матрицы используют органические растворители, в частности растворы этанола или метанола. Однако развитие технологий так называемой «зеленой химии» основывается на постепенном отказе от такого рода веществ, поэтому в последнее время особое внимание при проведении процедур экстракции уделяется исследованиям возможности использования в качестве экстрагентов поверхностно-активных соединений и их мицеллярных растворов [9]. В ходе нашей работы было показано, что использование в качестве экстрагента растворов додецилсульфата натрия (SDS) позволяет эффективно проводить экстракцию полифенолов из пряно-вкусовых растений семейства Яснотковые.
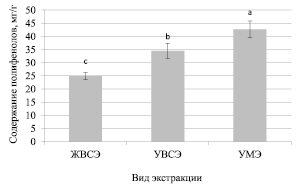
Рис. 4. Содержания полифенолов при использовании различных методов экстракции данных соединений из растений иссопа лекарственного
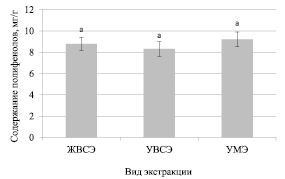
Рис. 5. Содержания полифенолов при использовании различных методов экстракции данных соединений из растений лаванды узколистной
Активно также внедряется в практику экстрагирования биологически активных растительных компонентов использование ультразвукового воздействия, которое позволяет сократить разрушение термически неустойчивых соединений и уменьшить время экстракции без потери выхода нужного вещества. Так, показана эффективность использования ультразвука при экстракции полифенолов из апельсинов [10], косточек винограда [11], листьев шалфея [12]. В ходе проведенных нами исследований было показано, что применение ультразвука позволяет сократить время экстракции. Так, при использовании «традиционного» метода жидкостной экстракции для достижения максимального выхода полифенолов оптимальное время составляло около 50 минут, тогда как при ультразвуковой экстракции – 15 минут.
Заключение
Таким образом, было показано, что при экстракции полифенолов из пряно-вкусовых растений семейства Яснотковые использование в качестве экстрагентов поверхностно-активных веществ в комбинации с ультразвуковой экстракцией позволяет повысить эффективность извлечения полифенолов из растительного материала, что особенно наглядно было продемонстрировано для растений с более высоким уровнем биологически активных веществ фенольной природы.
Библиографическая ссылка
Попова О.С., Скрыпник Л.Н. СРАВНИТЕЛЬНАЯ ХАРАКТЕРИСТИКА ЭФФЕКТИВНОСТИ РАЗЛИЧНЫХ МЕТОДОВ ЭКСТРАКЦИИ ПОЛИФЕНОЛОВ ИЗ РАСТЕНИЙ СЕМЕЙСТВА ЯСНОТКОВЫЕ // Успехи современного естествознания. 2017. № 6. С. 34-38;URL: https://natural-sciences.ru/ru/article/view?id=36495 (дата обращения: 07.03.2026).



