Пероксидаза (ПО; КФ 1.11.1.7) относится к классу оксидоредуктаз. Основная функция ПО – катализировать окисление химических соединений за счет пероксидного кислорода с образованием промежуточных комплексов [1].
Пероксидазы подразделяются на два семейства – животные и растительные [2]. Семейство растительных пероксидаз состоит из трех классов, выделяемых на основании исследований аминокислотных последовательностей ферментов [3]. К первому классу растительных ПО относятся внутриклеточные ферменты: аскорбатпероксидаза, бактериальная каталаза-пероксидаза и дрожжевая цитохром-с-пероксидаза, второй класс включает секретируемые грибные ферменты, а к третьему классу относятся секретируемые пероксидазы растений [4].
Пероксидаза является одним из ферментов, участвующих в регуляции роста и развития растительных организмов, поскольку катализирует защитные реакции от повреждений различного типа, а также участвует в формировании клеточной стенки и дыхании растений [5–7]. Доказана ее роль в образовании ауксина, этилена, восстановлении нитратов и нитритов, то есть в азотном обмене, ростовых процессах [8]. В присутствии ПО регулируется созревание и старение тканей, синтез лигнина [8]. ПО – наиболее часто изучаемый фермент при анализе сомаклональной изменчивости, возникающей в культуре ткани в условиях in vitro [9]. Кроме того, энзим является чувствительным к разного рода неблагоприятным воздействиям и широко используется исследователями для оценки чувствительности/устойчивости к стрессу [10–12]. ПО является индуцибельным ферментом, индуктором которого могут служить физические, химические и биологические факторы. Кислые и основные пероксидазы участвуют в ответных реакциях при стрессовом состоянии растительного организма. В самом начале активируются основные ПО, а изменения, связанные с метаболизмом ауксина и этилена, индуцируют усиление синтеза кислых ПО как более поздний шаг ответа или защиты.
Пероксидазную активность определяют не только для анализа метаболизма растений, но и в клинико-биохимических исследованиях патологических процессов животных тканей, для диагностики хронических и острых, а также аллергических заболеваний. Кроме того, лиофилизированные препараты ПО используются для диагностики бактериальных, аллергических, аутоиммунных и онкологических заболеваний, включая СПИД и лепру [13–18].
В настоящее время существует множество методов определения активности и выявления изоферментного спектра пероксидаз; некоторые методики весьма трудоемки, малочувствительны, дают противоречивые результаты [19–22]. Разнообразие методик определяется широкой субстратной специфичностью пероксидазы, поскольку фермент проявляет активность в присутствии пероксида водорода по отношению ко многим фенолам и ароматическим аминам: двухатомному фенолу пирокатехину (о-диоксибензолу), монометиловому эфиру пирокатехина – гваяколу, оксипроизводному нафталина – 1-нафтолу, 4,4'-диаминодифенилу, известному как бензидин, а также производному бензидина – 3,3'-диметоксибензидину (о-дианизидину), 2,2-азинобис-(3-этилбензотиазолин-6-сульфоновой) кислоте (АБТС) и многим другим [1, 21]. Таким образом, фермент является строго специфичным по отношению к перексиду водорода и широко специфичным – к другим субстратам [1]. Активность изоформ фермента также зависит от природы субстратов, а физиологические функции отдельных форм значительно отличаются. Отмечена видовая, органная, тканевая, внутриклеточная специфичность ПО [1].
В связи со значительным многообразием методов определения активности и выявления изоферментного спектра пероксидазы с применением различных субстратов целью настоящей работы явился обзор собственных 15-летних исследований, а также работ других авторов для выявления наиболее быстрого, незатратного, чувствительного способа в оптимальных субстратных условиях.
Объекты исследования
Обсуждаемые в обзоре эксперименты по определению активности и изоферментного спектра пероксидазы выполнены с использованием культурального фильтрата корневой губки различных штаммов (Heterobasidion annosum (Fr.) Bref.), почек дуба черешчатого (Quercus robur L.), листьев вяза обыкновенного (Ulmus laevis L.), микроклонов карельской березы (Betula pendula Roth var carelica Merkl.) и березы повислой (Betula pendula Roth), а также вейгелы цветущей «вариегата» (Weigela florida «Variegata» Bunge A.D.C.), хвои сосны обыкновенной (Pinus sylvestris L.), трансгенных растений сахарной свеклы (Beta vulgaris L.), сыворотки крови людей, больных артериальной гипертензией.
Получение ферментных препаратов из растительных тканей
Для получения растительных ферментных экстрактов навеску растительного материала растирают с битым песком в экстрагирующем буфере (0,1 М трис-НСl буфер, рН 7,5). Соотношение навески и буфера составляет в зависимости от образца от 1:4 до 1:10 (w/v). Гомогенат центрифугируют в эппендорфах в течение 10 минут при 20000 g, + 4 °С, на центрифуге СМ50 ELMI (Латвия). Надосадочные жидкости сохраняют при –3 °С в твердотельном термостате BIOSAN CH-100 (Латвия).
Буферы для определения активности пероксидазы
В зависимости от оптимума рН фермента используют 0,1 М ацетатный буфер в диапазоне рН 3,6–5,6; 0,1 М цитратный буфер (лимонная кислота / натрий лимоннокислый), pH 3,0–6,6; буфер Мак-Ильвейна (Na2HPO4/лимонная кислота) рН 3,0–6,3; 0,1 М трис-НСl – рН 7,2–9,0.
Молярность буфера. При изучении влияния молярности буфера на активность фермента установлено, что максимальная активность ПО в реакции с бензидином наблюдалась в 100–200 mM (0,1–0,2 М) трис-НСl буфере при рН 7,0.
Субстраты для определения активности пероксидазы
В проведенных нами экспериментах кинетика насыщения фермента субстратами имела вид равнобочной гиперболы, поэтому константы Михаэлиса определяли по методу двойных обратных величин (координаты Лайнуивера – Берка) [23]. Каталитическую активность устанавливают на основании детекции окрашенных продуктов реакции при 25 °С. Субстратная смесь состояла из 0,05 мл 0,1 % водного раствора АБТС (конечная концентрация 30 мкМ), 2,9 мл буфера, измерение оптической плотности проводят при длине волны 436 нм.
В реакции с пирокатехином для определения активности ПО используют 5 % водный раствор пирокатехина в 0,1 М буфере Мак-Ильвейна (конечная концентрация 41,3 mM). Определение активности проводят при длине волны 365 нм.
Для определения активности ПО в реакции с бензидином используют метод А.Н. Бояркова, разработанный впервые при использовании ФЭКа в 1951 г. [24]. Бензидиновый реактив включает два компонента [25]. Первый состоит из 50 % спиртового раствора 0,1 % бензидина солянокислого, содержащего 6 % ацетата натрия, 3 % уксусной кислоты. Конечная концентрация бензидина в реакционной смеси – 5,8 mM. Вторым компонентом является 0,5 % раствор пероксида водорода (конечная концентрация 0,3 mM). Значение рН бензидинового реактива составляет менее 2,0 единиц рН, а предварительные исследования выявили рН-оптимум действия ПО, равный 7,0. Поэтому первый компонент бензидинового реактива доводят до нейтрального значения рН растертым в порошок (для неизменности объема смеси) кристаллическим NaОН. Приготовленная таким образом основа бензидинового реактива может храниться в холодильнике при 0–4 °С в течение года. Для упрощения процедуры измерения активности ПО в кварцевую кювету вносят 3 мл первого компонента бензидинового реактива, предварительно согретого до комнатной температуры, и добавляют 18 мкл Н2О2. Измерения проводят при 520 нм.
Выявление изоферментного спектра пероксидаз
Изоферментный спектр ПО выявляют с использованием бензидинового реактива, о-дианизидина, α-нафтола.
Состав и методика применения бензидинового реактива описаны выше.
Х.С. Рафиковым впервые был использован для выявления пероксидазной реакции гаптоглобина крови о-дианизидин [26]. В состав проявляющей смеси входят 50 мл воды, 1 г о-дианизидина, 2,5 мл СН3СООН, 0,2 мл Н2О2. После появления оранжевых полос реакцию останавливают добавлением раствора 15 % уксусной кислоты.
Для приготовления проявляющей смеси с α-нафтолом берут 1 mM 1-нафтола в 0,1 М фосфатном буфере в присутствии 0,33 mM перекиси водорода. Данный метод используется, в частности, в клинико-диагностических лабораториях при цитохимическом диагностировании лейкозов [27].
Вертикальный электрофорез (ЭФ) проводят по стандартному методу Дэвиса в пластинах полиакриламидного геля (7,5 % по акриламидной смеси) при 4 °С. К 0,05–0,2 мл ферментного образца добавляют в качестве антиконвекционной смеси глицерин до конечной концентрации 20 %, в карман геля вносят 20 мкл пробы, в качестве лидирующего красителя используют бромфеноловый синий.
Выявление зон активности проводят по Левитесу [28], Божко [29], Рафикову [30], Юренковой [31, 32]. Гели высушивают на стеклянных пластинах, в целлофане (Балаково), в растворе спирт: глицерин (1:1), а затем сканируют с разрешением 300dpi на сканере HP Scanjet 3770 в окне для прозрачных материалов. Гели хранят в темноте.
Экстракция пероксидаз из различных тканей
Растительные пероксидазы высокостабильны, поэтому в состав экстрагирующего буфера входит только трис-НСl, рН 7.0. Добавление ЭДТА, меркаптоэтанола, хлорида калия, а также поливинилпирролидона не влияет на изменение активности фермента (рис. 1).
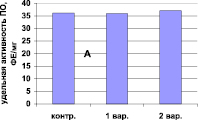
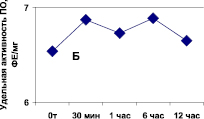
Рис. 1. Зависимость активности пероксидазы (А) от состава экстрагирующего буфера в хвое сосны обыкновенной и (Б) длительности экстракции ПО в листьях вяза обыкновенного (гладкого) Ulmus laevis L. Обозначения: А: контроль – экстракция в 0,1 М трис-НС1 буфере, рН 7,0; 1 вар. – контроль + ЭДТА + меркаптоэтанол + КС1; 2 вар – 1 вар. + 5 % поливинилпирролидон
Кроме того, можно отметить нейтральное влияние длительности экстракции фермента (от 30 мин до 12 часов) из сосновой хвои, считающейся труднодоступной для извлечения ферментов, на активность ПО. Полученный после центрифугирования супернатант обнаруживал стабильную активность и неизменность изоформ ПО в течение по крайней мере недели, при этом хранение препарата осуществлялось при 0 °С в присутствии 20 % глицерина.
Нами было установлено, что оптимум рН для ПО из корневой губки в присутствии АБТС в цитратном, ацетатном и буфере Мак-Ильвейна сдвинут в кислую сторону (рН 4,5–5,5). В трис-НСl буфере в присутствии бензидина оптимум рН составляет 7,0–7,5, а в буфере Мак-Ильвейна в присутствии пирокатехина – 6,0–6,5. В буфере Мак-Ильвейна оптимум рН более широкий, и активность пероксидазы в этой системе в 1,3 раза выше по сравнению с цитратным буфером (рис. 2). Можно предположить, что такое увеличение активности фермента связано с присутствием ионов неорганического фосфора в составе буфера Мак-Ильвейна. Активность ПО в культуральном фильтрате (КФ) корневой губки ниже активности фермента в цитратном буфере в 9,7 раз.
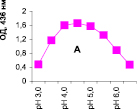
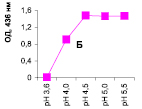
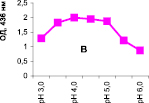
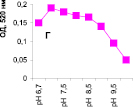
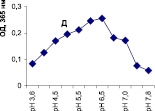
Рис. 2. рН-зависимость активности пероксидазы корневой губки в различных буферных системах. Обозначения: А – цитратный буфер; Б – ацетатный буфер; В, Д – буфер Мак-Ильвейна; Г – трис-НС1 буфер; А–В – субстрат АБТС, культуральный фильтрат корневой губки, Г – субстрат – бензидин, листья березы повислой in vitro, Д – субстрат пирокатехин; молярность всех буферов – 0,1 М
В связи с этим было изучено влияние HPO42--ионов на активность ПО корневой губки посредством добавления к цитратному буферу соли Na2HPO4. Добавление 0,5 мМ соли приводит к падению активности фермента до ее уровня в КФ. Увеличение концентрации соли до 1,0 и 2,0 мМ повышало активность ПО до уровня ее показателей в цитратном буфере. Дальнейшее повышение концентрации ионов фосфора (3,0 мМ) приводит к падению активности фермента. Таким образом, действие буфера Мак-Ильвейна высокоспецифично и отличается от простого влияния ионов фосфора на активность энзима. Отмечено, что влияние фосфата натрия проявляется только в условиях буферной системы, а его добавление в концентрации 1 мМ непосредственно к культуральному фильтрату штаммов (контроль) приводило к полной потере активности ферментного препарата.
Наивысшая активность пероксидазы проявляется при молярности трис-НС1 буфера (рН 7,0), составляющей 100 мМ и выше (рис. 3).
Методы определения активности пероксидаз
Принципы методов определения активности ПО основаны на появлении окрашенных продуктов при окислении субстратов под действием пероксидазы, регистрируемых по увеличению оптической плотности при соответствующей длине волны. Одной из важнейших характеристик любого фермента является специфичность его действия по отношению к субстрату. Анализ кинетических характеристик показал, что скорость окисления пирокатехина в КФ корневой губки (Km 29 мM) оказалась на порядок ниже скорости окисления АБТС (Km 40–60 мкМ для разных штаммов), хотя молекула пирокатехина (о-диоксибензол) является фенольным производным и по своему строению проще молекулы АБТС. Скорость окисления бензидина, измеренная в хвое сосны, почках дуба и микроклонах березы и сахарной свеклы, оказывается промежуточной: Km в 0,1 М трис-НС1 буфере при рН 7,0 равна 0,3 mM.
Чувствительность реакции очень высока, поэтому объем используемого ферментативного экстракта мал (1–10 мкл), а время измерения активности фермента составляет не более 3 мин. В случае обнаружения чрезмерно высокой ферментативной активности препаратов их разбавляют 0,1 М трис-НС1 буфером, рН 7,0 для сохранения нормальных кинетических кривых или используют удвоенное количество перекиси водорода (36 мкл). Бензидиновый метод определения активности ПО представляется оптимальным в силу ряда причин: долговременного хранения базового реактива (около года при 0 °С), оптимальных условий рН, доступности компонентов и простоты измерения.
Анализ изоферментного спектра пероксидаз
а) Проявление с использованием бензидина
Для выявления изоформ пероксидазы растительного происхождения применяют бензидиновый реактив при рН 7,0. Перед окрашиванием геля компоненты бензидинового реактива смешивают в соотношении 1:1. После заливки геля бензидиновым реактивом окраска зон пероксидазной активности проявляется в зависимости от количества нанесенного фермента в течение 5–130 минут (рис. 4–6). Иногда гель оставляют в проявляющем растворе на ночь в темноте.
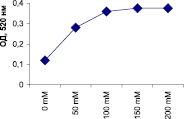
Рис. 3. Влияние молярности трис-НС1 буфера (рН 7,0) на активность пероксидазы из листьев березы повислой in vitro
Выявление изоформ пероксидазы бензидиновым методом позволяет получить достаточно широкий спектр зон фермента.
Этот метод, однако, не подходит для выявления зон гаптоглобина сыворотки крови, т.к. не выявляет всех изоформ фермента [33]. Поэтому для выявления фенотипов гаптоглобина использовали еще два метода.
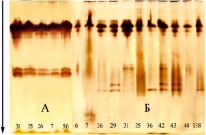
Рис. 4. Изоферментный спектр ПО в зимних почках (А; февраль) и распускающихся листьях (Б; март, образование на почках зеленого конуса) дуба черешчатого [34]. Плюсовые деревья Шиповой дубравы, Воронеж
По первому из них, предложенному Г.Х. Божко с соавт. [29], проявление геля проводят с использованием бензидинового реактива, исключающего присутствие спирта и уксуснокислого натрия: пластины геля выдерживают в течение 10 мин в 0,1 % бензидине в 10 % уксусной кислоте, после чего гели перемещают в кюветы с 0,03 % раствором перекиси водорода. Окраска ферментативных полос стремительно развивается, но после промывания в воде синяя окраска фермента переходит в коричневую, становится нестабильной, а гели – непригодными для сушки.
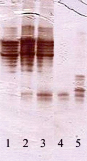
Рис. 5. Пероксидазный спектр растений-регенерантов березы различного происхождения в культуре in vitro [35]. Обозначения: 1–4 – карельская береза, узорчатая форма; 2 и 3 – карельская береза, триплоидная узорчатая форма; 4 – карельская береза, безузорчатая форма; 5 – береза повислая; 1 – каллус с регенерирующими побегами; 2 – регенерант; 3 – каллус; 4 – регенерант без корней; 5 – регенерант без корней
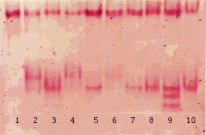
Рис. 6. Изоферментный спектр ПО в различных линиях трансгенной сахарной свеклы in vitro [36], выявленный с помощью бензидина. Обозначения: 1 – контроль; 2–10 – опыт
Другим способом выявления спектров гаптоглобина по пероксидазной активности является метод, предложенный Х.С. Рафиковым [30]. Он включает выдерживание гелей в растворе, содержащем 50 мг бензидина, 135 мг гваякола, 25 мл 10 % уксусной кислоты, перед применением раствор разводят водой в соотношении 1:5. К 10 мл бензидин-гваяколового реактива добавляют дополнительно 1 мл 0,2 М ацетата натрия, 0,1 мл 5 мM сульфата марганца и 1 каплю 50 % перекиси водорода. Время проявления составляет 10–20 мин. Реакцию останавливают 15 % уксусной кислотой. Учитывая сложность приготовления проявляющей смеси, в дальнейшем стали применять о-дианизидин, который обычно используют для выявления активности фермента в культуральной жидкости дереворазрушающих и других грибов – представителей белой и коричневой плесеней [33]. Исходя из литературных данных, проявляющая смесь для выявления пероксидазной активности для сыворотки крови состоит из 1 г о-дианизидина, 2,5 мл уксусной кислоты, 0,2 мл перекиси водорода в 50 мл воды. Зоны фермента приобретали красный цвет на фоне темно-вишневого фона геля (рис. 7).
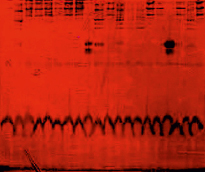
Рис. 7. Электрофореграммы гаптоглобинов сыворотки крови у 20 человек, больных артериальной гипертензией [37]. Обозначения: Типы гаптоглобинов: Нр 1–1–дорожки (слева направо) 1, 3–8, 11, 15–16, 18, 20; Нр 1–2 – дорожки 2, 10, 12–14, 19; Нр 2–2 – дорожки 9, 17
Способ выявления изоформ ПО с помощью о-дианизидина применялся нами и для сравнения спектра фермента из спящих и пробуждающихся почек дуба черешчатого. Результаты приведены на рис. 8.
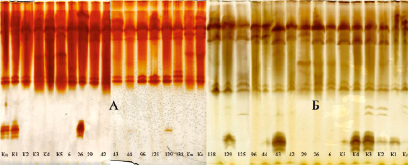
Рис. 8. Изоферментный спектр ювенильных листьев дуба черешчатого [36]. Обозначения: А – выявление изоформ ПО с помощью о-дианизидина; Б – выявление изоформ ПО с помощью бензидина; Кд – дерево колонновидной формы кроны из Семилукского питомника; К – контрольные деревья; № 6 – № 138 – плюсовые деревья дуба черешчатого позднораспускающейся феноформы
В руководстве Левитаса [28] описан метод выявления изоформ ПО с помощью 0,1 М гваякола (100 мл) в сочетании с 1–3 мл 3 % перекиси водорода. Однако автор указывает, что окраска нестойкая. Этот же автор описывает и бензидиновый способ проявления гелей на ПО-активность при рН 5,0, при этом гель фиксируют в метаноле.
Кроме того, существует способ выявления активности пероксидазной активности в гелях, описанный в статье С.И. Юренковой с соавт. [31] для электрофоретического выявления изоформ цитохром-с-оксидазы. Реакционная смесь для выявления зон фермента включает 1 мл 2 % спиртового раствора 1-нафтола, 25 мл водного раствора диметил-п-фенилендиамина солянокислого (20 мг), 0,1 М фосфатный буфер, рН 7,4 до 50 мл. Однако при проявлении гелей на цитохром-с-оксидазу выявлялись полосы активности, совпадающие с таковыми при выявлении пероксидазной активности. Такие результаты были получены у почек дуба черешчатого, а также у микроклонально размноженных растений вейгелы цветущей «вариегата», адаптированных к медному и солевому стрессу в ходе длительной ступенчатой адаптации на протяжении 120 суток (рис. 9).
Полученные результаты позволяют нам предположить, что 1-нафтол в данном методе является субстратом для проявления активности ПО, а не цитохром-с-оксидазы.
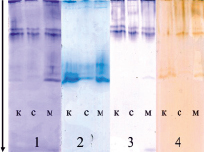
Рис. 9. Изоферментый спектр пероксидазы в микроклонах вейгелы цветущей «вариегата», адаптированных к солевому и медному стрессам. Обозначения: 1 и 2 – 40 и 120 суток адаптации, субстрат – 1-нафтол в фосфатном буфере; 3 и 4 – 40 и 120 суток адаптации, субстрат – бензидин; к – контроль, с – соль, м – медь. Стрелкой указано направление движения тока при электрофорезе
Изоформы пероксидазы могут быть выявлены разными способами, но при этом надо учитывать, что спектры фермента получаются различными, что связано со скоростью утилизирования субстрата теми или иными формами фермента. Представляется, что метод выявления активности фермента в гелях с помощью бензидина при рН 7,0 является более универсальным. При проявлении изоформ ПО с помощью о-дианизидина появляющиеся зоны менее стабильны, некоторые из них пропадают уже через несколько минут. Через сутки они практически полностью исчезают, тогда как в предыдущем случае, при правильном хранении, гели сохраняют окраску многие годы.
Таким образом, с помощью выявления изоформ ПО можно выявить отличия одного вида растений от другого, стадию регенерации растения, влияние стрессовых воздействий, онтогенетический возраст растения, независимо от того, древесное или травянистое растение берется для анализа.
Гаптоглобин является стрессовым белком крови человека и животных, обладающим пероксидазной активностью [38]. По его количеству можно определить степень тяжести заболевания [39]. Имеют значения и типы гаптоглобина: они связаны с определенным заболеванием. Выявление фенотипов гаптоглобина используется как для выбраковки больных животных, так и для получения потомства от генетически здоровых родителей [40, 41]. При выявлении типов гаптоглобина также используется о-дианизидин.
Заключение
Таким образом, из проанализированных способов определения активности и выявления изоферментного спектра пероксидазы оптимальным представляется метод, основанный на применении бензидинового реактива в нашей модификации, связанной с повышением рН реактива до нейтральных значений (7,0), тогда как в классических методиках рН сильнокислый (2,0). Для электрофоретического выявления изоформ фермента растений бензидиновый способ является наиболее удобным, дешевым, позволяющим получать стабильную окраску гелей.
Библиографическая ссылка
Землянухина О.А., Калаев В.Н., Воронина В.С. СРАВНИТЕЛЬНЫЙ АНАЛИЗ МЕТОДОВ ОПРЕДЕЛЕНИЯ АКТИВНОСТИ И ИЗОФЕРМЕНТНОГО СПЕКТРА ПЕРОКСИДАЗ РАЗЛИЧНОГО ПРОИСХОЖДЕНИЯ // Успехи современного естествознания. 2017. № 9. С. 13-22;URL: https://natural-sciences.ru/ru/article/view?id=36534 (дата обращения: 16.01.2026).
DOI: https://doi.org/10.17513/use.36534



