В последние десятилетия большие усилия ученых были направлены на выделение и изучение биологически активных природных компонентов морских организмов. Относительно небольшое количество изученных до сих пор морских организмов позволило получить тысячи новых химических соединений. Необычные условия морской среды, связанные с ее химическим разнообразием, обеспечивают возможности выявления новых активных веществ, используемых для создания биоактивных препаратов [1].
Полисахариды морского происхождения находятся в настоящее время на пике исследовательской активности мировых научных центров. Тем не менее они остаются недостаточно используемыми и требуют дальнейшего изучения для установления перспектив их потенциального применения. Имеются многочисленные данные о биологической активности полисахаридов морского происхождения, включая противоопухолевую, противовирусную, антикоагулянтную, антиоксидантную и противовоспалительную. Получение высококачественных препаратов непосредственно из морских объектов может быть сложным по своему технологическому воплощению. Для того чтобы использовать эти углеводы в БАД к пище, косметике и тем более в лекарственных средствах необходимы активные исследования [2].
Примером объектов подобных исследований могут служить морские животные, принадлежащие к семейству оболочников Tunicates. Интерес к их изучению связан с решением проблем фармакологии, рынка функциональных пищевых продуктов (ФПП) и даже производства целлюлозных наноматериалов. Это определяется разнообразием состава полисахаридов и их производных, таких как целлюлоза, аминосахара, белково-полисахаридные комплексы, гликозаминогликаны, хитин и хитозан, склеропротеин [3–5]. Взрослые особи оболочников имеют целлюлозо-полисахаридную ткань, образующую экзоскелет, называемый туникой. Оболочники – единственные животные, которые синтезируют целлюлозу. До сих пор не существует единого мнения о структуре и составе туники оболочников. Большинство исследователей считают, что основой их жестко структурированного экзоскелета является целлюлоза (более 60 % массы), имеющая высокую степень кристалличности [4]. По данным других авторов туника взрослой асцидии содержит в основном сульфатированный L-галактан, синтезируемый эпидермальными клетками [5].
В дальневосточных морях имеются значительные запасы асцидии пурпурной Halocynthia aurantium. Используемые части тела асцидии: мышечный мешок (мантия) – пищевой продукт в странах Юго-Восточной Азии, и внешняя защитная оболочка (туника) – источник БАВ. Туника содержит высокие концентрации каротиноидов – ксантофиллов, которые используются в виде БАД к пище, обладающей антиоксидантной, мембранотропной и иммуномодулирующей активностями [6]. После экстракции каротиноидов остается около 20 % отходов, представляющих собой обезжиренную и обезвоженную тунику. Основными компонентами этого вторичного сырья являются полисахариды. При этом жесткая структура полученного полуфабриката не позволяет использовать его без дальнейшей обработки. Предлагаемые способы использования его в качестве нерастворимых пищевых волокон представляются недостаточно эффективными (из-за невысокой сорбционной емкости) и рациональными (из-за ограниченных возможностей проявления биологической активности материала, содержащего комплекс биоактивных полисахаридов).
В связи с вышеизложенным целью представленной работы явилась разработка способов переработки туники асцидии пурпурной, обеспечивающих возможности ее эффективного использования в пищевой промышленности, а также изучение состава и свойств полученного продукта.
Материалы и методы исследования
Материалом исследований служила туника асцидии пурпурной Halocynthia aurantium. Сырую тунику измельчали, обрабатывали ацетоном в соотношении 1:5, после удаления экстрагента высушивали. Определение воды и белка проводили по общепринятым методикам [7]. Содержание углеводов определяли антроновым методом. Содержание гексозаминов, хитина и целлюлозы, определяли стандартными методами, описанными в работе [6]. Выделение и количественное определение растворимых глюканов проводили согласно методу, предложенному Anno [8]. Определение содержания растворенных веществ проводили на рефректометре «ИРФ-454Б № 821058». Содержание сульфат-ионов определяли турбидиметрически после гидролиза образцов в 4 н HCl, п осаждения ионов сульфата BaCl2 и регистрации степени помутнения раствора при 405 нм.
Частичный кислотный гидролиз образцов проводили с помощью 0,5 н трифторуксусной кислоты (ТФУ) при 37 °С в течение 5 час. Полный кислотный гидролиз проводили 2 н ТФУ при 100 °C в течение 7 час. Щелочную экстракцию полисахаридов проводили 0,1 н NaOH при 37 °С в течение 14 час. Моносахаридный состав определяли на углеводном анализаторе «Biotronik IC-5000» (Германия), на колонке «Shim-pack ISA-07/S2504». Обнаружение проводили бицинхониатным методом. ИК-спектры полисахаридов регистрировали для KBr-таблеток образцов на спектрометре «Vector (Bruker) 22» (Германия). Для определения типа гликозидной связи между остатками глюкозы на образцы полисахаридов, действовали рекомбинантной эндо-1,3-β–D-глюканазой из морской бактерии Formosa algae [9]. Анализ продуктов гидролиза проводили на колонке Zorbax-NH2 (4,6*250 мм, Германия) и хроматографе Agilent 1100. Детектирование осуществляли с помощью рефрактометра.
Результаты исследования и их обсуждение
Ранее было показано, что туницин, нерастворимая в щелочи волокнистая фракция, содержит не менее 60 % целлюлозы от сухой массы туники, а высокая степень устойчивости туники к химическому и ферментативному гидролизу связана с высокой степенью кристалличности присутствующей в ней целлюлозы и значительного количества протеогликанов, прочно с ней связанных [3]. Соответственно этому жесткая структура туники не позволяет выделить ее компоненты относительно мягкими способами, позволяющими сохранить нативную структуру и свойства, что является препятствием для их дальнейшего использования в качестве биоактивного ингредиента. В ряде работ приводится сравнение структурных образований туники с хитинглюкановым комплексом (ХГК) грибов и для их выделения применяют аналогичные приемы. Исходное сырье подвергают гидробаротермической обработке, варьируя давление, гидромодуль, температуру и концентрацию реагентов (NaOH, HCl, H2O2, Na2CO3) [10]. Это позволяет экстрагировать хитозан, но одновременно приводит к разрушению глюканов. Среди современных методов рекомендуют ультразвуковую (УЗ) обработку как способ снижения молекулярной массы полимеров путем расщепления отдельных химических связей [10]. Для удаления белковой составляющей ХГК используют ферментные препараты протеолитического и целлюлолитического действия [11]. Однако использование физико-химических и ферментативных методов, как по отдельности, так и при их комбинировании не позволяет существенно изменить свойства получаемых препаратов. Показана возможность применения таких препаратов в составе ФПП. Однако потенциал их биологической активности остается нераскрытым.
На первом этапе обработки туники обязательным условием является выделение концентрата каротиноидов органическими растворителями. В дальнейшем обезжиренную тунику подвергали последовательной обработке: 1 н NaOH при температуре 50 °C; УЗ обработке с помощью прибора Vibra-Cell при мощности излучения 130 ватт, частоте 20 кГ в течение 10 минут; гидролизу препаратом «ЦеллоЛюкс» (содержит целлюлазу, ксиланазу и глюканазу).
Физико-химические свойства полученного таким способом препарата представлены в табл. 1. Несмотря на определенные изменения свойств, считать эти препараты, последовательно обработанные щелочью, УЗ и ферментами, удобными и усвояемыми организмом нельзя. Поэтому для механической активации сырья был использован метод сверхтонкого измельчения. Для этого использовали центробежную мельницу непрерывного типа «ТМ» (совместная разработка ИХТТМ СО РАН и ООО «Новиц»), которая позволяет достичь тонкого измельчения мягких веществ и сухого сырья, механической активации материалов в высокодисперсном состоянии. Размер частиц полученного порошка составил 1–100 мкм. Результаты исследований микропорошка из туники асцидии также представлены в табл. 1.
Таблица 1
Физико-химические свойства препаратов из туники асцидии
|
Показатель |
Обезжиренная туника |
Обработка щелочью, УЗ, ферментолиз |
Микропорошок |
|
Внешний вид |
Чешуйки размером 1–3 мм |
Крупнозернистый порошок, размер частиц 0,5–1 мм |
Аморфный порошок, размер частиц 1–100 мкм |
|
Белок, % |
3,7 ± 0,7 |
2,0 ± 0,5 |
4,3 ± 0,5 |
|
Хитин, % |
4,8 ± 0,5 |
1,5 ± 0,5 |
7,4 ± 0,6 |
|
Целлюлоза, % |
61,3 ± 1,6 |
80,6 ± 4,3 |
62,6 ± 2,2 |
|
Глюканы, % |
12,5 ± 1,1 |
2,2 ± 0,2 |
17,2 ± 1,9 |
|
Сульфат-ионы, % |
3,7 ± 0,4 |
2,4 ± 0,7 |
4,6 ± 0,3 |
Как показывают результаты, представленные в табл. 1, после обработки щелочью, УЗ и ферментолиза полученный препарат сохраняет в своем составе в основном (~ 80 %) целлюлозу. Различия между крупноразмерным порошком и микропорошком туники свидетельствуют о сохранении соотношения природных компонентов, но обеспечивают в последнем случае более легкое извлечение и хитина, и глюканов. Известно, что ударно-истирающее воздействие, даже без добавок твердофазных химических реагентов, сопровождается изменением химического состава компонентов в результате разрыва ряда химических связей (даже таких прочных, как 3-гликозидные). Результатом механохимической обработки сырья является увеличение биологической доступности (в частности, водорастворимости) компонентов без участия растворителей в одну технологическую стадию [12].
При исследовании растворимости полученного микропорошка из туники асцидии (рис. 1) было показано повышение концентраций компонентов в жидкой фазе после экспозиции в различных средах по сравнению с измельченной обезжиренной туникой, полученной обычным путем. При этом рассматривали в растворе общее содержание сухих веществ и белка, которые возрастали в 1,5–2 и 2–3 раза соответственно. Наибольшую растворимость микропорошка наблюдали в щелочной среде, наименьшую – в кислой. При этом накопление в жидкой фазе как общего числа растворенных веществ, так и белка имело общую тенденцию.
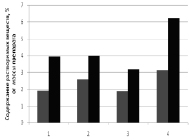
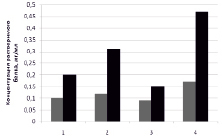
А Б
Рис. 1. Изменение растворимости препаратов из туники асцидии в разных средах после микроизмельчения. А – всех компонентов, Б – белка (1 – Н2О; 2 – 1 М NaCl; 3 – 0,2 н HCl; 4 – 1 н. NaOH). Серый – после обработки щелочью, УЗ, ферментолиза, черный – микропорошок
При проведении сравнительного анализа количественного и качественного состава полисахаридов и их моносахаридных составляющих в качестве пробоподготовки использовали кислотный и щелочной гидролиз. Полученные результаты представлены в табл. 2. Неполный кислотный гидролиз проводили с помощью 0,5 н ТФУ, в заданных условиях происходит отщепление молекул гликопротеинов и других комплексов легкогидролизуемых полисахаридов с выделением молекул полисахаридов. Увеличение концентрации ТФУ и температуры приводит к расщеплению полисахаридов до моносахаров. При мягком щелочном гидролизе 0,1 н NaOH происходит расщепление О-гликозидных связей, что позволяет выделить фракцию щелочерастворимых полисахаридов и также проанализировать их состав. Содержание кислоторастворимых полисахаридов в микропорошке туники составило 17,2 %, среди входящих в их состав моносахаров преобладала глюкоза, в значительно меньшем количестве обнаружены галактоза, фукоза, манноза и ксилоза. После экстракции микропорошка 0,1 н NaOH общее количество выделенных полисахаридов составило 34,8 % от массы образца. При анализе их моносахаридного состава был обнаружен только один пик, соответствующий глюкозамину. Наиболее вероятно, что, при щелочной экстракции происходит высвобождение хитина.
Таблица 2
Состав и содержание полисахаридов и их мономеров в микропорошке туники асцидии пурпурной
|
Полисахариды, % массы образца |
Моносахариды, % от суммы |
|||||
|
Кислотный гидролиз |
||||||
|
17,2 ± 1,9 |
Фукоза |
Ксилоза |
Манноза |
Галактоза |
Глюкоза |
Глюкозамин |
|
3,6 |
0,7 |
3,9 |
6,3 |
85,6 |
0 |
|
|
Щелочной гидролиз |
||||||
|
34,8 ± 3,2 |
0 |
0 |
0 |
0 |
0 |
100 |
Для определения типа гликозидной связи между остатками глюкозы, на полисахариды, полученные частичным кислотным гидролизом, подействовали рекомбинантной эндо-1,3-β–D-глюканазой из морской бактерии Formosa algae. Этот фермент предложено использовать для определения структуры β-1,3-глюканов [9]. В составе микропорошка туники асцидии обнаружен 1,3-β–D-глюкан в количестве 1,2 %. На рис. 2 представлена хроматограмма разделения продуктов исчерпывающего гидролиза кислоторастворимых полисахаридов. При гидролизе эндо-1,3-β-D-глюканазами происходит резкое падение молекулярной массы полисахарида на начальных стадиях реакции, а конечными продуктами реакции являются олигосахариды с различной степенью полимеризации. Анализ продуктов исчерпывающего ферментолиза этой фракции позволил обнаружить дисахарид ламинарибиоза и трисахарид ламинаритриоза, которые входят в состав 1,3-β–D-глюкана. Количественный расчет продуктов реакции показал, что они составляют 8,7 % от фракции полисахаридов, взятой в ферментативную реакцию, или 1,2 % от исходного образца.
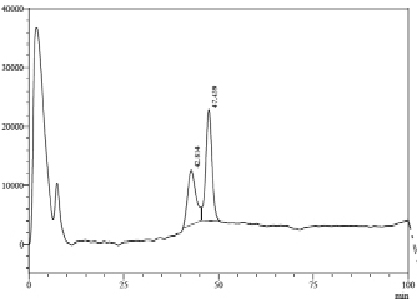
Рис. 2. ВЭЖХ продуктов исчерпывающего гидролиза кислоторастворимой фракции полисахаридов из туники асцидии пурпурной 1>3-b-D-глюканазой из морской бактерии Formosa algae. Пик 1 – ламинарибиоза, пик 2 – ламинаритриоза
Ранее в тканях животных β–D-глюканы не были обнаружены. Содержание b-D-глюкана в зернах злаковых культур колеблется от 0,4 до 0,8 %. Известно, что β–D-глюканы активируют местный иммунитет, защищая организм от вторжений антигенов, и системный иммунитет, уничтожая уже проникший внутрь организма чужеродный генетический материал, восстанавливая иммунный гомеостаз. Помимо выраженной иммуномодуляции β–D-глюканы обладают антиоксидантной, противоопухолевой, противовоспалительной, противоаллергической активностью [13].
Для анализа компонентов щелочерастворимой фракции использовали ИК-спектроскопию, в исследуемом образце показано наличие специфичных для хитозана полос в областях: 1384 см-1 и более сглаженной структуры спектра при 1250 см-1 (рис. 3).
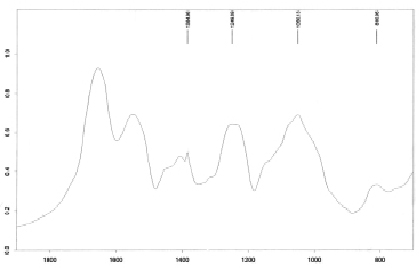
Рис. 3. ИК-спектр щелочерастворимой фракции углеводов микропорошка туники асцидии пурпурной
Аналогичные пики установлены для хитозана беспозвоночных и грибов. В ИК-спектрах исследуемого образца наблюдали поглощение при 1590–1750 см-1 (сопряжённые С=О группы, валентные колебания), а пик поглощения при1650 см-1 характерен для валентных колебаний С=О в амидах. В областях поглощения 1249 см-1 (S=O валентные колебания) и 810 см-1(C-O-S деформационные колебания), относящихся к области поглощения эфиров сульфата, наблюдали характеристические полосы. Области поглощения 1249 см-1 и 810 см-1 свидетельствуют о содержании сульфатных групп в образце.
Таким образом, результаты проведенных исследований полисахаридов туники Halocynthia aurantium согласуются с литературными сведениями о наличии в данной ткани уникальных по своему строению хитиноподобных сульфатированных полисахаридов, а также содержании целлюлозной составляющей, характерной для растительных организмов. Препараты из туники асцидии, прошедшие обработку методами щелочного гидролиза, УЗ и ферментативного гидролиза, содержат преимущественно целлюлозную составляющую, которую можно рассматривать в качестве нерастворимых пищевых волокон. Наиболее целесообразно применение в составе БАД к пище и ФПП микропорошка из обезжиренной туники асцидии, содержащего в своем составе растворимые полисахариды, сульфатированный хитозан и бета-глюканы, обладающие широким спектром биологической активности.
Библиографическая ссылка
Пивненко Т.Н., Позднякова Ю.М., Есипенко Р.В., Петрова Е.С. ИЗУЧЕНИЕ СОСТАВА И СВОЙСТВ ПОЛИСАХАРИДОВ МИКРОПОРОШКА ИЗ ТУНИКИ АСЦИДИИ ПУРПУРНОЙ // Успехи современного естествознания. 2017. № 9. С. 23-29;URL: https://natural-sciences.ru/ru/article/view?id=36535 (дата обращения: 18.11.2025).
DOI: https://doi.org/10.17513/use.36535



